组胺抑制自噬流介导SARA奶牛PMN黏附增强
李云飞,李聪宜,杨宇宸,冯献程,杜希良,李心慰,李小兵,王 哲,宋玉祥,刘国文
(吉林大学 动物医学学院,吉林 长春 130062)
亚急性瘤胃酸中毒(subacute rumen acidosis,SARA)也称为慢性酸中毒或亚临床瘤胃酸中毒,是高产奶牛中常见的一种代谢性疾病。GARRET等[1]的研究发现,在美国高达19%的早期泌乳奶牛和26%的哺乳期奶牛患有SARA。SARA导致的奶牛产奶量下降、生产效率降低、过早淘汰和死亡等每年所造成的经济损失高达5亿~10亿美元[2]。发生SARA时,瘤胃低pH环境会引起瘤胃菌群紊乱,导致革兰阴性菌(埃氏巨型球菌和大肠杆菌等)死亡和乳酸杆菌中的组氨酸脱羧作用增强,最终导致瘤胃液内内毒素(LPS)和组胺含量急剧上升[3-4]。SARA奶牛胃肠道屏障受损,LPS和组胺入血增加,导致高LPS和组胺血症,这可能与SARA奶牛系统性炎性反应有关[5]。
PLAIZIER等[5]总结了多个SARA诱导试验的结果,提出LPS、组胺或其他到达肝脏的细菌产物刺激了急性期反应蛋白从肝脏的释放并产生全身性炎性反应。SARA奶牛发生系统性炎性反应,是造成多个组织器官功能(肝脏、乳房、胰岛和脂肪等)紊乱的病理学基础,同时与SARA常继发的蹄叶炎和滑膜炎等无菌性炎症的发病有关[6]。组胺作为一种炎性介质,可以通过激活细胞表面组胺受体增加嗜酸性粒细胞和中性粒细胞的趋化性,在调节机体免疫反应方面具有重要作用[7-8]。
中性粒细胞(PMN)是机体固有免疫的第1道防线,在血液白细胞中占比最多且最先募集至局部炎症部位,在炎性信号放大中起着关键作用。在健康机体内,PMN处于静止状态,但当遇到细菌产物(LPS、组胺等)、细胞因子或趋化因子(TNF-α,GM-CSF,IL-8,IFN-γ等)时,就会引发PMN的活化以及黏附级联反应的起始[9]。有文献指出,酸中毒继发的蹄叶炎和滑膜炎局部组织中PMN浸润增多且PMN黏附相关蛋白L-选择素表达增加[10],说明了由酸中毒引起的PMN活化以及黏附功能的改变。此外,在炎性反应中PMN黏附相关蛋白β2整合素(白细胞功能相关抗原-1(CD11a)和巨噬细胞功能相关抗原-1(CD11b)是中性粒细胞上两个最丰富的β2整合素,也是主要介导PMN与内皮细胞黏附的主要黏附分子)与其受体的结合对PMN跨内皮迁移到达炎性反应部位至关重要[11-12]。
自噬是哺乳动物细胞内普遍存在的一种能够实现胞内物质降解和能量循环利用的现象,是调节PMN分化和实现细胞功能稳态的关键因素。自噬可通过病原体清除作用、抗原呈递作用、细胞因子生成和免疫反应等来参与炎性反应的调节[13]。例如:通过敲除NLRP3抑制自噬或抑制NLRP3炎性小体会增强PMN的募集和吞噬作用,从而改善细菌清除率并增加败血症小鼠的存活率[14]。此外,自噬在调节细胞黏附方面的作用也越来越多被关注,有研究指出,自噬的活化增加了含β1整合素的囊泡与微管相关蛋白1轻链3(LC3)染色的自噬泡的共定位,但是,自噬的抑制减弱了内在的含β1整合素的溶酶体的降解,减弱了β1整合素在细胞膜表面的重新表达,从而降低了细胞的黏附和迁移速率[15]。
目前,SARA奶牛机体炎性水平增加的内在分子机制尚不清楚。本研究通过SARA奶牛高组胺血症增强中性粒细胞黏附的角度解释了SARA奶牛炎性反应增加的原因并部分阐明了其内在分子机制,旨在为奶牛SARA致病机制的研究及其防控提供理论基础。
1 材料与方法
1.1 实验动物所用实验动物来源于长春市合隆镇某集约化奶牛养殖场。随机选取若干头胎次相同,体质量相差不大,体况相似,无明显其他疾病临床症状的经产奶牛。每隔1 h抽取瘤胃液,使用pH试纸检测瘤胃液pH值,如果瘤胃液pH值低于5.5且持续3 h以上,则确定为SARA奶牛。选取15头SARA奶牛与15头健康奶牛作为研究对象。连续10 d记录产奶量。使用无菌注射器通过乳静脉抽取以上2组奶牛外周静脉血50 mL。其中10 mL在离心机上3 000 r/min离心10 min,吸取上层血清,用作生化分析与ELISA试验,其余40 mL 用作外周血中性粒细胞分离。
1.2 主要仪器与试剂D-37520低温高速离心机购自德国Thermo Fisher公司;CO2细胞培养恒温箱购自日本三洋公司;通用型电泳仪购自美国BIO-Red公司;CD11a抗体购自北京博奥森公司;CD11b抗体、LC3A/B抗体、P62抗体均购自美国abcom公司;β-actin抗体购自美国Santa Cruz Biotechnology公司;组胺(Histamine)、鼠尾胶原蛋白Ⅰ型均购自北京索莱宝公司;氯奎磷酸盐购自Sigma-Aldrich公司;TNF-α、IL-6、IL-1β、内毒素结合蛋白(LBP)、触珠蛋白(Hp)和血清淀粉样蛋白(SAA)ELISA检测试剂盒均购自上海酶联生物科技有限公司;LPS检测试剂盒购自厦门鲎试剂生物科技有限公司;组胺ELISA检测试剂盒购自上海江莱生物科技有限公司;外周血中性粒细胞提取试剂盒购自天津灏洋生物公司。
1.3 血清指标检测血清LPS检测使用鲎试剂盒进行检测,严格按照说明书操作。利用人工合成的显色基质使鲎试剂产生的显色反应定量检测内毒素,在适宜的条件下(温度、pH值及无干扰物质)细菌内毒素会激活C因子并引起一系列酶促反应,激活凝固酶原后形成凝固酶,凝固酶可以分解人工合成的显色基质,使其分解为多肽和黄色的对硝基苯胺(pNA,λmax=405 nm),在一定时间内,pNA的生成量与细菌内毒素浓度成正相关。据此,可以定量供试品的内毒素浓度。
血清组胺、血清急性期反应蛋白LBP、Hp、SAA和细胞炎性因子TNF-α、IL-6和IL-1β等采用ELISA检测试剂盒进行检测,严格根据说明书进行操作。往预先包被抗体的微孔中依次加入样本和HRP标记的检测抗体,经温育并彻底洗涤,用底物TMB显色。TMB在酶催化下转化为蓝色,在酸的作用下变为黄色,颜色的深浅与样品中的待检测指标成正相关,用酶标仪在450 nm波长下检测吸光值,根据标准曲线计算样品浓度。
1.4 外周血中性粒细胞分离试验采用中性粒细胞提取试剂盒提取外周血中性粒细胞。其分离原理为密度梯度离心。在离心管内依次缓慢加入2∶1含量的不同悬浮密度的A液和C液,使其形成分离液面,然后加入同体积的新鲜抗凝血液,室温下800 r/min 离心30 min,取中性粒细胞层到离心管内,加入洗涤液,摇匀,1 000 r/min离心10 min,弃掉上清后加入红细胞裂解液重悬,10 min后1 000 r/min 离心10 min,弃掉上清后用RPMI-1640培养基洗涤2次,提取出中性粒细胞后进行黏附试验或免疫印迹试验;体外试验用RPMI-1640培养基适应培养2 h,然后给于刺激物刺激后收集细胞进行黏附试验或免疫印迹试验。
1.5 中性粒细胞黏附试验提前在96孔板的孔内加入50 μL 0.012 g/L用乙酸稀释溶解的Ⅰ型鼠尾胶原蛋白,在超净台内过夜晾干,使96孔板底部包被上Ⅰ型鼠尾胶原蛋白。分离出牛外周血中性粒细胞后,调整细胞为2×106个 /mL,向预先包被了Ⅰ型鼠尾胶原蛋白的培养孔内加入100 μL细胞悬液,37℃、5%CO2细胞恒温箱内培养4 h,用冷PBS溶液清洗3次,洗去未黏附的细胞,然后加入100 μL PBS,使用相差显微镜(400×)观察,随机选取视野拍照,并在相同大小面积内计算黏附的中性粒细胞数量。
1.6 蛋白免疫印迹试验分离出中性粒细胞后用含10%胎牛血清的RPMI-1640培养基培养平衡2 h,调整细胞为2 ×106个/mL,用6孔板培养,每孔3 mL,分组为空白组、组胺(10 μmol/L)组、氯奎(100 μmol/L)组、组胺+氯奎组,刺激4 h后收集细胞,用冷PBS缓冲液清洗2遍,用含有1%蛋白酶抑制剂的RIPA裂解液裂解细胞10 min,然后12 000 r/min离心10 min,弃掉沉淀,使用BCA法检测蛋白浓度,调整蛋白浓度后加入蛋白上样缓冲液,95℃加热5 min使蛋白变性,配置12% SDS-PAGE分离胶,按每孔30 μg蛋白上样,80 V电泳2 h,后通过湿转法将蛋白电转至PVDF膜上,用3% BSA溶液常温封闭3 h,封闭后将膜浸没与1∶1 000稀释的一抗中,4℃封闭过夜,用TBST溶液清洗3遍后,常温孵育二抗45 min,用TBST溶液清洗3遍后,在显影仪上检测蛋白表达量。

2 结果
2.1 健康奶牛和SARA奶牛血清生化指标检测通过对比健康奶牛和SARA奶牛的生产性能发现,相对于健康奶牛,SARA奶牛的日均产奶量有明显的下降(表1);SARA奶牛血液中葡萄糖和β-烃丁酸(BHBA)的浓度虽然有轻微增加但并没有统计学上的明显差异(表1);血液生化指标结果显示,相比于健康奶牛,SARA奶牛血清LPS的含量从不可检测升高到了0.22 EU/mL左右,而组胺浓度从平均1.12 μmol/L增加到了6.32 μmol/L(表1); SARA奶牛血清免疫学指标中, 急性期反应蛋白LBP、Hp和SAA的浓度显著性增高(表1),TNF-α、IL-6和IL-1β等促炎因子或趋化因子均显著性升高(表1)。以上结果表明,SARA奶牛存在高LPS和组胺血症以及系统性炎性反应。
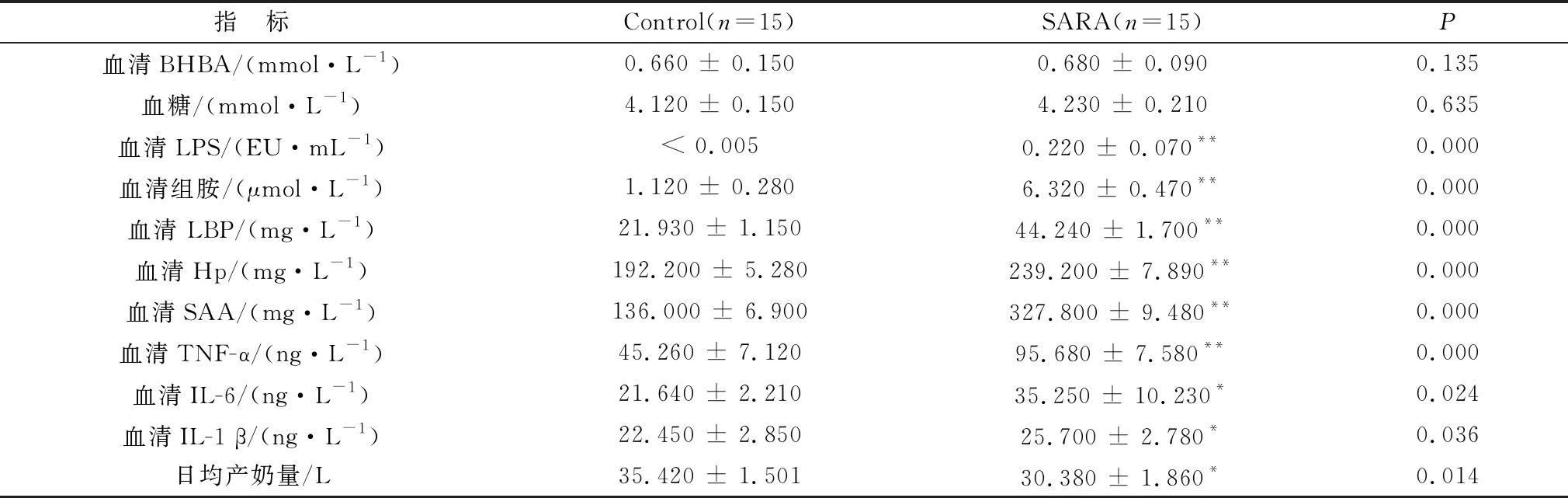
表1 健康和SARA奶牛相关血液指标
2.2 健康和SARA奶牛中性粒细胞黏附能力和黏附蛋白表达检测为了探究发生SARA时血液中PMN的黏附功能变化,本研究检测了SARA奶牛PMN的黏附功能和主要相关黏附蛋白的表达变化。通过黏附试验发现,发生SARA的奶牛其PMN黏附数量明显多于健康奶牛(图1A), 黏附细胞数量约增加了0.5 倍(P<0.01)(图1B);通过Western blot试验检测了PMN主要相关黏附蛋白的表达水平,结果显示与健康奶牛相比,发生SARA的奶牛主要相关黏附蛋白CD11a和CD11b表达显著性升高(图1C),CD11a的表达量约为健康组奶牛的1.5倍(P<0.01)(图1D),而CD11b约为健康奶牛的4倍(P<0.01)(图1E)。综上所述,奶牛发生SARA时,外周血中性粒细胞黏附增强,主要相关黏附蛋白表达增多。
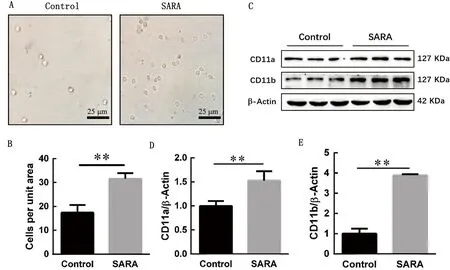
A.中性粒细胞黏附能力检测(400×);B.A中黏附的中性粒细胞数定量分析;C.中性粒细胞主要黏附分子CD11a和CD11b的免疫印迹结果;D.C中的黏附分子CD11a的相对表达水平;E.C中的CD11b的相对表达水平
2.3 SARA奶牛中性粒细胞自噬流检测自噬参与了细胞的多种生理性功能,为了解奶牛在发生SARA时PMN的自噬水平,本研究通过Western blot试验检测SARA奶牛与健康奶牛PMN自噬流情况。结果如图2A所示,与健康奶牛相比,SARA奶牛PMN内LC3-I向LC3-II的转变有明显增加,但LC3-II在胞内并未被迅速降解而是在细胞内累积(P<0.05)(图2B)。与此同时,自噬降解底物 P62在SARA奶牛PMN内累积升高(P<0.05)(图2C)。综上所述,奶牛发生SARA时中性粒细胞自噬过程受阻,自噬降解过程在一定程度上减弱即自噬流被阻断。

A.SARA奶牛和健康奶牛中性粒细胞相关自噬标记分子蛋白免疫印迹图;B.LC3-II/LC3-I蛋白的相对表达水平;C.P62蛋白的相对表达水平
2.4 组胺通过阻断PMN自噬流引起PMN黏附增强为了探明奶牛发生SARA时引起PMN功能改变的具体影响因子,本研究分离了健康奶牛的外周血PMN,在体外给于病理浓度的LPS和组胺,对比两者对PMN的黏附和激活作用。黏附试验结果显示,给予病理浓度(7 μmol/L)的组胺刺激4 h后,PMN的黏附数量显著性增加,而病理浓度(0.4 EU/mL即0.04 μg/L)的LPS并没有引起显著性的黏附变化(图3A)。单独组胺刺激与组胺和LPS共同刺激均引起了中性粒细胞的黏附增强(P<0.01),而LPS与对照组并没有显著性差异(P>0.05)(图3B)。说明奶牛发生SARA时由瘤胃进入外周血的高浓度组胺引起了中性粒细胞黏附状态的改变。为了证明自噬流在组胺引起的PMN黏附增强中的作用,本研究通过使用自噬流阻断剂氯奎(CQ)来研究PMN自噬与细胞黏附之间的关系。黏附试验结果发现,通过CQ阻断自噬流后,与对照组相比发生黏附的PMN数量明显增加(图3C),其增强PMN黏附能力的作用(P<0.01)甚至要高于组胺的刺激作用(P<0.01)(图3D)。综上所述,组胺增强中性粒细胞黏附能力的作用是由自噬流抑制所介导的。
3 讨论
SARA是一种常见的奶牛代谢性疾病,给奶牛生产养殖业造成了巨大损失[2]。SARA会造成奶牛多个器官或组织功能紊乱,严重影响奶牛产奶量、乳品质和繁殖率,每年因SARA造成的经济损失高达5亿~10亿美元[2]。本研究结果发现SARA奶牛与健康奶牛相比,平均日产奶量有明显下降(表1)。GOZHO等[6]研究结果证实在泌乳中期的奶牛中,谷物诱导的SARA会增加革兰阴性细菌的溶解并激活奶牛系统性炎性反应。SARA奶牛血液组胺和LPS水平升高可以激活肝脏常驻巨噬细胞——库否细胞,进而通过NF-κB信号通路和JNK-AP1信号通路促进转录因子NF-κB和AP-1的入核和下游促炎因子(如TNF-α、IL-1和IL-6等)的表达和分泌导致肝脏炎性反应增加和肝损伤。肝损伤会进一步促进急性期反应蛋白如CRP、SAA和Hp等的分泌入血,引起一定程度的系统性炎性反应。SAA与Hp由肝脏合成,他们与LBP常被用作系统性炎性反应特别是乳腺炎的指标[16-17]。在GOZHO等[6,18]的研究中,利用不同的方法诱导奶牛SARA后,发现血清淀粉样蛋白A(SAA)和触珠蛋白(Hp)浓度显著性增加,这与本研究结果一致。此外,SAA的合成可以通过IL-6或TNF-α的释放来诱导,但是要合成触珠蛋白,这2种细胞因子都是必需的[16]。本研究结果显示,与SAA在血清中的增高相一致,SARA奶牛血清中的IL-6和TNF-α也有显著性升高,而且,细胞趋化因子IL-1β的含量也随之增高。以上结果证实了奶牛发生SARA时,血清中主要急性期蛋白与炎性细胞因子分泌增加,说明了奶牛机体内出现了炎性反应,并且奶牛的生产性能受到了影响。

A.0.04 μg/L LPS或7 μmol/L组胺刺激4 h后中性粒细胞黏附能力检测(400×);B.A中黏附的中性粒细胞数定量分析;C.通过100 μmol/L氯奎抑制PMN自噬流或组胺刺激后中性粒细胞黏附能力检测(400×);D.A中黏附的中性粒细胞数定量分析
图3 体外自噬与黏附关系的探究
奶牛发生SARA时,胃肠道屏障功能受损,胃肠内由细菌产生的LPS和组胺等会渗透进入血液,引起奶牛的免疫细胞活化,同时引起机体的炎性反应水平增加。NOCEK等[19]证实,SARA奶牛机体升高的炎性反应水平不仅仅是由于血液中升高的LPS,组胺的易位可能是导致炎症水平增加的主要原因。本研究结果证实,奶牛发生SARA时其外周血中的LPS和组胺浓度升高。但是,在病理浓度的LPS或组胺作用下,组胺引起了PMN黏附能力的改变,LPS并没有引起这些变化,这可能是由于肝脏对于LPS的屏障作用导致血液中的LPS(0.4 EU/mL=0.04 μg/L)不足以引起免疫细胞的活化。ANDERSEN等[20]甚至在SARA奶牛外周血中没有检测到LPS的存在。而SARA时瘤胃内升高的组胺则通过NF-κB途径诱导了牛瘤胃上皮细胞的炎症反应[21]。以上证据说明SARA奶牛机体内炎症水平的增加以及PMN黏附能力的改变主要由血液中升高的组胺引起。
PMN是最常见的白细胞类型,是最先到达炎性反应部位的免疫细胞,在调节机体炎性反应水平方面具有重要作用,其功能的改变往往与机体炎性反应有关。数据表明,奶牛发生SARA时,瘤胃内左旋乳酸升高入血,可诱导PMN通过NET依赖性机制黏附于血管内皮细胞[22]。本研究结果发现,SARA奶牛PMN黏附能力较之于健康奶牛有明显升高。介导PMN与内皮细胞黏附的CD11a和CD11b蛋白的水平增加,这或许与SARA奶牛炎性反应水平有关,因为在正常情况下,PMN处于静止状态,其与内皮细胞的黏附处于较低水平,发生SRAS时PMN被免疫原性物质激活,启动了黏附级联反应,活化的PMN就会与血管内皮细胞发生黏附,导致组织浸润增加,并分泌炎性因子,引起奶牛机体的炎性反应。此外,PMN的自噬功能在影响细胞功能方面的作用也越来越多的被报道。本研究探索了SARA奶牛PMN的自噬状态,通过Western blot检测自噬相关蛋白LC3和P62的表达水平。在自噬过程中,p62与LC3结合并优先被自噬体溶酶体降解。但本研究发现作为自噬流早期水平的标志性分子LC3-Ⅰ向LC3-Ⅱ的转变显著性增加,但是,LC3-II和作为自噬降解底物的P62却在细胞内累积,说明SARA奶牛自噬的过程受到了阻断。以上结果说明,奶牛发生SARA时,外周血PMN功能发生了改变,具体表现为黏附能力增强,黏附相关蛋白表达增多,自噬流被阻断,自噬降解过程受阻。
细胞的内吞作用和膜蛋白的循环作用有助于调节细胞的黏附与迁移,整合素是参与细胞与细胞外基质(ECM)之间相互作用的黏附分子家族,在PMN上介导PMN与内皮细胞的牢固黏附,整合素可通过细胞内吞作用实现从细胞膜到胞内囊泡的转运,囊泡内的整合素可以与溶酶体结合实现整合素的清除或降解为小分子物质重新用于合成整合素[23]。VÉRONIQUE等[15]的结果显示抑制HeLa细胞的自噬后,细胞的内吞作用和膜循环作用减弱,β1整合素的降解过程受阻,β1整合素在细胞膜表面的重新分布增多,细胞黏附与迁移增多。在本研究中,利用氯奎(CQ)抑制了中性粒细胞自噬降解过程,其黏附能力显著性增强。以上结果说明,中性粒细胞自噬降解受抑制后,细胞的内吞作用和黏附蛋白的膜循环作用受到干扰,引起黏附分子的降解作用受阻,黏附分子在细胞膜上累积,引起细胞黏附能力的升高。
综上所述,本研究证实了奶牛发生SARA时,奶牛机体系统性炎性反应水平增加,是SARA影响奶牛生产性能的重要因素。 并进一步证明了SARA引起的系统性炎性反应与高组胺血症抑制自噬流导致的PMN黏附和活化增强有关。本研究结果可为SARA奶牛致病机制研究和防治产品研发提供理论依据。

