环状RNA hsa_circ_0070421对甲型流感病毒复制的影响
张玳宁,于秀华,张 舒,段 铭*
(1.吉林大学 动物医学学院 人兽共患病研究所 人兽共患病研究教育部重点实验室,吉林 长春 130062;2.吉林大学 第一医院,吉林 长春 130021)
环状RNA(circular RNA,circRNA)是近些年才发现的一种新的内源性非编码RNA,具有独特的闭合环状结构,由前体mRNA反向剪接产生[1]。大约40年前,这些环状转录本被认为是mRNA剪接的副产物[2],但随着RNA测序技术的发展,现在已发现数以千计的circRNA。已有的研究结果表明,circRNA表达具有较高的组织特异性和发育阶段特异性,且在基因表达调控中具有重要的生理功能[3],在癌症、心血管疾病、中枢神经系统疾病等生理病理进程中扮演了重要的角色。
甲型流感病毒(influenza A virus,IAV),属于正黏病毒科,单股负链RNA病毒,对人类及动物的生命健康具有重大危害,但是宿主编码的circRNA在IAV与宿主细胞相互作用中的功能及其机制尚不清楚[4]。本实验室前期基于基因芯片技术分析circRNA在IAV感染A549细胞中的表达,发现hsa_circ_0070421的表达显著上调[5]。本研究探讨了hsa_circ_0070421在IAV感染过程中的表达及其功能,研究结果有助于认知circRNA在IAV与宿主相互作用中的作用。
1 材料与方法
1.1 主要试剂聚肌苷酸胞苷酸(Poly I:C)和大肠杆菌O55:B5的脂多糖(LPS)购自Sigma-Aldrich公司;Cisplatin购自MedChem Express公司;超纯琼脂糖凝胶(UltraPure Agarose)购自Invitrogen公司;抗IAV-M1抗体购自Abcam公司;抗β-actin抗体购自Cell Signaling公司。
1.2 细胞培养A549和THP-1细胞在含有10%胎牛血清(FBS)(HyClone)和100 U/mL青霉素和100 mg/L链霉素的RPMI-1640(Corning)中培养;将MDCK、A172、Caco-2和SH-SY5Y细胞维持在含10% FBS的DMED(Corning)中培养,并置于37℃、4%CO2培养箱中生长。
1.3 病毒和病毒感染将流感病毒株A/PR/8/34(H1N1)在11日龄鸡胚尿囊腔中增殖。用PBS洗涤细胞,并用感染复数(MOI)=3的病毒与含有1 mg/L TPCK处理的胰蛋白酶(Sigma-Aldrich)的培养基一起孵育1 h,吸附后,吸出上清液,将细胞培养指定的时间。
1.4 细胞处理A549细胞铺24孔板,次日细胞密度达到60%~80%,分别加入LPS和Cisplatin,使其终质量浓度分别为1 mg/L和10 μmol/L,24 h后提取总RNA。
1.5 质粒、siRNA和转染基于pHB-circBasic载体(HanBio)构建hsa_circ_0070421的真核表达质粒[5]。抑制hsa_circ_0070421表达的siRNA由上海吉玛公司合成,序列为5′-GCUGCACAGGAUAACCACCTT-3′,根据Lipofectamine RNA-iMAX试剂(Invitrogen)说明书进行转染。质粒和Poly I:C的转染按照Lipofectamine LTX reagent转染试剂(Invitrogen)使用说明书进行。以6 孔板为例:用250 μL Opti-MEM基础培养基将所需量转染试剂稀释、混匀后静置5 min,用250 μL Opti-MEM基础培养基将所需要的质粒或poly I:C稀释,混匀后静置5 min,然后将处理好的转染试剂和质粒1∶1混匀,静置10 min后将混合液加入到培养板中,细胞置于CO2细胞培养箱中继续培养。
1.6 RNA的提取、实时荧光定量PCR(qPCR)和半定量RT-PCR使用TRIzol试剂(Invitrogen)提取细胞总RNA,按照TaKaRa反转录试剂盒说明书进行反转录,反转录前42℃ 2 min反应,去除基因组DNA。RNA反转录的反应条件:37℃ 15 min,85℃ 5 min。取1 μL反转录产物使用FastStart Essential DNA Green Master(Roche)进行实时荧光定量PCR,反应程序:95℃ 10 min预变性;95℃ 10 s,60℃ 15 s,72℃ 20 s,共40个循环。对于半定量RT-PCR,反应条件:94℃ 5 min预变性;94℃ 30 s,60℃ 30 s,72℃ 30 s,共35个循环。均以GAPDH为内参基因,引物序列见表1。PCR产物通过1.5%琼脂糖凝胶电泳检测,电泳条件为电压100 V,10 min,在凝胶成像仪(UVP EC3 Imaging System)上观察结果。

表1 PCR引物序列及扩增片段长度
1.7 空斑试验将MDCK细胞以2.5×105个/孔的密度均匀铺于12孔细胞培养板中,加入梯度稀释的细胞培养上清,37℃孵育2 h,弃掉上清,加入1%的超纯琼脂糖凝胶,在37℃、4%的培养箱中培养2~3 d后,利用结晶紫进行活细胞染色,统计空斑数量,计算获得病毒样品的感染性滴度(PFU/mL)=(每孔平均空斑个数×病毒稀释倍数)/每孔病毒接种量(mL)。
1.8 蛋白提取和Western blot收集处理后的A549细胞并提取总蛋白,在10% SDS-PAGE凝胶中加样电泳,每组含等量蛋白样品。电泳后转膜至PVDF膜,在5%脱脂奶粉中进行封闭。按照抗体说明书制备一抗IAV-M1和β-actin,在4℃冰箱内与膜孵育。二抗孵育后,利用 ECL化学发光显色(Pierce),通过 ECL 化学发光成像系统采集信号,用 Image J 软件对电泳图进行灰度值的分析。

2 结果
2.1 IAV感染后宿主hsa_circ_0070421的表达显著上调前期circRNA组学数据提示hsa_circ_0070421与IAV感染密切相关。用收敛引物和分散引物分别扩增cDNA和基因组中的hsa_circ_0070421,结果cDNA中的hsa_circ_0070421为环状结构(图 1A)。取IAV感染不同时间点样品用荧光定量PCR方法再次验证,结果IAV感染A549细胞后宿主hsa_circ_0070421的表达随感染时间的延长逐渐增加,在感染后24 h表达量最高(图 1B),而不同MOI 的IAV感染A549细胞后hsa_circ_0070421的表达与病毒感染剂量呈显著正相关(图 1C),说明hsa_circ_0070421的表达与IAV感染复制密切相关。选取不同器官或组织来源的5种人源细胞系,应用半定量RT-PCR检测其hsa_circ_0070421的表达水平。结果如图 1D所示,hsa_circ_0070421在研究选取的细胞系中表达水平有所差异,除Caco-2外,其他4种细胞系中均可检测到该circRNA的表达,且表达量高低与病毒M基因的表达呈正相关。以上结果表明,hsa_circ_0070421的表达即呈现出细胞类型的广泛性,也兼具特异性,并且其表达量与IAV的感染复制密切相关。

A.收敛引物和分散引物扩增的hsa_circ_0070421电泳图;B.IAV(PR8)感染A549细胞不同时间对hsa_circ_0070421表达的影响; C.不同MOI 的IAV(PR8)感染A549细胞后24 h对hsa_circ_0070421表达的影响;D.不同细胞系感染IAV(PR8) 24 h后 hsa_circ_0070421的表达。*P<0.05;**P<0.01;***P<0.001。下同
2.2 Poly I:C和IFN有效诱导hsa_circ_0070421表达为了研究IAV感染后hsa_circ_0070421表达的诱因,分别使用聚肌苷酸胞苷酸(polyinosinic:polycytidylic acid,Poly I:C)、干扰素-β(interferon,IFN-β)、细菌脂多糖(lipopolysaccharides,LPS)、凋亡诱导剂Cisplatin和血清饥饿法处理A549细胞,结果如图2A所示,Poly I:C处理A549细胞后,hsa_circ_0070421的表达在12 h极显著增加;IFN-β刺激A549细胞后,hsa_circ_0070421的表达随时间的延长极显著增加(图 2B);LPS刺激细胞后,hsa_circ_0070421表达的上调幅度远小于Poly I:C和IFN-β的刺激(图2C);Cisplatin(10 μmol/L)和血清饥饿处理细胞后,hsa_circ_0070421表达水平不受影响(图 2D)。这些数据表明,IAV复制过程中产生的大量病毒RNA及其所激活的Ⅰ型IFN相关的抗病毒天然免疫应答可能是hsa_circ_0070421表达的主要诱因。
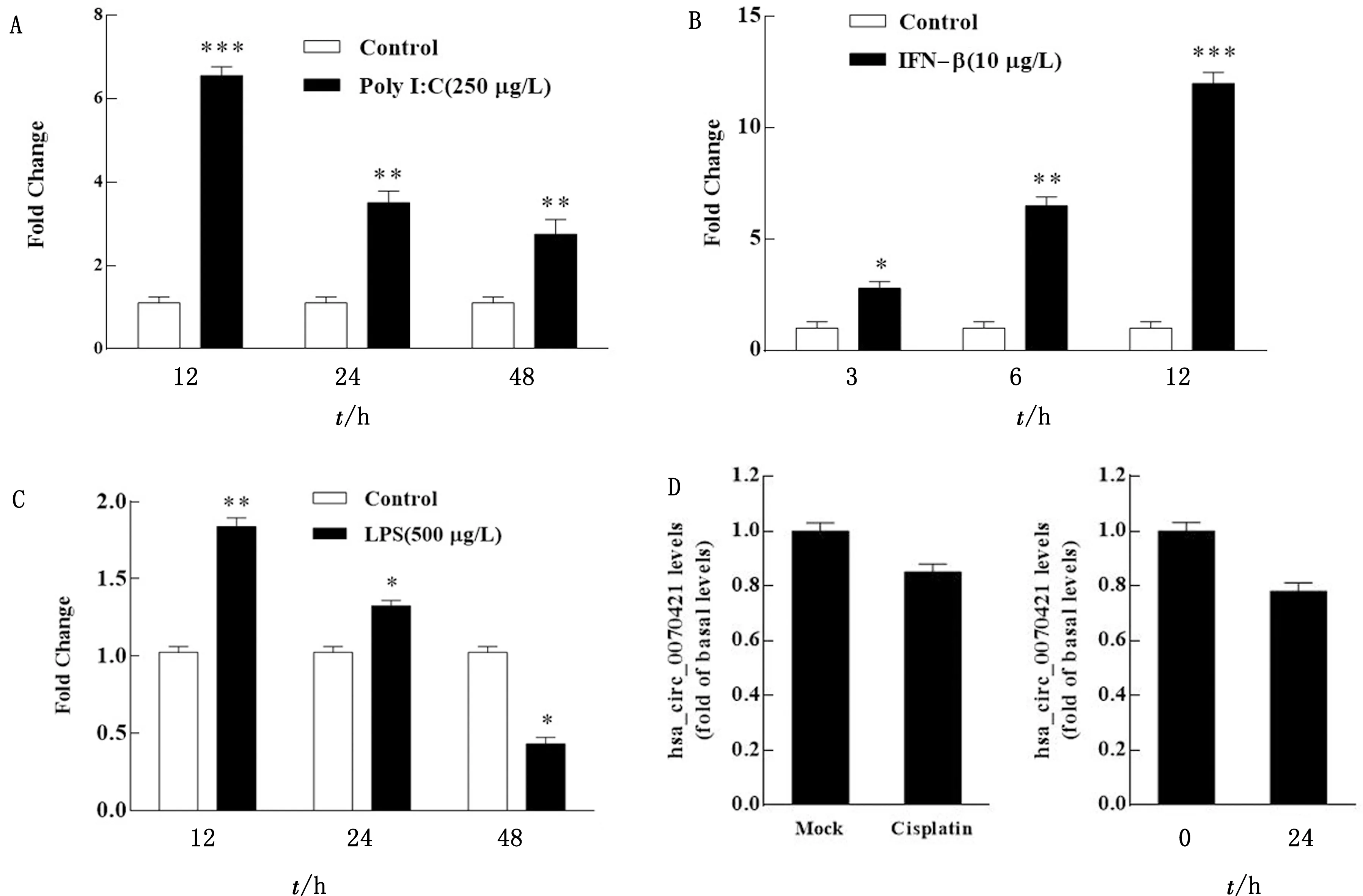
A.Poly I:C转染A549细胞不同时间后hsa_circ_0070421的表达;B.IFN-β刺激A549细胞不同时间后hsa_circ_0070421的表达;C.LPS处理A549细胞不同时间后对hsa_circ_0070421的表达;D.Cisplatin和血清饥饿处理A549细胞24 h后hsa_circ_0070421的表达
2.3 hsa_circ_007042抑制IAV复制为了探究hsa_circ_0070421对IAV复制的影响,应用过表达和用siRNA敲低hsa_circ_0070421的方法处理细胞,并在病毒mRNA、蛋白和病毒粒子水平上检测hsa_circ_0070421对病毒复制的影响。结果显示,与对照组相比,hsa_circ_0070421的过表达显著抑制 IAV M基因和M1蛋白的表达,且病毒的感染滴度降低;反之,与用对照siRNA转染的细胞相比,转染hsa_circ_0070421 siRNA的A549细胞可促进IAV M基因和M1蛋白的表达复制,且病毒的感染滴度升高(图3)。上述结果表明,hsa_circ_0070421具有抑制IAV复制的功能。

A.hsa_circ_0070421在mRNA水平对IAV复制的影响;B.hsa_circ_0070421在蛋白水平对IAV复制的影响;C.hsa_circ_0070421对IAV子代病毒粒子产生的影响
3 讨论
1976年,人们首先在植物类病毒中发现了共价闭合的circRNA[6],之后,研究人员又在动物细胞和真菌酵母中发现了circRNA[7-9],但鉴于生物技术的局限性和结构的特殊性,circRNA在当时被认为是RNA错误剪接或剪接过程中形成的副产物。直到2012年,SALZMAN等[10]对circRNA进行了比较全面系统的研究报道,人们才开始重新认识并深入研究这一类“生物暗物质”。近年来,circRNA的生物学功能已成为生命科学领域研究的热点之一。已有的相关研究表明,circRNA发挥生物学功能的作用机制丰富多样,除了作为miRNA海绵起作用外,还可以调节mRNA可变剪接、作为翻译的模板、调节rRNA和tRNA的生物发生和作为装配蛋白质复合物的支架[11]。值得注意的是,不同circRNA在特定疾病背景下异常表达,表明其与人类疾病的发生和发展密切相关,比如癌症、心血管疾病、神经系统疾病、代谢病和病原感染等。
近几年,研究人员对宿主编码circRNA在病毒感染宿主细胞过程中的作用也展开了相关的研究。基于芯片或RNA高通量测序技术,人们已经研究了10余种病毒感染后宿主circRNA表达模式的改变,包括单纯疱疹病毒1型、人巨细胞病毒、乙肝病毒、猪传染性胃肠炎病毒、猪流行性腹泻病毒、马立克病毒和J亚群禽白血病病毒等[12-18]。这些组学数据不仅证实病毒感染能改变宿主circRNA的表达模式,而且说明circRNA在病毒与宿主的相互作用中扮演重要的角色,既有可能是宿主抗病毒感染的工具,也有可能成为病毒重塑有利于自身复制的细胞内微环境的利器。上述差异表达circRNA在病毒感染致病或宿主抗病毒应答中的功能及其分子机制的研究尚未广泛展开,亟待探究。
源于本实验室前期组学数据的遴选结果,选择差异表达显著上调的hsa_circ_0070421作为研究目标。本研究首先从IAV感染后不同时间点、不同毒株和不同MOI多角度验证IAV感染与宿主hsa_circ_0070421表达的关联。在5种细胞系中检测了hsa_circ_0070421的表达,结果显示该circRNA广泛表达于多种器官或组织来源的细胞中,但其生物学功能在不同细胞类型中可能不尽相同。随后利用凋亡诱导剂和血清饥饿排除了hsa_circ_0070421表达上调与病毒感染时的其他细胞表型或极端的生理条件之间的关联。Poly I:C是双链RNA的类似物,是一种常用的Toll样受体3激动剂和IFN诱导剂,可用来模拟RNA病毒复制过程中的病毒RNA中间体。Poly I:C和IFN-β的处理显著诱导hsa_circ_0070421表达,表明该circRNA表达是病毒RNA在细胞内累积并激活从模式识别受体到Ⅰ型IFN相关抗病毒免疫应答的产物,可能具有类似IFN刺激基因的功能。功能学试验显示hsa_circ_0070421能够抑制IAV复制和增殖,更好地佐证了其是宿主抗病毒天然免疫应答的一员,但其抗病毒作用的分子机制尚需在后续的研究中进一步阐明。
综上所述,本研究发现和鉴定了hsa_circ_0070421抗IAV复制的新功能,研究结果丰富了对circRNA功能的理解,为探究IAV与宿主相互作用提供了新的视角。

