猪血凝性脑脊髓炎病毒感染对小鼠脑内星形胶质细胞的影响
徐荣艺,石俊超,张 竞,高 蕊,李 姿,贺文琦,高 丰
(吉林大学 动物医学学院,吉林 长春 130062)
猪血凝性脑脊髓炎是由猪血凝性脑脊髓炎病毒(porcine hemagglutinating encephalomyelitis virus,PHEV)感染所致的一种急性、高度传染性疾病。PHEV为冠状病毒科、β冠状病毒属成员,主要侵害3周龄以内的仔猪,临床以仔猪呕吐和神经症状为典型特征,死亡率可达100%[1]。现已发现有些PHEV毒株可感染成年猪,呈呼吸道感染为主的急性流感样症状[2]。PHEV具有典型的噬神经特性,主要侵害宿主的中枢神经系统,引发非化脓性脑脊髓炎[3]。由病毒引起的脑脊髓炎是导致宿主发病死亡的重要原因[4],然而目前仍缺乏有效的疫苗及特异性的药物。因此对于PHEV致病机制的研究尤为迫切且意义重大。星形胶质细胞是中枢神经系统(central nervous system,CNS)中含量最多的一类细胞,担负着神经递质的转运与再循环、离子稳态、能量代谢、感染防御以及维持血脑屏障完整性等众多功能[5]。已有研究报道某些噬神经病毒例如水泡性口炎病毒(VSV)、单纯疱疹病毒(HSV)等感染过程中,星形胶质细胞发生活化[6-8]。然而,PHEV感染后是否会引起星形胶质细胞活化以及活化的星形胶质细胞所发挥的作用还未见有相关的报道。本研究表明,PHEV感染过程中小鼠脑内星形胶质细胞发生大量活化,有趣的是PHEV并不能感染星形胶质细胞,表明星形胶质细胞的活化并非病毒直接感染引起。后续试验将从星形胶质细胞活化的机制及活化的星形胶质细胞在病毒感染过程中发挥的作用方面展开研究,研究结果可为进一步阐明PHEV的致病机制奠定基础。
1 材料与方法
1.1 病毒及来源猪血凝性脑脊髓炎病毒株PHEV-CC14(GenBank登录号:MF083115)从自然感染发病仔猪脑组织匀浆分离获得,并由本实验室保存。

1.3 实验动物3周龄雌性BALB/c小鼠,购自辽宁长生实验动物有限公司。小鼠自由采食饮水,试验组小鼠通过滴鼻接种0.03 mL PHEV病毒液(TCID50为10-4.2/0.1 mL),对照组小鼠通过滴鼻途径接种同样剂量的PBS (0.01 mol/L,pH 7.4)。分别于接毒后1~5 d相应时间点处死小鼠,冰上取出脑组织进行后续qRT-PCR、Western blot检测及石蜡切片制作。
1.4 RT-PCR及荧光定量PCR取采集的小鼠脑组织,根据TransZol Up Plus RNA Kit试剂盒说明书提取总RNA,测定浓度后将其反转录为cDNA。查找GenBank中GFAP和GAPDH基因序列,使用Primer Premier 5.0软件设计相应的引物(表1),将引物序列发送至库美生物合成。使用rTaq酶进行常规PCR后凝胶电泳观察条带大小及特异性,使用QuantStudioTM3 Real-Time PCR System进行荧光定量PCR反应。反应体系如下:2×SYBR Green Master Mix (10 μL)、cDNA模板 (2 μL) 、上游引物(1 μL)、下游引物(1 μL)、蒸馏水补充至 20 μL。所得数据由QuantStudioTMDesign and Analysis Software version 1.4.3软件分析,内参基因选择GAPDH。
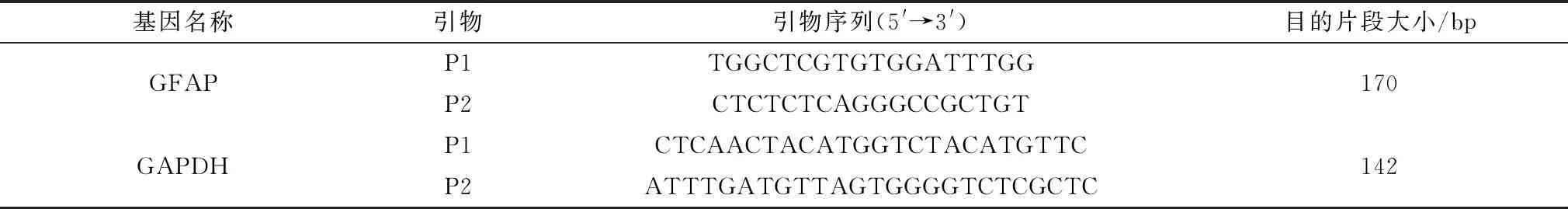
表1 qRT-PCR反应引物信息
1.5 Western blot检测取采集的小鼠脑组织于离心管中加入适量RAPI裂解液(含PMSF),用眼科剪将组织剪碎并用匀浆器进行匀浆,冰上裂解30 min 以充分裂解蛋白。用BCA法测定浓度,将样品蛋白浓度调整一致后加入上样缓冲液,于微波炉上开水煮沸10 min,12 000 r/min离心10 min。取样品加入到蛋白胶加样孔中,上层胶80 V,30 min,下层胶120 V,90 min进行电泳分离。电泳结束后,300 mA恒流湿式转膜1 h;将蛋白转移到PVDF膜上,37℃、5% BSA封闭1 h;加GFAP抗体和GAPDH抗体4℃孵育过夜;PBST洗涤充分后,用HRP标记的二抗室温孵育1 h;PBST洗涤后ECL显影并采集图像,使用Image J对条带灰度值进行分析。
1.6 石蜡切片制作矢状切取小鼠半脑后置于10%中性福尔马林溶液中固定24 h以上,酒精梯度脱水,二甲苯透明,浸蜡,包埋,石蜡切片机切片。
1.7 间接免疫荧光将上述切片置于二甲苯和梯度酒精中脱蜡复水,并将切片放入适量柠檬酸钠(pH 6.0)溶液进行抗原修复,37℃、5% 脱脂奶粉封闭1 h;加入稀释好的一抗4℃孵育过夜;PBST溶液清洗后加入荧光二抗,室温避光孵育1 h;PBST溶液清洗切片,加入稀释好的DAPI溶液染核;清洗干净后滴加封片剂封片,用荧光显微镜观察,根据不同的染料选择不同波段的激发光,采集图像。

2 结果
2.1 qRT-PCR检测小鼠脑组织中GFAP基因表达情况
2.1.1RT-PCR扩增结果 使用合成的GAPDH和GFAP引物进行常规PCR扩增,琼脂糖凝胶电泳结果显示为单一条带,大小符合预期(图1),表明引物特异性好,可用于下一步试验。

M.DL2000 DNA Marker;C.对照组;1~5.接种PHEV后1~5 d
2.1.2qRT-PCR检测结果 对照组与试验组小鼠脑组织均可检测到GFAP基因转录。与对照组小鼠相比,接毒3 d后小鼠脑组织GFAP基因转录水平显著升高并且随着感染时间延长差异更加显著(图2)。

C.对照组;1~5.接种PHEV后1~5 d
2.2 Western blot检测小鼠脑组织GFAP蛋白表达对照组与试验组小鼠脑组织均可检测到GFAP蛋白表达,且其表达量随着感染时间的延长呈现上升趋势,蛋白条带大小约为50 kDa,与预期相符(图3);经统计分析,与对照组相比,试验组小鼠于接毒后3 d即差异显著(图4)。
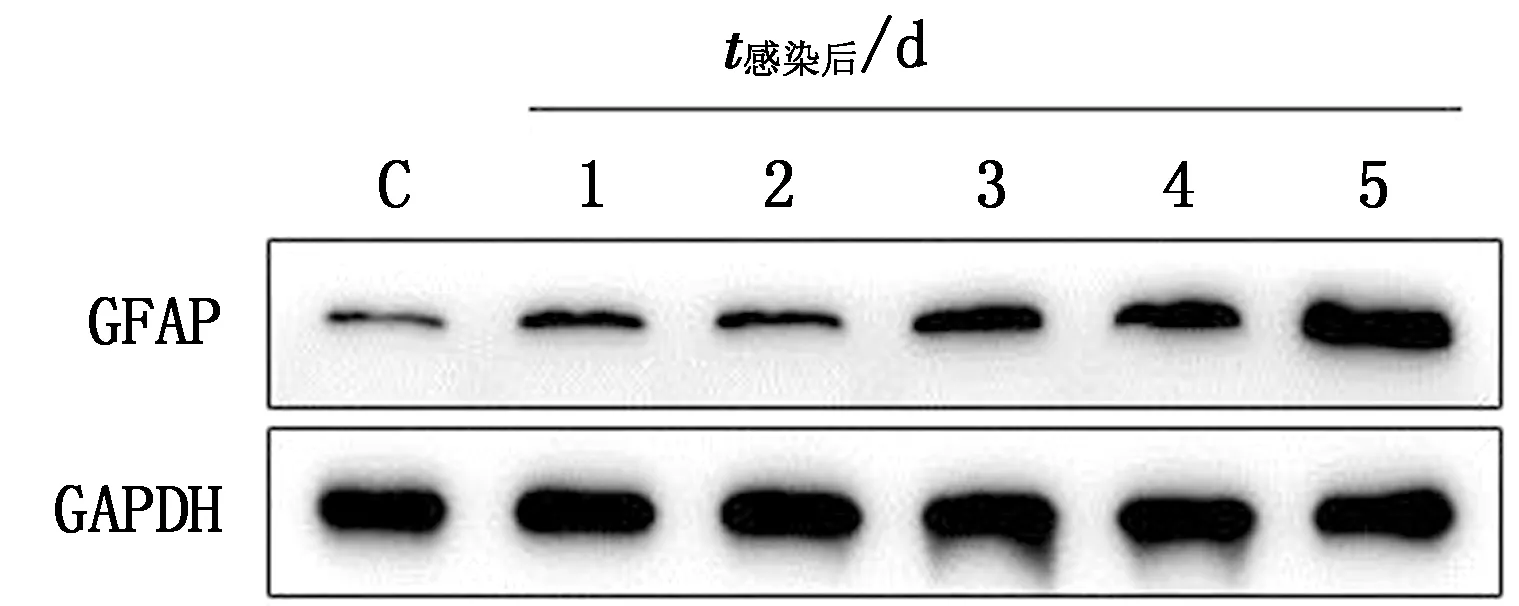
C.对照组;1~5.接种PHEV后1~5 d
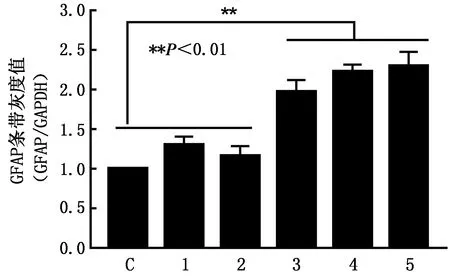
C.对照组;1~5.接种PHEV后1~5 d
2.3 间接免疫荧光结果免疫荧光结果显示(图5),对照组小鼠脑组织病毒染色阴性,GFAP标记的星形胶质细胞胞体较小,数量少,零散分布;接毒5 d后,试验组小鼠脑组织含有大量病毒分布,GFAP标记的星形胶质细胞数量增加,分布集中且胞体变大,突起更加明显;PHEV与GFAP不发生共定位,说明PHEV不能直接感染星形胶质细胞。
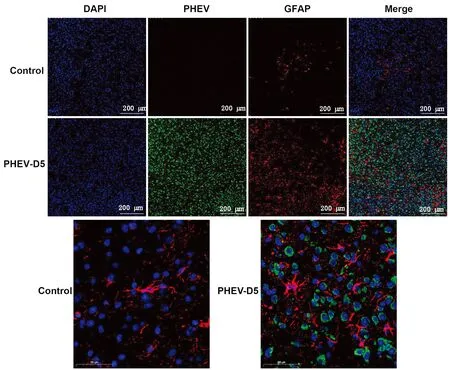
Control.对照组;PHEV-D5.接种PHEV后5 d小鼠;DAPI.细胞核
3 讨论
多数噬神经病毒感染脑组织后能够引发神经炎症,然而神经炎症在病毒性脑脊髓炎中的作用还有待进一步研究。最初的神经炎症反应可能有利于病毒的清除,但是中枢神经系统长期暴露在促炎细胞因子/趋化因子的环境中可能会导致神经死亡及组织损伤。星形胶质细胞的活化是神经炎症过程中的一个重要特征,明确神经炎症反应及星形胶质细胞在病毒性脑炎过程中发挥的作用有利于更好地理解其发病机理并据此开发新的治疗方法。
PHEV属于典型的噬神经性病毒,病毒经外周神经末梢感染并沿神经向体内传递后,局限于CNS中大脑、脊髓、延髓及脑干的神经元胞质及突起,引起神经损伤,并且在整个感染过程中检测不到病毒血症,与狂犬病病毒的侵袭途径有一定的相似性[9]。利用基因芯片检测PHEV感染诱导小鼠大脑皮质差异表达基因的结果显示,从病毒感染的第3天开始与星形胶质细胞活化相关的因子,如GFAP、Vim、CCL5、CXCL10,发生显著升高,这提示我们PHEV感染可能激活宿主CNS中的星形胶质细胞[10]。星形胶质细胞活化的标志为GFAP表达升高,同时胞体肥大、细胞增生[11]。活化的星型胶质细胞作为神经炎症的重要调节者,能够释放广泛的免疫介质,例如细胞因子、趋化因子及生长因子,这些因子既能发挥神经保护作用也可能发挥神经毒性作用。例如星形胶质细胞通过负反馈调节抑制小胶质细胞过度活化控制炎症反应从而发挥神经保护作用[12]。与上述相反,在脊髓损伤模型中,活化的星形胶质细胞是有害的,选择性的抑制星形胶质细胞有利于损伤的修复[13]。上述结果表明,在不同的病理条件下,星形胶质细胞可能发挥截然不同的作用。
星形胶质细胞及小胶质细胞作为CNS主要的细胞类型,广泛参与到脑组织稳态的维持及各种功能的发挥。小胶质细胞起源于髓系细胞,被认为是CNS中专职的巨噬细胞,其能够表达多种模式识别受体,因此,以往关于CNS先天免疫的研究多集中于小胶质细胞[12,14]。然而,近期的研究证实星形胶质细胞在CNS先天免疫中的功能也不容忽视。星形胶质细胞起源于神经外胚层,是CNS中数量最多的胶质细胞类型,其在脑血管周围形成胶质界膜限制免疫细胞进入到脑实质[15]。同时,星形胶质细胞表达一系列与天然免疫有关的受体,包括Toll样受体、NOD样受体、清道夫受体、甘露糖受体及补体系统的成分[12]。本课题组前期研究证实,PHEV感染可激活小鼠脑内的小胶质细胞[16],活化的小胶质细胞发挥的免疫功能及其内在机制是目前研究的重点。
本研究以星形胶质细胞特异性标记物GFAP为检测对象,评价PHEV感染后星形胶质细胞的活化状态。结果表明,与对照组小鼠相比,试验组小鼠接种PHEV后脑组织GFAP基因转录水平及蛋白表达水平都发生了显著升高,且随着感染时间的延长而逐渐增加,直至感染后第5天小鼠死亡时达到峰值。表明PHEV感染后,CNS中活化的星形胶质细胞不断增殖,伴随整个感染过程。间接免疫荧光结果进一步表明感染 PHEV后的小鼠脑组织星形胶质细胞数量明显增多,呈聚集样分布,同时胞体增大,突起变多。以上结果分别从基因转录水平、蛋白表达水平和组织学分布及形态等3个方面证实PHEV感染后小鼠脑内星型胶质细胞发生了明显增殖、活化现象。
前期大量研究结果均表明,神经元为PHEV感染的靶细胞,星形胶质细胞不能被PHEV感染,这提示我们星形胶质细胞的活化并非是由PHEV直接感染所引起。我们推测,PHEV感染的神经元可能产生了某种物质从而介导星形胶质细胞的活化。根据文献报道,IL-1、TNF-α、IFN-γ等多种细胞因子均可激活星形胶质细胞[12],例如在呼肠孤病毒性脑炎小鼠模型中,星形胶质细胞是由呼肠孤病毒感染神经元产生的IFN-β激活[11]。然而在PHEV感染的小鼠脑脊髓炎模型中星形胶质细胞活化的确切机制及活化的星形胶质细胞发挥的作用仍需进一步试验研究。
综上所述,本研究明确了PHEV感染后可使小鼠CNS中星形胶质细胞发生活化、增殖,并且该过程伴随着整个感染进程。该结果可为后期深入开展PHEV所致神经系统炎性损伤的机制研究奠定一定的基础。

