儿童急性巨核细胞白血病临床特点及预后分析
罗铁梅 于洁 安曦洲
(重庆医科大学附属儿童医院血液肿瘤科/国家儿童健康与疾病临床医学研究中心/儿童发育疾病研究教育部重点实验室/儿科学重庆市重点实验室,重庆 401122)
急性巨核细胞白血病(acute megakaryocytic leukemia,AMKL) 是急性髓系白血病(acute myeloid leukemia,AML)的一个亚型,FAB分型为AML-M7型[1],约占儿童AML 5%~15%[2-4],发病中位年龄为1.4~2岁[2-3,5]。AMKL骨髓巨核细胞在光镜下较难辨认,可伴骨髓纤维化等原因易误诊[6]。根据患儿是否伴有唐氏综合征(Down syndrome,DS),将AMKL分为DS-AMKL及非DSAMKL[7]。DS-AMKL患儿采用较低强度的单纯化疗即可实现持续完全缓解(complete remission,CR),其总生存(overall survival,OS) 率可达79%~91%[7-8],而非DS-AMKL对标准化疗反应不佳,复发率高,OS率仅为53%~70%[2,5,9-11]。本研究根据白血病细胞形态学、免疫学、细胞遗传学和分子生 物 学 (morphology,immunology,cytogenetics,molecular biology,MICM)分型及微小残留病(minimal resident disease,MRD)作为危险度分级指标,参考美国儿童肿瘤协作组AML方案[12]制定AML03方案,旨在分析AMKL患儿的临床特点、疗效及预后影响因素。
1 资料与方法
1.1 研究对象
选取2011年5月至2019年12月间在我院诊治的47例AMKL患儿为研究对象。纳入标准:(1)年龄0~18岁,新诊断AMKL,外院未行化疗治疗;(2)经骨髓涂片、骨髓活检、免疫分型确诊为AMKL,诊断标准为:骨髓原始细胞≥20%,其中50%以上为巨核细胞系或者原始细胞通过流式细胞术和/或免疫组织化学染色至少表达一种血小板糖蛋白(CD41、CD61或CD42)[1];(3)本研究经重庆医科大学附属儿童医院医学伦理委员会审查并批准[(2015)年伦审(研)第(28-1)号],治疗前所有入组患儿家长均签署知情同意书。
1.2 临床资料收集
对诊断为AMKL患儿自确诊之日起进行病历资料收集及电话随访,随访终点时间为2020年6月1日。根据入组患儿年龄、性别,是否有肝脾、淋巴结肿大,初诊血常规,MICM分型,早期治疗反应(骨髓细胞学及MRD结果),是否行异基因造血干细胞移植(allogeneic hematopoietic stem cell transplant,allo-HSCT)等因素进行分组。
1.3 治疗方案
AML03方案(中高危组):
(1)诱导Ⅰ:ADE(10+3+5)方案:阿糖胞苷(cytosine arabinoside,Ara-C)200 mg/(m·2d)×10 d静脉滴注;柔红霉素 (daunorubicin,DNR)50 mg/(m·2d)×3 d静脉滴注;依托泊苷(etoposide,VP16)100 mg/(m2·d)×5 d静脉滴注。
(2)诱导Ⅱ:AM/AI方案:Ara-C 2 g/(m·2d)×4 d静脉滴注;米托蒽醌12 mg/(m2·d)×4 d或伊达比星10 mg/(m2·d)×2 d静脉滴注。
(3) 强化I:AE方案:Ara-C 2 g/(m2·d) ×5 d静脉滴注;VP16 150 mg/(m2·d) ×5 d静脉滴注。
(4) 强化II:AL方案:Ara-C 6 g/(m2·d)×4 d静脉滴注;左旋门冬酰胺酶(L-asparaginase,L-Asp):6 000 U/m2×2 d肌肉注射。
(5)神经系统白血病防治:甲氨蝶呤(methotrexate,MTX)、地塞米松(dexamethasone,Dex)、Ara-C三联鞘内注射共4次(年龄<1岁:MTX 6 mg、Dex 2.5 mg、Ara-C 15 mg; 年 龄1~<3岁:MTX 9 mg、Dex 2.5 mg、Ara-C 25 mg;年龄≥3岁:MTX 12.5 mg、Dex 5 mg、Ara-C 35 mg)。
(6)造血干细胞移植:5例患儿获CR后行allo-HSCT,其中1例为DS-AMKL患儿。3例行亲缘人类白细胞抗原(human leukocyte antigen,HLA)不全相合allo-HSCT,1例行同胞HLA全相合allo-HSCT,1例行无关供者HLA全相合allo-HSCT。
1.4 疗效及随访评估
骨髓检查为治疗评价主要指标,在四疗程化疗前和/或化疗后完善骨髓细胞学及MRD监测。骨髓CR定义为:骨髓增生活跃或明显活跃,骨髓白血病细胞<5%。复发定义为:CR后任何时候外周血出现原始幼稚细胞或骨髓白血病细胞>5%或出现髓外白血病。OS期定义为从确诊之日开始到死亡或末次随访;无事件生存(event-free survival,EFS)期定义为从确诊之日开始到发生任何事件(事件包括复发、死亡或发生二次肿瘤)。
1.5 MRD
初诊时即采集骨髓使用流式细胞术对AML-MRD筛查标记,化疗后再采集骨髓送检MRD(北京康圣环球公司),MRD阴性定义为:MRD<0.1%。
1.6 MICM分型检测
初诊时需完善MICM分型检查,具体方法如下:
(1)骨髓细胞形态学:骨髓细胞涂片行常规瑞氏染色,分析细胞形态及细胞化学染色特点。
(2)免疫分型检测:采用流式细胞术进行免疫分型检测。
(3)染色体核型检测:采用G显带技术进行核型分析。
(4)融合基因检测:抽取骨髓用乙二胺四乙酸抗凝后行多重巢式逆转录-聚核酶链式反应(reverse transcription-polymerase chain reaction,RTPCR)检测。
(5)基因突变检测:采用RT-PCR、PCR和/或二代测序技术,筛选并记录与白血病发病或预后相关的突变基因。
1.7 统计学分析
应用SPSS 25.0统计软件对数据进行统计学分析,正态分布计量资料以均数±标准差(±s)表示,非正态分布计量资料以中位数(范围)表示;计数资料使用百分率(%)表示。采用Kaplan-Meier生存分析及log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
47例AMKL患儿中,男21例,女26例,男女比例为1∶1.2。发病中位年龄为22.2(4.6~104.8)个月。患儿初诊临床症状和体征:出血为87%(41/47),发热为64%(30/47),贫血为96%(45/47),肝脏肿大(≥2 cm)为64%(30/47),脾脏肿大为45%(21/47),淋巴结肿大为38%(18/47),骨浸润为19%(9/47),有3例患儿伴骨髓纤维化。血常规提示血红蛋白(Hb)为79(24~118)g/L, 白 细 胞 (WBC) 计 数 为13.5(2.3~153.8) ×109/L,血小板 (PLT) 计数为23(7~271)×109/L,31例患儿外周血发现幼稚细胞,幼稚细胞的百分比为16%(0%~77%)。
2.2 MICM结果
47例AMKL患儿的骨髓涂片结果显示原始及幼稚巨核细胞/原始细胞的中位数为55.5%(7.0%~86.5%)。幼稚巨核细胞形态特点为:胞体大小不等,边缘不齐,呈云雾状或粗毛刺状,胞浆呈深蓝色不透明,着色不均,可见伪足样突起,部分可见少许颗粒,核染色质疏松网状,核仁不清,部分原巨核细胞边缘有产生PLT现象,或伴有网状纤维增生。95.3%过氧化物酶染色为阴性。
31例患儿白血病免疫分型结果分析:CD41阳性占81%(25/31),CD61阳性占50%(15/30),CD42阳性占62%(13/21),CD36阳性占68%(21/31),CD117阳性占68%(21/31),CD13阳性占52%(16/31),CD33阳 性占77%(24/31),CD56阳性占32%(10/31),HLA-DR阳性占52%(16/31)。
35例患儿初诊时染色体核型结果分析:正常核型11例(31%)、超二倍体12例(34%)、假二倍体9例(26%)、低二倍体3例(9%)。常见染色体数目异常有:伴+21染色体核型9例(26%),伴+8染色体、+19染色体核型各4例(11%),伴+10染色体、+22染色体、-16染色体核型各3例(9%)。有3种以上染色体异常的复杂核型9例(26%)。
29例患儿行RT-PCR检查显示,仅EVI1融合基因阳性13例(45%),EVI1合并MLL融合基因、TLS-ERG融合基因各1例(3%)。24例患儿完善与AML相关突变基因检测,13例患儿结果提示异常,常合并多个基因突变。携带ASXL1突变基因10例(41.7%),携带WT1突变基因、TET突变基因各5例(20.8%),携带TP53突变基因4例(16.7%),其余突变基因有:CEBPA、GATA、JKA2、NRAS、DNMT3A、RUNX1、CTCF、KMT2C、SF3B1基因。
2.3 治疗结果
47例患儿中,诊断后23例未接受AML03方案治疗,余24例患儿的中位随访时间为11.6(0.4~45.0)个月,其中2例中途放弃治疗,2例失访;2例为DS-AMKL患儿,其中1例移植后存活38.0个月,另1例完成化疗16.5个月后复发死亡。22例非DS-AMKL患儿行AML03方案(中高危组)化疗,2例在诱导缓解Ⅰ阶段死亡,未行骨髓细胞学、MRD检查,诱导Ⅰ、Ⅱ后骨髓细胞学缓解率分别为70%(14/20)、85%(17/20);3例患儿诱导Ⅰ后未行MRD检查,1例诱导Ⅱ后未行MRD检查,诱导Ⅰ、Ⅱ后MRD阴性率分别为41%(7/17)、79%(15/19)。22例非DS-AMKL患儿2年OS率为50%±13%,2年EFS率为40%±12%(图1);截至随访终点时间,2例失访,8例复发,复发率为36%(8/22),复发中位时间为9.3(5.9~15.0)个月,其中7例骨髓复发,1例髓外复发;9例患儿死亡,病死率为41%(9/22),其中5例为疾病进展死亡,4例为治疗相关死亡。
2.4 预后危险因素
生存分析发现,非DS-AMKL患儿性别、年龄、淋巴结肿大、肝脾大及初诊WBC计数对OS率及EFS率的影响差异均无统计学意义(P>0.05)。患儿行allo-HSCT与单纯化疗相比,2年OS率和EFS率更低,但差异无统计学意义(P>0.05)。见表1。

图1 AML03方案治疗22例非DS-AMKL患儿的生存曲线

表1 22例非DS-AMKL患儿远期生存的危险因素分析
对细胞免疫分型进行生存分析结果显示,CD56阳性患儿2年的OS率(P=0.008)和EFS率(P=0.003)低于阴性患儿(表2、图2)。染色体核型(包括高二倍体、假二倍体、正常核型、伴+21染色体、复杂核型),EVI1融合基因、TET2突变基因、AXSL1突变基因、WT1突变基因对OS率及EFS率影响差异均无统计学意义(P>0.05)。见表2。
对早期治疗反应情况进行生存分析:诱导Ⅰ后骨髓细胞学及MRD结果对OS率及EFS率影响差异均无统计学意义(P>0.05)。诱导Ⅱ后骨髓细胞学缓解与未缓解相比,患儿2年OS率(P=0.011)和EFS率(P=0.005)更高;诱导Ⅱ后MRD阴性与阳性相比,患儿2年EFS率(P=0.007)更高。见表3和图3。
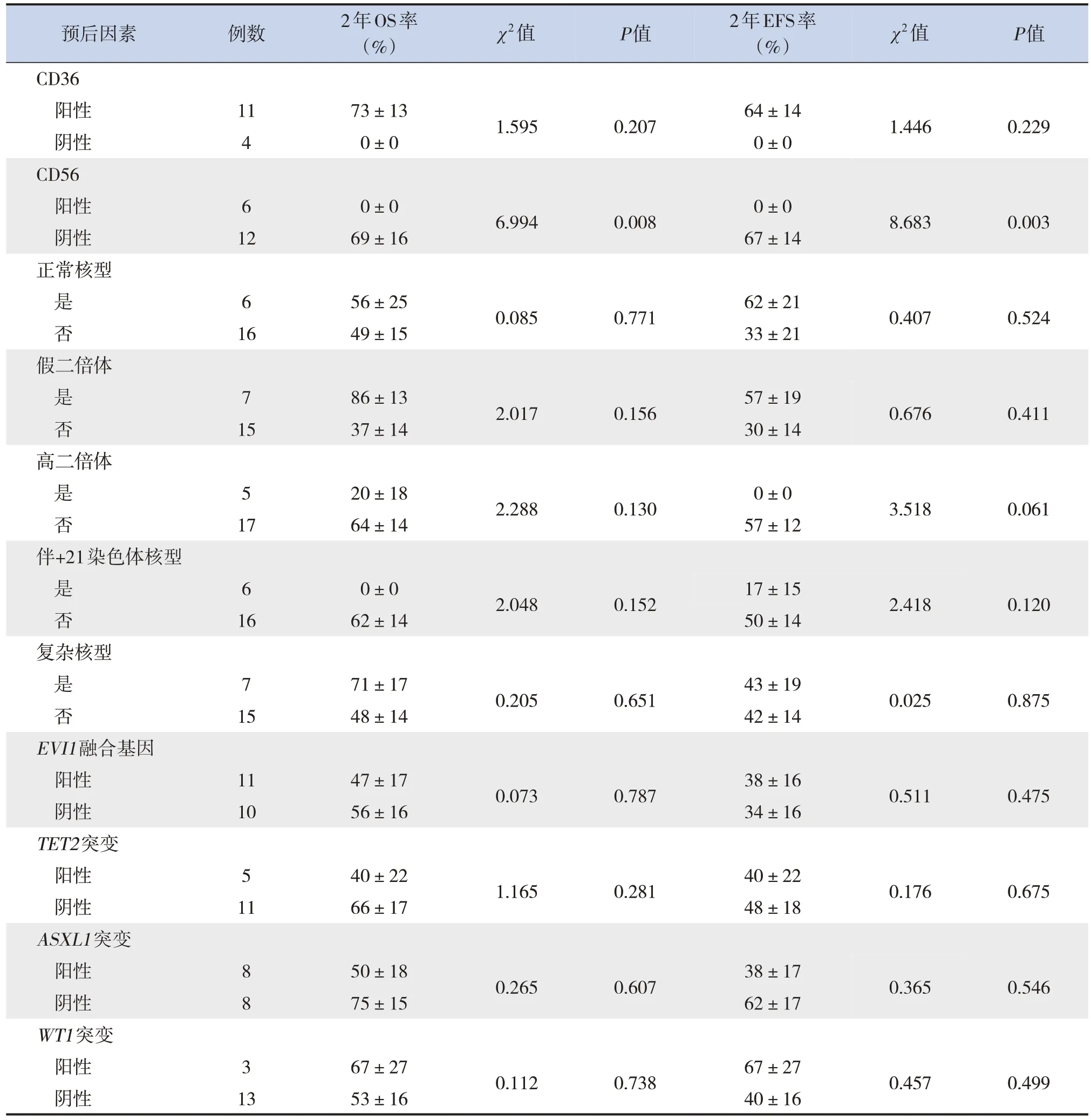
表2 22例非DS-AMKL患儿MICM分型对远期生存的危险因素分析

表3 22例非DS-AMKL患儿早期治疗反应对远期生存的危险因素分析
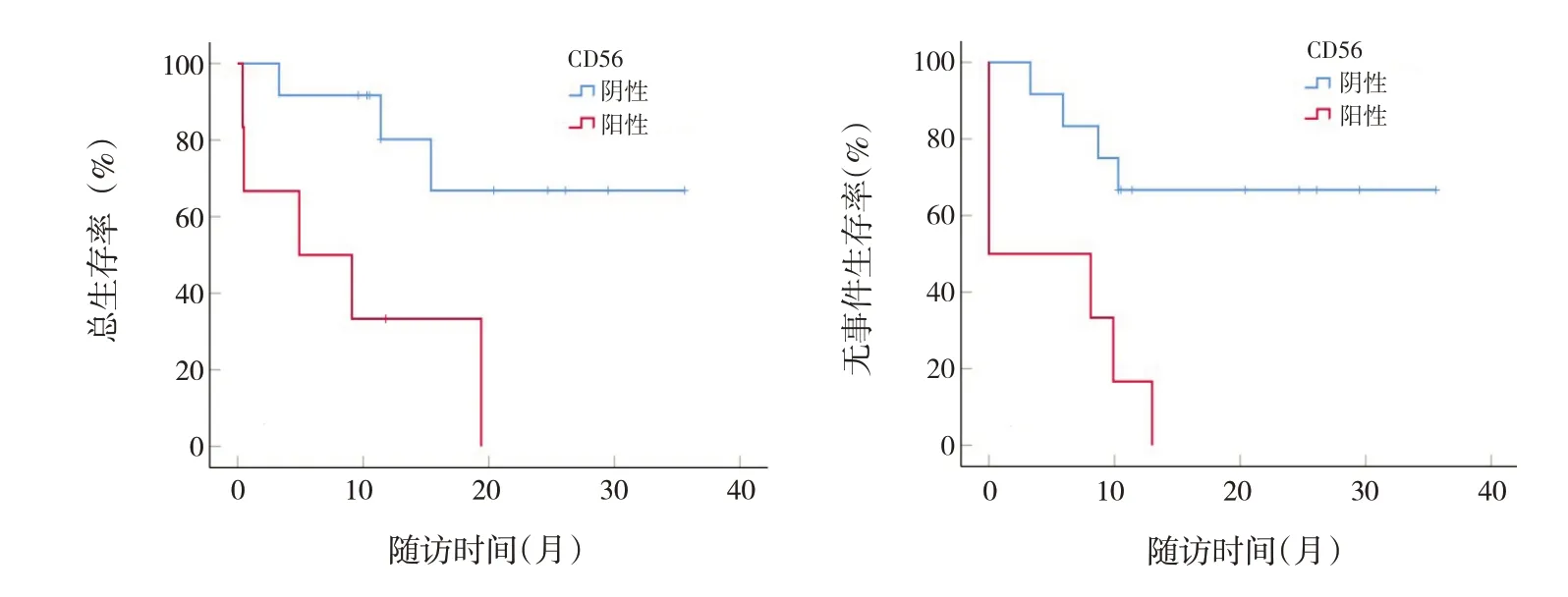
图2 CD56阳性与阴性非DS-AMKL患儿的生存曲线
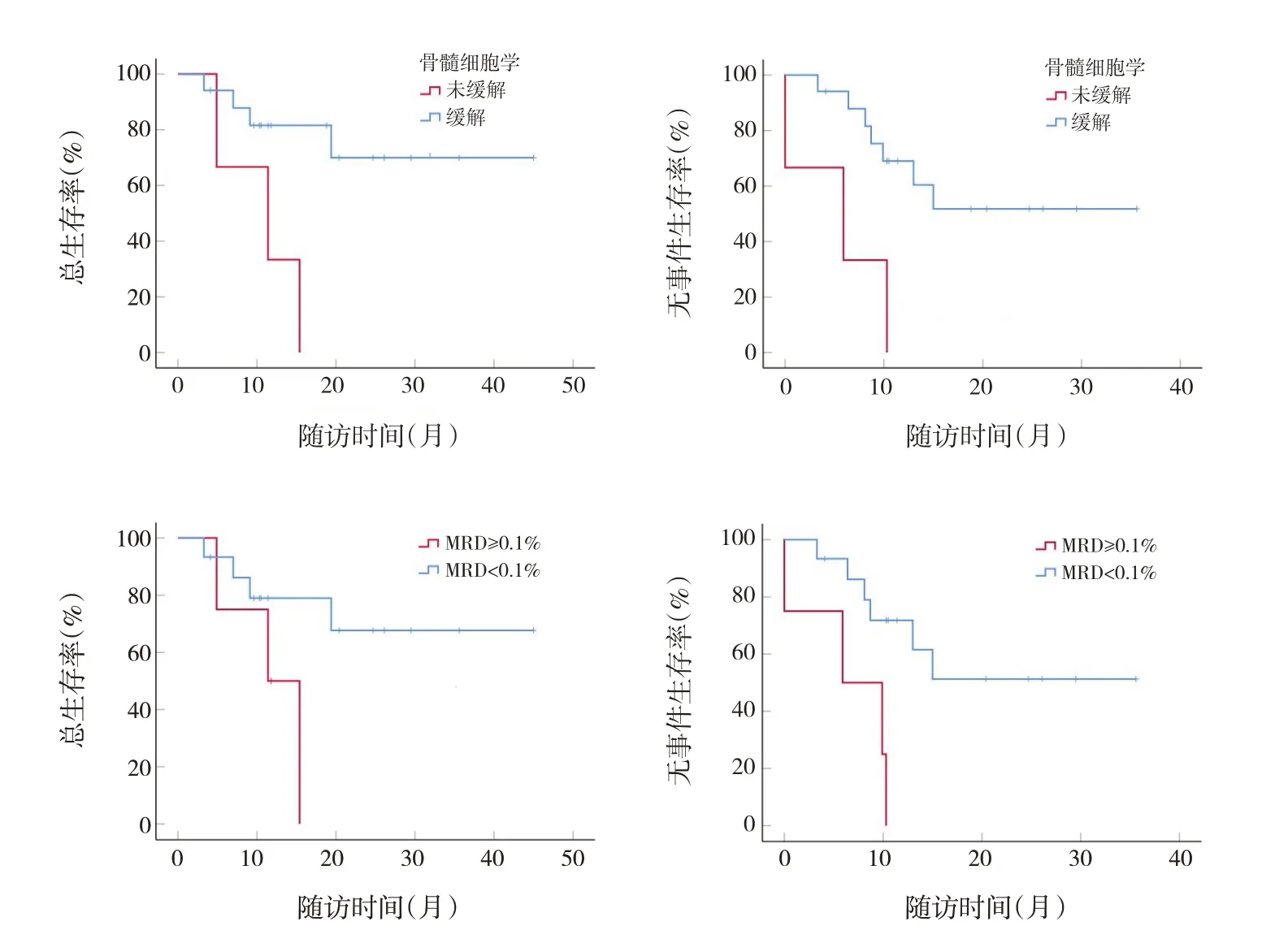
图3 诱导Ⅱ后骨髓细胞学及MRD对非DS-AMKL患儿生存曲线的影响
3 讨论
儿童AMKL发病年龄多小于3岁,女童稍多,我院AMKL约占AML(除外急性早幼粒细胞白血病)10.1%[13]。临床以发热、贫血、出血及肝大为主要表现,淋巴结肿大和脾大比例不高,初诊时PLT计数低于其他急性白血病亚型,结果与其他研究报道相似[2-3,10]。AML03方案治疗非DS-AMKL结果提示91例患儿3年OS率和EFS率分别为70%±6%、54%±7%[13],相比之下,AMKL预后稍差。国内有研究结果显示非DS-AMKL患儿(n=22)治疗后2年OS率及EFS率分别仅为36%±13%、22%±11%[14],国外近几年研究结果显示非DS-AMKL患儿OS率可达52.6%~70.0%,EFS率为30.9%~57.0%[2,5,9-11],提示本研究应用AML03方案治疗非DS-AMKL疗效接近国际水平。
AMKL患儿可伴骨髓纤维化,导致部分患儿骨髓涂片原始细胞比例不足20%,且部分细胞形态难以辨别,利用MICM分型及其特异性免疫表型标志物协助诊断尤为重要。目前国内外报道伴CD36阳性患儿预后更好[14-15],本研究显示CD36阳性与阴性患儿预后无差异。有研究表示AML患儿CD56表达水平高于成人[16],体外实验显示CD56阳性与CBFA2T3-GLIS2融合基因相关[17],携带该融合基因在非DS-AMKL患儿中复发率高、预后差[4,11]。本研究未检测该融合基因,但CD56阳性患儿OS率及EFS率也明显低于阴性患儿,提示CD56阳性可能与预后不良相关。
遗传细胞学对AMKL预后的影响是目前国内外研究热点,DS患儿患AMKL的风险是非DS患儿的500倍,但预后好[7-8]。本研究中有2例DS-AMKL患儿,占8.3%(2/24),样本量少未做进一步分析。也有研究报道伴+21染色体核型是非DS-AMKL预后的良好因素[2],本研究中6例伴+21染色体核型患儿OS率及EFS率却低于不伴+21染色体核型患儿,但差异无统计学意义,可能由于样本量少引起结果偏差。
患儿早期的治疗反应也与预后效果密切相关,非DS-AMKL患儿骨髓细胞学缓解率较其他AML亚型稍差[2,13,18]。BFM98及BFM04方案结果显示诱导缓解后骨髓细胞学缓解患儿的预后明显优于未缓解患儿,其5年OS率分别为66%±6%vs 35%±11%[2],而本研究中诱导Ⅱ后骨髓细胞学缓解患儿2年EFS率、OS率也明显高于未缓解组,提示早期治疗反应的骨髓细胞学结果与预后密切相关。AML患儿诱导化疗后骨髓MRD<0.1%的预后显著优于MRD≥0.1%[9,19],但国外 研究结果未 显示MRD对非DS-AMKL预后有显著差异[5]。本研究结果不仅显示诱导Ⅱ后MRD阴性患儿的OS率及EFS率更好,也为MRD预测远期预后提供重要依据。
近年来随着化疗方案的优化,CR后行allo-HSCT与单纯化疗相比,两者的远期预后是否存在差异仍有争议[2,11,14,20],本研究结果虽显示OS率及EFS率均无差异,但allo-HSCT的OS率及EFS率更低是由于4例非DS-AMKL移植患儿中,1例复发死亡,1例因感染性休克死亡,分析认为虽然allo-HSCT具有比化疗更强的抗白血病潜能,但是治疗相关死亡可能部分抵消其疗效。这些研究结果受到allo-HSCT样本量较少的影响,结论有待于进一步证实。
本研究作为回顾性研究,且随访时间较短,结果可能存在偏差,未来需进一步行大样本、多中心、长时间的前瞻性研究,从而才能更加深入对儿童AMKL的认识。
利益冲突声明:所有作者均声明不存在利益冲突。

