外排泵抑制剂对泛耐药鲍曼不动杆菌生物被膜的影响*
王清会,蔺 飞,袁明勇,凌保东△
1.成都医学院 结构特异性小分子药物研究四川省高校重点实验室(成都 610500); 2.成都医学院 药学院(成都 610500);3.成都医学院临床医学院·第一附属医院(成都 610500)
细菌主要以浮游态和生物被膜态两种形态存在于环境中,临床上80%的细菌感染性疾病的持续与生物被膜的形成有关[1],由于临床抗菌药物的广泛使用,促进了细菌生物被膜的形成,导致细菌的耐药性、致病性不断提升,慢性感染、反复感染率不断增加[2-3]; 研究[4-5]表明,外排泵在生物分子的细胞间信号传递中起重要作用,以协助生物被膜形成,通过对胞外多糖(exopolysaccharide,EPS)或群体感应(quorum-sensing,QS)因子的外排,调控参与生物被膜形成的基因;阻止生物被膜中细菌的黏附等作用方式影响生物被膜的形成,是导致细菌耐药的主要机制之一。对抗耐药性的一种可能机制是采用外排泵抑制剂阻断外排泵的相关功能,最终阻碍生物被膜的形成[6-7]。本研究拟探讨泛耐药鲍曼不动杆菌浮游状态与生物被膜状态下外排泵基因表达是否存在差异和外排泵抑制剂对生物被膜形成是否存在影响。
1 材料与方法
1.1 菌株来源
从成都医学院第一附属医院收集9株2018—2019年住院患者临床标本的非重复泛耐药鲍曼不动杆菌菌株(extensivelydrugresistantAcinetobacterbaumannii,XDRAB),经过法国Bio-merieux公司Vitek32全自动微生物分析系统鉴定。质控菌株鲍曼不动杆菌ATCC19606购自美国ATCC标准菌株数据库,金黄色葡萄球菌ATCC29213、大肠埃希菌ATCC25922、铜绿假单胞杆菌ATCC27853为本实验室留存。
1.2 实验仪器
恒温培养箱(上海一恒)、生物安全柜、恒温摇床、酶标仪(SpectraMa190)、荧光定量PCR仪(biorad);96孔细胞培养板(科兹莫)、6孔细胞培养板(科兹莫)等。
1.3 抗菌药物
美西林、氨苄西林钠、美罗培南、亚胺培南、头孢噻肟、头孢他定、庆大霉素、阿米卡星、环丙沙星、左氧氟沙星、多西环素、米诺环素、替加环素、氨苄西林舒巴坦、头孢哌酮舒巴坦、磺胺甲恶唑、多粘菌素B均购自大连美仑生物公司。试剂:维拉帕米(大连美仑生物公司)、奥美拉唑(上海源叶生物)、PAβN、CCCP购自上海皓元生物医药科技有限公司。胰酪大豆胨液体培养基(trypticase soy broth,TSB)、CAMHB肉汤培养基购自青岛海博生物技术有限公司。酵母提取物、胰蛋白胨、琼脂(英国OXOID公司);二甲基亚砜(成都市科龙化工试剂厂)、氯化钠、无水乙醇、异丙醇(成都市科龙化工试剂厂)。
1.4 实验方法
1.4.1 最低抑菌浓度(minimum inhibitory concentration,MIC)测定实验 参照美国临床实验室标准化协会(clinical and laboratory standards institute,CLSI) 2019标准采用微量肉汤稀释法测定浮游状态下9株XDR AB对17种抗菌药物的MIC值;参照文献[6-8]测定生物被膜状态下的最低抑菌浓度,即在96孔细胞培养板中加入190 μL TSB培养基和OD600为0.1的鲍曼不动杆菌重悬液10 μL,37 ℃孵育24 h,移除浮游菌,加入200 μL PBS洗涤3次,再加入CAMHB肉汤培养基和抗菌药物的混合培养基,在37 ℃下孵育16~20 h,记录结果。
1.4.2 外排泵抑制剂工作浓度的确定 PAβN、奥美拉唑、维拉帕米对9 株XDR AB的MIC值均>512 mg/L,CCCP的MIC值为16 mg/L,最终确定PAβN、奥美拉唑、维拉帕米选取128 mg/L,CCCP选取8 mg/L,在该工作浓度下均不影响细菌的生长。
1.4.3 生物被膜形成实验 结晶紫染色法:9株XDR AB菌株解冻后接种在LB固体培养基中过夜,用0.9%生理盐水调整其OD600=0.1。然后,接种到96孔细胞培养板,平板在37 ℃静置培养24 h。用1×PBS清洗3遍去除浮游细菌,静置30 min晾干96孔板;每孔加入200 μL 0.1%结晶紫,染色15 min。移除结晶紫,无菌PBS轻轻洗3次,静置30 min使96孔板晾干;在每孔中加入200 μL 95%的乙醇溶液,静置15 min,使结晶紫完全溶解,测定OD570。
1.4.4 实时定量聚合酶链反应(qRT-PCR) 测定9株XDR AB浮游状态与生物被膜状态下外排泵基因adeB、adeG、adeJ的表达情况.以16S rRNA基因作为内参基因,进行RNA提取(高纯RNA分离试剂盒,生工生物)和cDNA合成(cDNA合成试剂盒,诺维赞)。使用荧光染料SYBR Premix Ex Taq Ⅱ(诺维赞),一式三份测量参与外排泵基因的表达水平。qRT-PCR总反应体积为10 μL反应条件:95 ℃预变性2 min, 95 ℃ 5 s,60 ℃ 30 s共40个循环,融解曲线95 ℃ 5 s,60 ℃ 5 s,95 ℃ 50 s。16S rRNA作内部对照,以标准化每个基因转录本的水平,统计学分析采用配对样本t检验。内参基因及外排泵基因引物序列如下(表1)。

表1 qRT-PCR检测外排泵基因表达引物情况
1.5 统计学方法

2 结果
2.1 17种抗菌药物对浮游状态下 9 株XDR AB的 MIC 值
参照CLSI 2019标准, 浮游状态下9 株 XDRAB除对替加环素、多黏菌素 B敏感外,对包括碳青霉烯类、 β-内酰胺类、氨基糖苷类、氟喹诺酮类、 四环素类等抗菌药物均耐药(表2)。

表2 17种抗菌药物对9株 XDR AB浮游状态下的 MIC值
2.2 17种抗菌药物对生物被膜状态下 9 株XDR AB的 MIC 值
生物被膜状态下, 9 株XDR AB对 17种抗菌药物的 MIC进一步增加,其中多黏菌素B的MIC值上升了4~16倍,替加环素的MIC值上升了8~32倍(表3)。
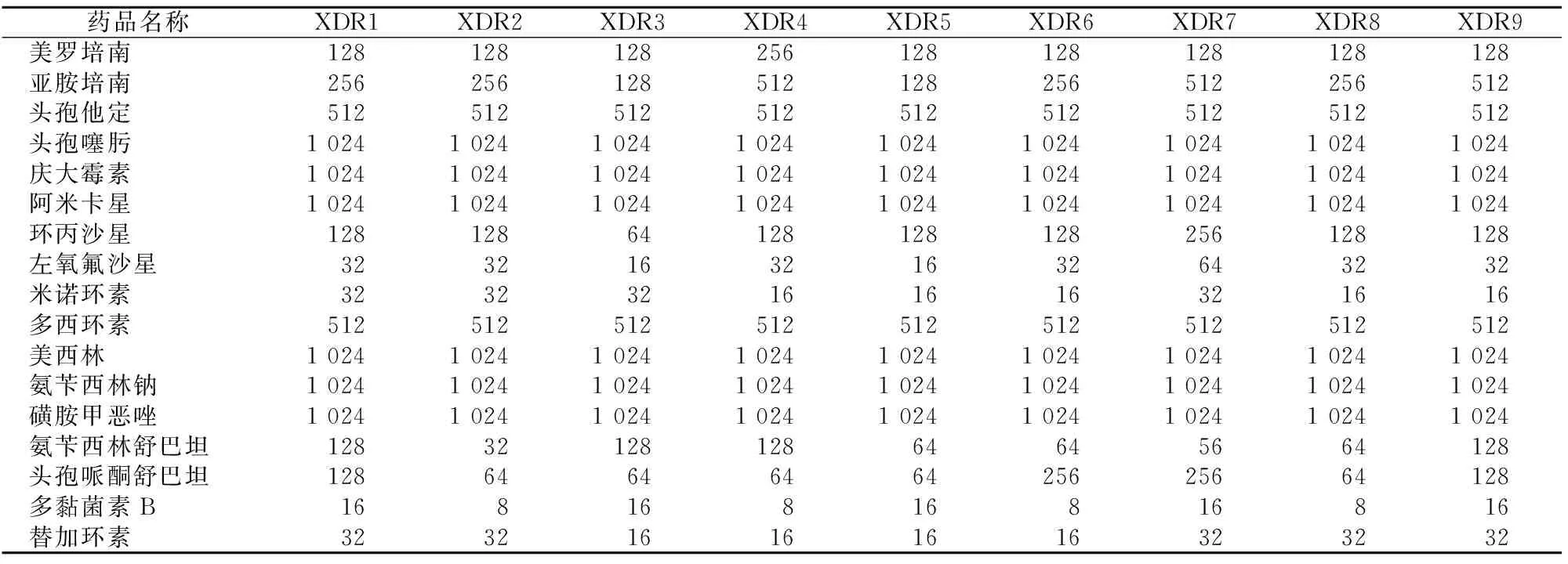
表3 17种抗菌药物对9株XDR AB生物被膜状态下的MIC值
2.3 9株XDR AB生物被膜形成前后的MIC值比较
对浮游状态与生物被膜状态下 9株XDR AB的MIC50和MIC90进行了比较,除氨苄西林舒巴坦外,抗菌药物在生物被膜状态下MIC50和MIC90均呈现不同程度的上升(表4)。

表4 9株XDR AB生物被膜形成前后的MIC值比较(mg/L)
2.4 4种EPIs对XDR AB生物被膜形成的影响
在工作浓度下4种EPIs对XDR AB生物被膜的形成均有不同程度的抑制作用,与对照组(1.39±0.06)相比,PAβN(0.74±0.04)的抑制作用最强,其次分别为CCCP(0.78±0.04)、维拉帕米(0.93±0.10)和奥美拉唑(0.95±0.09),生物被膜形成的减少量差异有统计学意义(P<0.05)(图1)。

图1 4种外排泵抑制剂对XDR AB生物被膜形成的影响
2.5 浮游与生物被膜状态外XDR AB排泵基因表达结果
qRT-PCR测定9株XDR AB的实验结果表明,在生物被膜状态下,3种外排泵基因中除adeG表达量无明显变化外,adeB和adeJ的表达量分别为(0.95±0.03)、(1.99±0.27),与浮游状态adeB(0.21±0.01)、adeJ(0.87±0.04)相比差异有统计学意义(P<0.05)(图2)。

图2 9株XDR AB的浮游状态与生物被膜状态外排泵基因表达情况
3 讨论
目前,国内外对XDR AB生物被膜形成前后耐药性变化与外排泵的关系研究不多。本研究实验结果显示,与浮游菌相比较,生物被膜状态下鲍曼不动杆菌对于抗菌药物的耐药性呈倍数增加,与蔺飞等[9]的研究结果一致。XDR AB生物被膜状态下外排泵基因adeB表达水平增强了4倍,adeJ表达水平增强了2倍。本研究应用的4种外排泵抑制剂均能不同程度减少XDR AB生物被膜的形成,以PAβN的抑制效果最明显,其次是CCCP、维拉帕米和奥美拉唑。有研究[10]表明,细菌的生物被膜形成后,其耐药性和黏附性进一步增强,使其能够不可逆地附着于生物或者非生物的表面,表现出相对于浮游菌在结构、基因表型和生化特性的改变[11];而PAβN是一种广谱的外排泵抑制剂,能够增加生物被膜状态下细菌外膜的通透性[12],使抗菌药物更容易进入细菌细胞发挥作用[13-15]。在生物被膜细菌中,外排泵抑制剂与外排泵结合发挥作用时,其作用机制主要包括,EPIs可与底物结合在同一位点,发挥竞争性抑制的作用,当外排泵表达时,优先排出EPIs,减少了抗菌药物的流失;另一方面,EPIs可通过阻碍外排泵的功能起作用。 EPIs还能通过影响生物被膜细菌的 QS系统和毒力基因的表达,减少生物被膜的产生,同时降低细菌毒性[16-18]。外排泵抑制剂通过以上方式影响着生物被膜的形成及细菌的耐药性,不失为一种减少细菌生物被膜形成与降低细菌耐药性的有效方式。

