九蒸九制对黄精多糖单糖组成及其抗氧化性的影响
吴丰鹏,李芹英,*,吴彦超,李惠静,*
(1.哈尔滨工业大学(威海)海洋科学与技术学院,山东威海 264209; 2.威海海洋生物医药产业技术研究院,山东威海 264400)
黄精(Polygonatumsibirieum)是药食同源多年生的草本植物,根据其根茎的形状不同习惯分为“鸡头黄精”、“姜形黄精”、“大黄精”。黄精属于百合科黄精属(PolygonatumMill.),目前全球共有黄精属植物327种,我国共有79种[1]。作为中药材,黄精味甘性平,归脾、肺、肾经,具有健脾、润肺、益肾以及补气养阴等功能[2],可用来治疗肺虚燥热、脾胃不和、体倦乏力、精血不足等症状,世人将黄精誉为“血气双补之王”[3]。黄精中含有多种多样的化学成分,含量最多的是多糖,约为14%左右,另外还有皂苷、氨基酸、木质素、甾醇、黄酮、挥发油等重要的化学成分[4]。现代药理学对药用黄精的研究表明,黄精具有降血糖、降血脂[5]、抗炎[6]、抗病毒[7]、抗菌、抗肿瘤[8-9]、美容养颜、提高记忆力[10]、改善免疫力[11]等功效,具有较高的药用价值及良好的市场前景。
近年来,中医治疗技术得到了空前的发展,受到了越来越多人的青睐与重视[12]。中药炮制品的制作主要是将生药材进行浸泡、蒸制、蜜制等过程,是我国传统中医的特色[13],数千年来用于身体的保健与疾病的治疗。九蒸九制作为一种传统的炮制中药方法,一般用来炮制比较珍贵的药材,如黄精、地黄、何首乌等大宗药材,黄精未炮制前往往对人体具有刺激性和毒害副作用,经炮制后消除了这些刺激性和毒害作用,还使其药物成分和药性得到改善,补益作用大大增强[14]。黄精炮制后其化学成分和药理活性会发生不同程度的变化[15],而多糖是黄精中最主要的药用成分,研究证明黄精多糖具有抗氧化、抗肿瘤、抗病毒等药理功效,炮制后多糖变化的具体研究尚不明确,因此,本文探究了黄精在九蒸九制炮制过程中多糖的含量及单糖组成变化,并对炮制过程中多糖的体外抗氧化活性进行测定,以期发现黄精多糖最佳的炮制工艺,为临床用药提供依据。
1 材料与方法
1.1 材料与仪器
黄精 取自于山东威海2年生的鸡头黄精块茎;葡萄糖(Glc)、甘露糖(Man)、鼠李糖(Rha)、葡萄糖醛酸(GlcA)、半乳糖醛酸(GalA)、半乳糖(Gal)、阿拉伯糖(Ara)、水杨酸(VC) 上海源叶生物科技有限公司;2,2-联苯基-1-苦基肼基(DPPH)、2,2′-联氨-双(3-乙基-苯并噻唑啉-6-磺酸)二胺盐(ABTS) 上海麦克林生化科技有限公司;1-苯基-3-甲基-5-吡唑啉酮(PMP) 萨恩化学技术有限公司;磷酸二氢钾、过硫酸钾、氢氧化钠、浓硫酸、盐酸、三氟乙酸(TFA)、苯酚、乙醇 分析纯,国药集团化学试剂有限公司;三氯甲烷、正丁醇、甲醇、乙腈 色谱纯,Fisher Scientific。
DZF6020型电热恒温鼓风干燥箱 江南宁波制造厂;HHS-11-2型恒温水浴锅 上海博讯实业有限公司;LGJ-10E型真空冷冻干燥机、DL-5-B型离心机 上海安亭科学仪器厂;旋转蒸发仪 东京理化器械株式会社;UV-1800紫外可见分光光度计 岛津仪器有限公司;SCL-10AVP型高效液相色谱仪 岛津制作所;氮吹仪供氮机 杭州德克尔实验设备有限公司。
1.2 实验方法
1.2.1 黄精多糖的制备 黄精块茎去除须根后清洗晒干,从生片开始,对黄精块茎进行清水蒸制(121 ℃,0.12 MPa,60 min),每蒸制一次后放入45 ℃烘箱至重量不再减少,留样,重复九次[16],随后进行切片、打磨成粉末并过20目筛。称取0~9次蒸制黄精粉末30 g,分别用80%的乙醇进行脱脂处理及挥干乙醇后,在料液比为1∶20、温度为60 ℃的条件下,用双蒸水提取3 h,重复浸提3次,旋蒸浓缩,5倍体积的无水乙醇4 ℃静置沉淀过夜,离心干燥即得黄精粗多糖。随后采用Sevag法对粗多糖进行蛋白质脱除[17],重复5~6次去除蛋白质,40 ℃旋蒸去除残留的有机溶剂,冻干,即得精制黄精多糖,根据蒸制次数将其分别命名为PSP0~PSP9。
1.2.2 多糖含量的测定
1.2.2.1 标准品溶液的制备 精密称取干燥至恒重的葡萄糖标准品30.70 mg,置于100 mL的容量瓶中,加去离子水溶解并定容至100 mL,反复摇匀,可得0.307 mg/mL的葡萄糖标准品溶液。
1.2.2.2 标准曲线的绘制 精密量取葡萄糖标准品溶液0.10、0.20、0.30、0.40、0.50、0.60 mL,分别置于干净试管中,并分别加去离子水至2 mL,各取100 μL于具塞试管中,依次加入新配置的6%苯酚溶液200 μL、浓硫酸溶液1 mL,摇匀后,在100 ℃水浴10 min,冷却,以去离子水为空白溶剂同法操作作为空白对照,在489 nm处测定吸光度,以葡萄糖质量浓度(X)为横坐标,吸光度(Y)为纵坐标绘制标准曲线,得标准曲线为:Y=0.0241X-0.0082,R2=0.9992。
1.2.2.3 供试品溶液的制备 分别精密称取干燥至恒重的0~9次蒸制黄精样品粉末1 g,按照“1.2.1”的方法进行黄精多糖的提取,再移至50 mL容量瓶中,用去离子水定容至刻度,即得供试品溶液。
1.2.2.4 黄精九蒸九制过程中多糖含量的测定 准确量取0.50 mL的各供试品溶液于干净具塞试管中,按照“1.2.2.2”的方法测定各供试品的吸光度(Y),代入标准曲线回归方程可计算多糖的质量浓度,然后再计算出黄精多糖的含量。
1.2.3 黄精多糖中单糖组成分析
1.2.3.1 单糖标准品的衍生化 准确称取标准品Glc、Man、Rha、GlcA、GalA、Gal、Ara各5 mg,各自配成5 mg/mL的水溶液待用。准确吸取如上配好的各标准单糖溶液10 μL于EP管中,并加水至100 μL,随后按顺序加入100 μL 0.30 mol/L的NaOH溶液,120 μL 0.50 mol/L的PMP-甲醇溶液,密封好后于70 ℃水浴锅中水浴1 h,冷却,再加入100 μL 0.30 mol/L的HCl中和至中性。加入500 μL三氯甲烷,漩涡振荡,使三氯甲烷与样品完全混合,再离心10 min,要上层水相,用注射器吸走下层,连续操作3次后上层水相用注射器吸取并过0.22 μm的滤膜,即得衍生化后的混标[18]。
1.2.3.2 黄精多糖的衍生化 准确称取0~9次蒸制黄精精制多糖5 mg,各自配成5 mg/mL的水溶液待用。吸取各多糖溶液200 μL于安瓿瓶中,分别加入4 mol/L的TFA溶液200 μL,用酒精喷灯封瓶,于110 ℃烘箱中水解4 h。水解完后,用氮吹仪吹干,再加入200 μL的甲醇溶液继续吹干,重复三次直至无TFA刺激性气味。随后加入150 μL的水溶解,吸取100 μL于EP管中,同“1.2.3.1”方法进行衍生化。
1.2.3.3 色谱条件 色谱柱:Inertsil ODS-3 C18,250×4.6 mm,5 μm,流动相为0.10 mol/L的磷酸盐缓冲液-乙腈(83∶17,pH=7.0),流速1 mL/min,柱温30 ℃,检测波长245 nm,进样量5 μL,检测时间40 min。
1.2.4 多糖的体外抗氧化活性测定
1.2.4.1 DPPH自由基清除能力的测定 取DPPH试剂,用乙醇配制成0.40 mmol/L的DPPH工作液待用。将多糖样品配制成2、4、6、8、10 mg/mL不同浓度的多糖溶液,分别吸取0.50 mL于具塞试管中,再依次加入0.30 mL的DPPH工作液和2 mL的去离子水,同时设置对照和背景,置于黑暗处反应30 min,每组样品设置三组平行,并以相同浓度梯度的VC为阳性对照[19]。反应结束后,用紫外-可见分光光度计测定其在517 nm处的吸光度。DPPH清除率按该方程式计算:
C(%)=[1-(A1-A2)/A0]×100
式中:C为清除率;A0为对照吸光度(0.50 mL水+0.30 mL DPPH工作液+2 mL水);A1为样品吸光度(0.50 mL样品+0.30 mL DPPH工作液+2 mL水);A2为背景吸光度(0.50 mL样品+0.30 mL水+2 mL水)。
1.2.4.2 ABTS阳离子自由基清除能力的测定 将7 mmol/L的ABTS水溶液与2.45 mmol/L的过硫酸钾水溶液按1∶1的比例混合,于黑暗处静置12 h,之后加水稀释,使其在734 nm处的紫外-可见分光光度计测得的吸光度值为0.7±0.05,即ABTS工作液配制完成。将多糖样品配制成2、4、6、8、10 mg/mL不同浓度的多糖溶液,分别吸取0.15 mL于具塞试管中,再加入3 mL的ABTS工作液,同时设置对照和背景,置于黑暗处反应6 min,每组样品设置三组平行,并以相同浓度梯度的VC为阳性对照[20]。反应结束后,用紫外-可见分光光度计测定其在734 nm处的吸光度。ABTS清除率按该方程式计算:
C(%)=[1-(A1-A2)/A0]×100
式中:C为清除率;A0为对照吸光度(0.15 mL水+3 mL ABTS工作液);A1为样品吸光度(0.15 mL样品+3 mL ABTS工作液);A2为背景吸光度(0.15 mL样品+3 mL水)。
1.3 数据处理
选用Excel 2010、SPSS 25.0进行数据处理,以及t检验显著性分析,并通过Graphpad prism 7.0软件计算黄精多糖样品DPPH自由基和ABTS阳离子自由基清除能力的半抑制浓度IC50值。
2 结果与分析
2.1 多糖含量的测定
根据葡萄糖标准曲线Y=0.0241X-0.0082,R2=0.9992,计算黄精多糖含量,结果如图1所示。从图1可看出,未蒸制时黄精多糖含量最高,达到14.36%,随着蒸制次数的增加,多糖含量逐渐减少,从第3次蒸制开始,多糖的含量趋于稳定,保持在4%左右,与陈瑞瑞等[21]的结果一致。黄精经过蒸制后,颜色逐渐加深,麻舌感逐渐消失,甜味增强,说明蒸制过程减弱了对人体的刺激性和毒害作用,并使口感变佳。但多糖的含量显著减少,这是由于在蒸制过程中,持续高温环境下多糖大量水解成单糖和低聚糖,从而导致蒸制后多糖含量减少。

图1 0~9次蒸制黄精的多糖含量变化Fig.1 Polysaccharide content Changes of Polygonatum sibiricum steamed for 0~9 times
2.2 黄精多糖中单糖组成

图2 酸降解后黄精多糖样品的单糖组成HPLC色谱图Fig.2 HPLC chromatogram of monosaccharide composition of PSPs after acidic hydrolysis注:Std为单糖混标,PSP0~PSP9为 0~9次蒸制次数的黄精多糖。
采用PMP衍生化-HPLC法检测0~9次炮制后黄精精制多糖的单糖组成,单糖PMP衍生化后,可以使其带上发色基团,具有紫外吸收,从而可以用紫外检测器对单糖进行定性定量分析[22]。检测结果如图2和表1所示。通过与混合单糖标准品色谱图对比,以及出峰时间、峰面积的大小,可以判断未蒸制黄精的多糖其单糖组成为Man、Glc、Gal、Ara,4种单糖的百分含量为52.47%、36.84%、7.32%、3.37%;蒸制后黄精多糖的单糖组成有所变化,随着蒸制次数的增加,Man的含量不断降低,从最初的52.4%减少至第九次蒸制时的18.86%;Glc的含量在前两次蒸制中降低,但随着蒸制次数的增加其含量又不断增加,最高为第九次蒸制时的52.2%;Gal和Ara随着蒸制次数的增加,其含量相对增加,其中Gal含量增加的量相对比较大。多糖在常温条件下是比较稳定的,而在蒸制过程高湿度和高温的条件下,各种糖类成分可发生脱水反应和降解反应,并且在其他成分如氨基酸的共同存在下会发生Maillard反应[23],多糖由各种单糖构成,其在炮制的过程中发生降解,进而发生其他反应变化,改变了多糖的单糖组成。

表1 九蒸九制黄精多糖的单糖组成分析Table 1 Monosaccharide composition of PSPs after nine-steam-nine-bask processing
2.3 多糖的体外抗氧化活性
DPPH是一种很稳定的自由基,颜色为紫色,它可用于测定各种抗氧化剂清除自由基的能力大小,抗氧化剂通过转移电子或传递氢原子给DPPH,从而中和自身的自由基,所以可以从对DPPH自由基的清除能力来反映抗氧化剂的供氢能力[24]。ABTS作为一种比较稳定的自由基,呈蓝绿色,它可以与抗氧化剂结合发生颜色变化,可以通过颜色变化的程度在特定的波长下测定其吸光度值来评价抗氧化剂对ABTS阳离子自由基的清除能力[25]。如图3、图4所示,黄精多糖呈现出一定的抗氧化活性。从图3中可以看出,黄精多糖对DPPH自由基有较强的清除能力,随着多糖浓度的提高其清除能力随之提高,说明清除能力与多糖浓度呈剂量依赖性;黄精多糖对ABTS阳离子自由基清除的能力要比清除DPPH自由基的能力略高,并与多糖的浓度呈相关性,但黄精多糖的清除能力均低于VC的清除能力;经蒸制后的黄精,其多糖对自由基的清除能力明显高于未蒸制黄精(P<0.05),但蒸制次数对黄精多糖抗氧化活性影响不大,只是随着蒸制次数的增加,抗氧化能力略微有所增加,如多糖浓度在10 mg/mL时,未蒸制黄精的多糖对DPPH和ABTS的平均清除能力分别为53.89%和58.63%,蒸制1~9次时多糖对DPPH和ABTS的平均清除能力分别为在60.35%~67.86%、63.32%~69.74%之间。通过Graphpad prism7.0软件计算黄精多糖样品对DPPH自由基和ABTS阳离子自由基清除能力的半抑制浓度IC50值,如表2所示,未蒸制黄精的多糖对DPPH和ABTS平均清除能力的IC50值分别为8.71和7.53 mg/mL,经蒸制后的黄精多糖对自由基平均清除能力的IC50值均低于未蒸制时黄精多糖的,说明蒸制后的黄精多糖抗氧化性更强。

图3 多糖对DPPH羟基自由基清除率Fig.3 Scavenging rate of DPPH radicals by PSPs注:PSP0~PSP9为0~9次蒸制次数的黄精多糖。图4同。
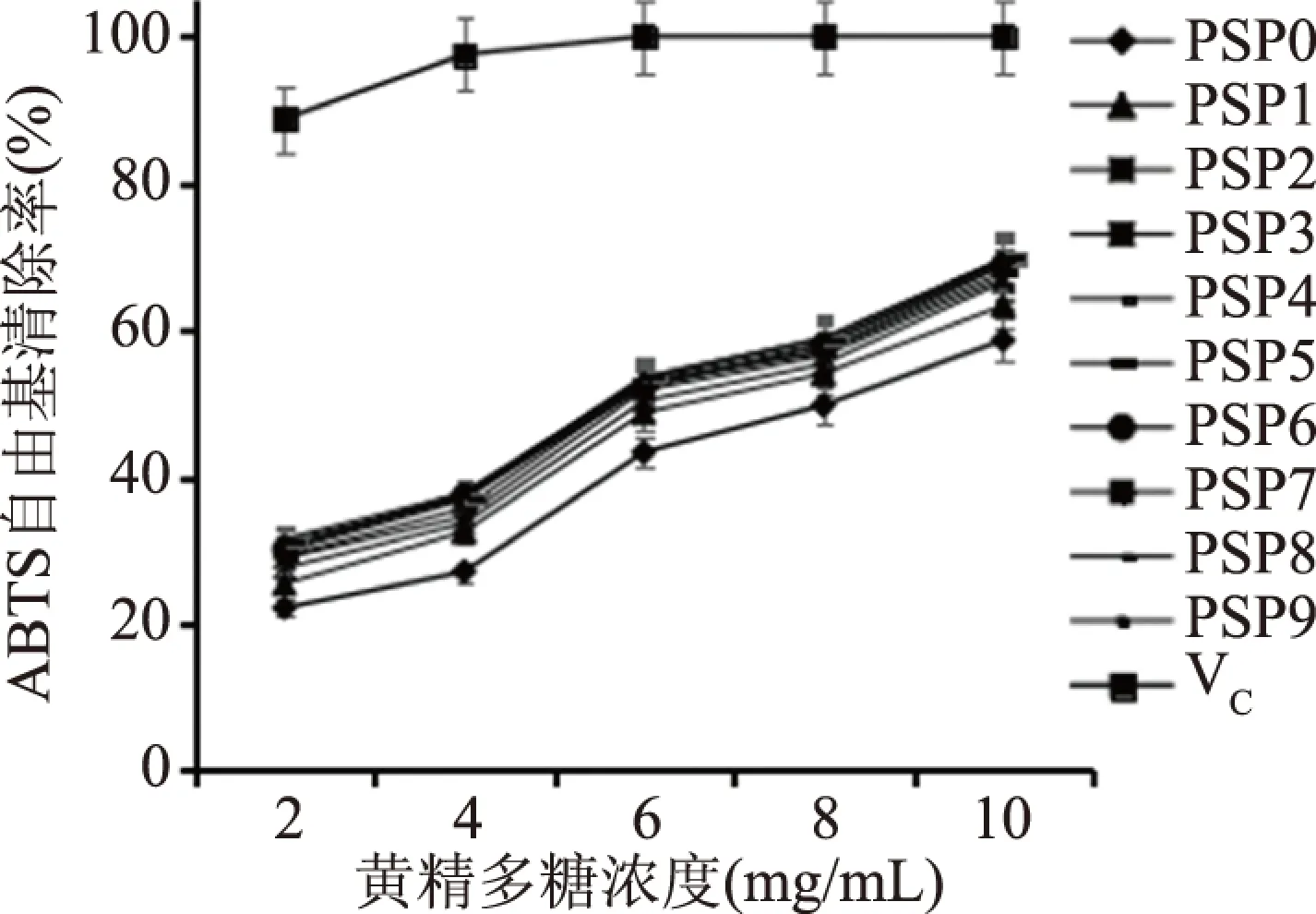
图4 多糖对ABTS阳离子自由基清除率Fig.4 Scavenging rate of ABTS cationic free radicals by PSPs
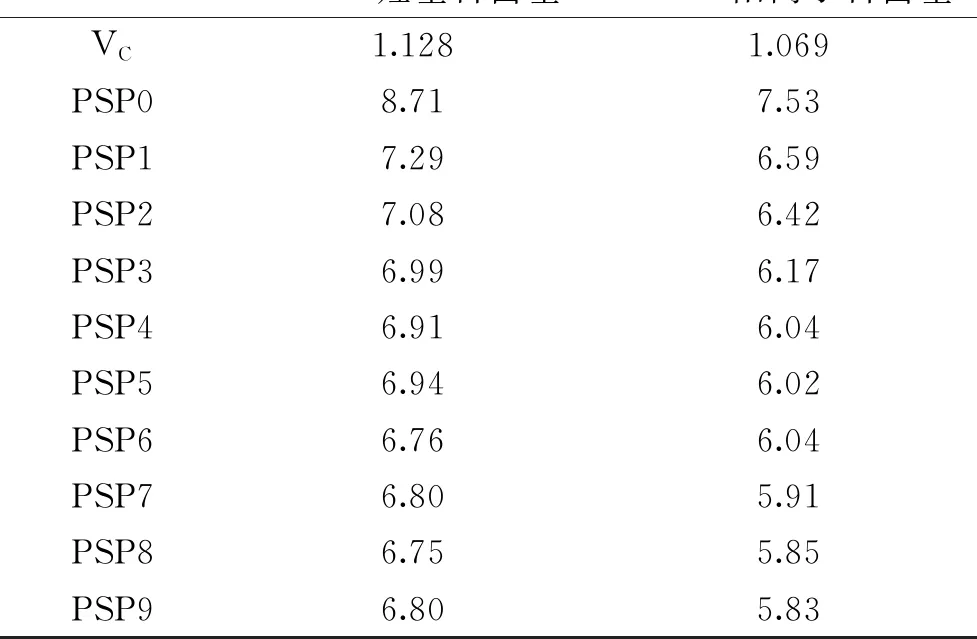
表2 九蒸九制黄精多糖的抗氧化活性Table 2 The antioxidant activity of polysaccharide in Polygonatum sibirieum
3 结论与讨论
黄精入药前往往经过炮制处理,炮制既可除去其刺激性,也方便保存,炮制前后其化学成分会发生不同程度的变化[26]。本研究采用苯酚-浓硫酸法测定蒸制过程中黄精多糖含量的变化,得出黄精在蒸制过程中,随着蒸制次数的增加,多糖含量逐渐减少,从最初的14.36%下降到4%左右,到蒸制第3次时,黄精的多糖含量趋于稳定并保持在4%左右;古法炮制讲究九蒸九制,但从多糖含量的变化来看,蒸制3次与蒸制9次已无多大差别,后续的改变可能倾向于口感的变佳和其他药效成分的增强,但究竟蒸制3次与蒸制9次的黄精药用效果是否一致,则需要进行进一步的研究。
采用水提醇沉法制备炮制黄精的多糖,并对每次蒸制后提取的多糖进行单糖组成分析测定,未蒸制黄精的多糖中主要由Man、Glc、Gal、Ara这4种单糖组成,其中Man含量最多,达到52.47%,其次是Glc,含量为36.84%,Gal的含量较低,为7.32%,Ara含量最低,含量为3.37%;通过蒸制后,Man含量减少,Glc含量先减少后增多,Gal和Ara含量增加,说明蒸制过程对黄精多糖的单糖组成有一定影响,这可能与Maillard反应有关。潘欢欢等[27]人对白术炮制过程中多糖与还原糖的含量变化进行研究,发现炮制过程中多糖和还原糖会发生转化和分解作用,而在炮制过程中高湿度和高温的条件下,还原糖会参与Maillard反应。Maillard反应是一种非酶褐变反应,它涉及羰基化合物与氨基化合物间的反应,这在食品中很重要,因为这对食品的风味和色泽起到决定性作用,另外Maillard反应中往往会引起糖的异构化和降解反应,从而改变多糖的单糖组成[28]。
通过对DPPH和ABTS自由基清除活性测定,可知黄精多糖具有一定的抗氧化活性,且抗氧化能力随多糖的浓度增加而增大,未蒸制黄精的多糖其抗氧化活性低于蒸制后黄精多糖的抗氧化活性,但蒸制的次数对黄精多糖抗氧化活性并没有过多的影响,只呈现略微增加的趋势。单糖组成对多糖的结构有着影响作用,单糖组成的不同表明化学结构的不同,这对多糖的抗氧化活性及其他活性的发挥产生一定影响,为进一步开发黄精的药用价值和经济价值提供依据。

