谷子抽穗时间基因SiTOC1的表达与单倍型变异分析
张林林,智慧,汤沙,张仁梁,张伟,贾冠清,刁现民
谷子抽穗时间基因的表达与单倍型变异分析
张林林,智慧,汤沙,张仁梁,张伟,贾冠清,刁现民
中国农业科学院作物科学研究所,北京 100081
【】谷子抽穗时间的适应性表现是广适性新品种选育的基础,分析抽穗时间关键基因的遗传变异和单倍型效应,为品种适应性改良提供基础信息。通过全基因组关联分析(genome-wide association study,GWAS),定位谷子抽穗时间关键基因,利用多组学数据库(multi-omics database for,MDSi)提供的数字表达量,分析的组织时空表达特性,并利用原生质体对SiTOC1蛋白进行亚细胞定位。采用qRT-PCR在短日(10 h光照/14 h黑暗)条件下进行24 h节律表达模式分析。利用有代表性的99份谷子品种,分析编码区和启动子区的遗传多态性、单倍型以及转录水平,并对单倍型与抽穗时间的关系进行鉴定。在第1染色体物理位置31 456 761 bp处鉴定到了一个显著的关联信号,与抽穗时间紧密相关,该位点附近存在一个拟南芥抽穗期的同源基因。在光周期响应组织(根、茎、叶等)中高表达,亚细胞定位于细胞核,在傍晚表达量上调,呈现出24 h节律性表达模式。在不同谷子品种中存在丰富的多态性,但REC和CCT结构域高度保守。编码区2种主要单倍型H-2和H-6分别与启动子单倍型Hp-591C和Hp-591A共分离,其中,启动子单倍型Hp-591C较Hp-591A的相对表达量显著上调了约2.5倍(=0.014),并且该单倍型在三亚市、长治市和乌鲁木齐市3个环境下的抽穗时间分别平均延迟9、11和12 d。启动子区第591 bp处的SNP是引起抽穗时间差异的主效位点,单倍型Hp-591A较Hp-591C早熟,可作为主效单倍型用于分子育种选择。
谷子;抽穗时间;全基因组关联分析;单倍型;遗传变异;节律性表达
0 引言
【研究意义】农作物是人类与动物能量和食物的主要来源。据预测,在2050年之前,全球农作物的单产增加100%—110%才能够满足不断增长人口的食物需求[1]。培育适宜生育期的农作物新品种,充分利用光温资源并实现更高的谷物产量,是解决这一问题的有效途径。【前人研究进展】谷子()作为起源于中国黄河流域的古老粮饲兼用作物,在中国的栽培历史超过一万年,在长期的栽培和驯化过程中形成了丰富的种质资源[2]。目前,谷子仍然是中国北方干旱、半干旱地区的重要粮食作物。谷子遗传资源按照分布区域和播种期可分为春谷和夏谷两类。已有研究结果表明,春谷主要分布在中国北方(黑龙江省)和西北部的高海拔地区,夏谷则分布在气候温暖的中部和南部地区,并且春谷平均抽穗期明显早于夏谷[3]。谷子是禾本科黍亚科二倍体(2n=2X=18)自花授粉作物,具有C4高光效、基因组较小(约430 M)的特点,目前,谷子高质量基因组测序及组装已经完成[4-5],稳定高效的遗传转化体系也已建立[6],单倍型物理图谱已经构建[3]完成,正在快速发展成为旱生C4禾谷类作物分子研究的模式植物。植物能够整合季节性光周期和冬季温度等外源信号及其内源性调节物质来调节开花时间[7]。日照时数和温度,特别是光周期开花和春化过程与抽穗期紧密相关,并且这些调节途径由多个基因共同决定[8-9]。CCT家族基因编码的蛋白(CONSTANS、CO-like和TOC1)具有CCT蛋白保守结构域,作为一类调控开花的转录因子,在植物花期调控过程中发挥了重要作用[10]。根据N末端结构域,CCT家族基因编码的蛋白质可分为3个进化枝,即CONSTANS-like(COL)进化枝,CCT MOTIF FAMILY(CMF)进化枝和PSEUDORESPONSE REGULATOR(PRR)进化枝。COL蛋白具有1或2个B-box型锌指结构域,如拟南芥基因()和水稻基因();CMF蛋白在N末端没有保守结构域,如水稻基因()[11];PRR蛋白具有伪受体(response regulator receiver motif,REC)结构域,如拟南芥昼夜节律系统关键调控基因(,也称为)和水稻基因(也称为)[12-14]。CO是第一个被报道的CCT家族基因,在拟南芥中介导了上游光周期信号与下游成花素基因间的协同调控[15]。研究发现,水稻CCT结构域发生错义突变,形成PRR37/Hd2和Ghd7/Hd4 2种功能缺失突变,进而拓宽了水稻抽穗期从温暖地区到寒凉地区的适应性[16]。已有研究表明,拟南芥昼夜节律振荡器由多个连锁的转录反馈网络环组合而成[17-19],振荡器核心部位成员包括MYB转录因子()和(),以及伪响应调节器(),其中,的突变体表现为振荡节律紊乱,抽穗期提前且早熟,叶片数及生物量下降[10]。亚细胞定位结果表明,该蛋白定位于细胞核,在被LHY/CCA1蛋白复合体负向调节的同时可以正向调节和的表达[20-21]。【本研究切入点】目前,虽然的昼夜节律特点和光周期开花调控规律已经在双子叶植物中初步解析,但在禾谷类作物中的表达规律和自然变异特点仍然缺乏了解,如何利用节律振荡器的早熟效应拓宽农作物的适种范围,寻找优异单倍型并进而提高禾谷类作物育种的效率和水平,是目前亟待解决的理论和应用问题。【拟解决的关键问题】中国拥有世界上最丰富多样的谷子种质资源,并且谷子单倍型物理图谱已经构建完成[3],本研究采用全基因组关联分析的方法定位谷子抽穗时间基因,对该基因的时空表达、亚细胞定位、光周期响应规律及序列变异与抽穗时间之间的关系进行研究,为谷子高效遗传改良和广适性分子育种提供指导信息,为解决谷子抽穗时间分子标记匮乏问题奠定基础。
1 材料与方法
1.1 种质资源表型鉴定
以尽可能囊括不同地理来源、不同基因型品种多样性为原则,有代表性地挑选以中国地区为主来自世界各地的99份谷子品种(地方品种66份和育成品种33份)作为研究材料(电子附表1),分别在三亚市(2010年)、长治市(2016年)和乌鲁木齐市(2016年)3个不同生态环境下种植。每品种播种两行,行长3 m,调查出苗期和抽穗期,每穗行50%幼苗展开第一片真叶的日期即为谷子出苗期,每穗行50%植株穗露出旗叶鞘的日期即为谷子抽穗期[22]。计算出苗次日至50%植株抽穗日的天数即为抽穗时间(单位:天)。
1.2 全基因组关联分析
采用TASSEL 5.0软件进行全基因组关联分析,所使用的单倍型图谱及遗传结构数据均来自已经发表的结果[3]。采用混合线性MLM模型进行数据运算,采用R软件包qqman[23]完成数据分析。谷子基因组注释文件下载自:https://phytozome.jgi.doe.gov/pz/portal. html。
1.3 生物信息学分析
将(Photozyme数据库基因号:)的蛋白序列提交至Uniprot蛋白数据库(https://www.uniprot.org)进行蛋白序列Blast,挑选出拟南芥()、水稻()、玉米()、小麦()、高粱()、大豆()、棉花()、蒺藜苜蓿()等不同物种对应同源蛋白序列的Fasta格式导入到MEGA 6软件中进行多序列比对,将比对好的同源蛋白序列利用邻接法(Neighbor-joining)构建系统发育进化树,步长值设为1 000,其他参数为默认值。
1.4 表达及亚细胞定位
在谷子多组学数据库(MDSi:Multi-omics Database for,http://foxtail-millet.biocloud. net/home)表达量可视化(expression visualization)栏目中检索()获得数字表达量FPKM值,分析的时空组织表达特异性。
以已完成全基因组测序的豫谷1号[5]cDNA为模板,分别用亚细胞定位N端载体引物对GFPG5-F1/ GFPG5-R1和C端载体引物对G5GFP-F1/G5GFP-R1(去除终止密码子)(表1)对的CDS进行PCR扩增,以日本晴cDNA为模板,用亚细胞定位N端载体引物对MYBRFP-F/MYBRFP-R对已报道核定位基因[24]的CDS进行PCR扩增。利用限制性内切酶Ⅰ和Ⅰ消化亚细胞定位PUC-N端载体;限制性内切酶Ⅰ和Ⅰ消化亚细胞定位PUC-C端载体,将获得的N端、C端和N端PCR回收产物利用同源重组酶Phanta®Max Super-Fidelity DNA Ploymerase(Vazyme #P505)连接到纯化回收后的线性化的PUC-N和PUC-C端载体上分别完成35S∷GFP︰SiTOC1、35S∷SiTOC1︰GFP和35S∷RFP︰OsMYB2亚细胞定位载体的构建。将构建好的亚细胞定位N端、C端载体和Marker载体转化到大肠杆菌中挑取单克隆,分别用N端、C端载体检测引物对PUCGFPN- TestF/PUCGFPN-TestR(GFPG5-F1.1和GFPG5-R1.1为内部测序引物)、PUCGFPC-TestF/PUCGFPC-TestR(G5GFP-F1.1和G5GFP-R1.1为内部测序引物)和PUCRFPN-TestF/PUCRFPN-TestR检测阳性克隆(表1),并对阳性克隆完成双向测序和序列拼接,挑选与参考序列完全一致的单克隆提取质粒(浓度不低于500 ng·μl-1)。提取豫谷1号谷子原生质体,将构建好的SiTOC135S∷ GFP︰SiTOC1和35S∷SiTOC1︰GFP亚细胞定位N端、C端载体分别与Marker载体35S∷RFP︰OsMYB2共转和空载体同时转化谷子原生质体,利用共聚焦电子显微镜ZenLightEdition(厂家:Carl Zeiss MicroImaging)观察转化后的原生质体并生成亚细胞定位结果图。
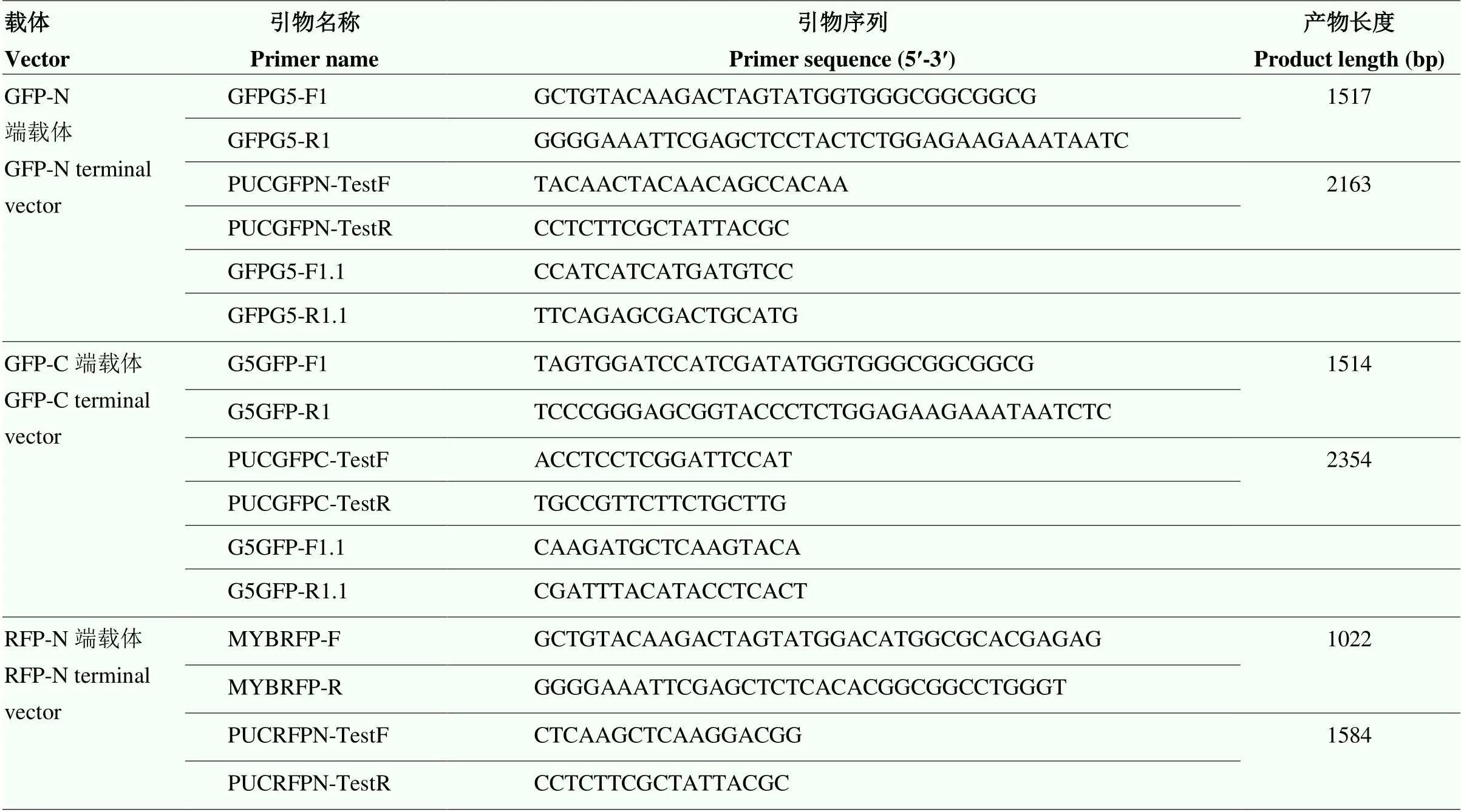
表1 SiTOC1亚细胞定位载体构建PCR扩增及测序引物
GFP-N端载体对应35S∷GFP∶SiTOC1,RFP-N端载体对应35S∷RFP∶OsMYB2,其中,GFPG5-F1.1和GFPG5-R1.1仅为测序引物;GFP-C端载体对应35S∷SiTOC1︰GFP,其中,G5GFP-F1.1和G5-R1.1仅为测序引物
The GFP-N end vector corresponds to 35S∷GFP︰SiTOC1, the GFP-N end vector corresponds to 35S∷RFP︰OsMYB2, of which GFPG5-F1.1 and GFPG5-R1.1 are only sequencing primers. the GFP-C end vector corresponds to 35S∷SiTOC1︰GFP, of which G5GFP-F1.1 and G5-R1.1 are only sequencing primers
1.5 表达节律分析
利用光、温敏感的Ci846作为研究材料,将Ci846种子播种于短日条件(10 h光照/14 h黑暗)、28℃恒温培养箱中培养至5叶1心期进行24 h光周期取样,取地上部组织,每隔2 h取样一次,其中7:00至17:00为光照阶段,17:00至次日7:00为黑暗阶段,共取样13次,将取好的样品放置于液氮中冷冻,利用全式金的TransZol Up(Lot#O10707)试剂盒,按照操作说明完成所有样品总RNA的提取,提取好的RNA用2%的琼脂糖凝胶电泳检测RNA的完整性,结果显示,能够看到清晰明亮的28s和18s带型,28s带型约为18s亮度的2倍,5s带型亮度较弱,吸取各样本RNA原液2 μl利用Nanodrop ND 1000分光光度计(厂家:美国Nano Drop)检测OD260/OD280比值和RNA浓度,OD260/OD280比值为1.7—2.1,代表RNA完整性及纯度良好。利用TakaRa厂家的PrimeScriptTM Ⅱ1st Strand cDNA Synthesis Kit(Cat # 6210A)试剂盒对提取好的样品RNA取2 000 ng反转成双链cDNA。利用荧光定量引物对G5Q-F1/G5Q-R1和内参基因荧光定量引物对Cullin-F/Cullin-R(表2)进行荧光定量PCR(3次技术重复),所用试剂为Realtime PCR Super mix SYBRgreen with anti-Taq(Cat #MF013-01)。配置好的PCR反应液瞬离后放入荧光定量PCR仪(厂家:ROCGENE,型号:Archimed-X6系统),对PCR反应结束后输出的Ct值利用2-△△Ct公式[25]计算各样品的相对表达量进行节律表达分析。

表2 SiTOC1 PCR扩增和测序引物
(Photozyme基因号:)为qPCR内参基因,G5P-F1.1和G5P-R1.1仅为测序引物
(Gene ID:) is the reference gene of qPCR, G5P-F1.1 and G5P-R1.1 are only sequencing primers
1.6 单倍型变异分析
利用CTAB法[26]提取不同谷子品种叶片基因组DNA,稀释一份200 ng·μl-1DNA工作液用于PCR,其余DNA原液-40℃保存。分别设计引物对G5-F1/ G5-R1和G5-F2/G5-R2对编码区DNA完成PCR扩增和测序,引物对G5P-F1/G5P-R1对启动子区完成PCR扩增,G5P-F1.1和G5P-R1.1为内部测序引物(表2)。采用Primer STAR® HS DNA Polymerase with GC Buffer(Cat#R044A),按试剂说明书配置PCR反应液。配置好的PCR反应液瞬离后放入PCR仪(厂家:新加坡Veriti,型号:VeritiTM 96-well Thermal Cycler)进行PCR反应。用1.5%的琼脂糖凝胶电泳检测PCR产物,结果均为单一的目的条带,将样品特异的PCR产物进行双向测序,利用DNAMAN软件完成序列拼接。将拼接好的所有样品序列提交至MEGA 6软件完成多序列比对,比对好的序列文件提交至DnaSP v.5.0提取变异位点[27],并对所有变异位点进行单倍型分析。将分析好的单倍型文件(rdf格式)使用Network软件分析单倍型之间的衍生关系生成单倍型Network网络图。
1.7 启动子单倍型转录水平分析
将挑选出的Hp-591A单倍型材料Ci001、Ci023、Ci086、Ci162、Ci846和Hp-591A单倍型材料Ci038、Ci082、Ci115、Ci138、Ci222播种于短日条件(10 h光照/14 h黑暗)、28℃恒温培养箱中培养至5叶1心期,取地上部组织提取RNA、反转成cDNA、使用引物对G5Q-F1/G5Q-R1和引物对Cullin-F/Cullin-R(表2)对进行荧光定量PCR(3次技术重复),并计算各样品的相对表达量。
2 结果
2.1 谷子抽穗时间基因SiTOC1的关联分析定位
通过全基因组关联分析,在第1染色体物理位置31 456 761 bp处鉴定到了一个显著的关联信号(2010年三亚市),与抽穗期紧密相关(图1-A)。在该位点上下游50 kb区间内共存在7个编码基因(图1-B),统计7个候选基因的功能注释信息(表3)发现为拟南芥同源基因,该基因属于CCT基因家族,与抽穗时间密切相关。
2.2 SiTOC1的基因结构与同源衍化
编码区全长2 266 bp,包含6个外显子和5个内含子。SiTOC1蛋白N端第28—143位氨基酸(1、2、3外显子)存在一个REC结构域(response regulator receiver domain),C端第443—486位氨基酸(第6外显子)存在一个CCT结构域(CCT domain)(图2-A)。对SiTOC1在拟南芥、水稻、玉米、小麦、高粱、大豆、棉花、蒺藜苜蓿等不同物种中的同源蛋白序列构建系统发育进化树,并对其基因结构和作用基序进行比较分析,结果显示同源蛋白系统进化树划分为两大分枝:分枝Ⅰ均为单子叶植物;分枝Ⅱ均为双子叶植物。谷子SiTOC1在分枝Ⅰ中与高粱、玉米、水稻具有更高的相似度(图2-B)。基因结构比较发现在不同物种中具有保守的基因结构,并且共享保守的REC和CCT结构域。
2.3 SiTOC1的表达规律及亚细胞定位
利用谷子MDSi数据库表达量数据对进行组织特异性表达分析,结果显示,在根、茎、叶、穗等多个组织中表达,其中,在2叶1心期整株、灌浆期穗下茎、灌浆期旗叶、灌浆期旗叶叶鞘、灌浆期顶端正数第二茎、灌浆期顶端正数第四叶、灌浆期顶端正数第四叶叶鞘、灌浆期根、叶脉、叶肉高表达,但在穗部的小码表达量相对较低(图3-A)。SiTOC1和GFP融合蛋白(35S∷SiTOC1︰GFP及35S∷GFP︰SiTOC1)在谷子原生质体中的亚细胞定位结果显示SiTOC1定位于细胞核(图3-B),这与拟南芥同源基因结果一致,表明可能和一样作为转录因子执行相似的生物学功能。
2.4 SiTOC1 24 h节律表达模式分析
24 h表达节律结果显示,与CCT家族基因相似,在24 h短日(10 h光照/14 h黑暗)光周期条件下具有震荡表达模式(图4),在7:00—11:00受光照阶段的前4 h表达量较低,在开始光照2 h后(9:00)几乎不表达,从11:00开始表达量开始上升,在临近黑暗条件表达量急剧上升,在给光10 h后即在光照与黑暗临界点17:00时,表达量达到峰值。在黑暗处理2 h(19:00—21:00)后表达量急剧下降,随后呈现平缓下降的趋势,在黑暗处理12 h(即次日凌晨5:00)后表达量降至最低。
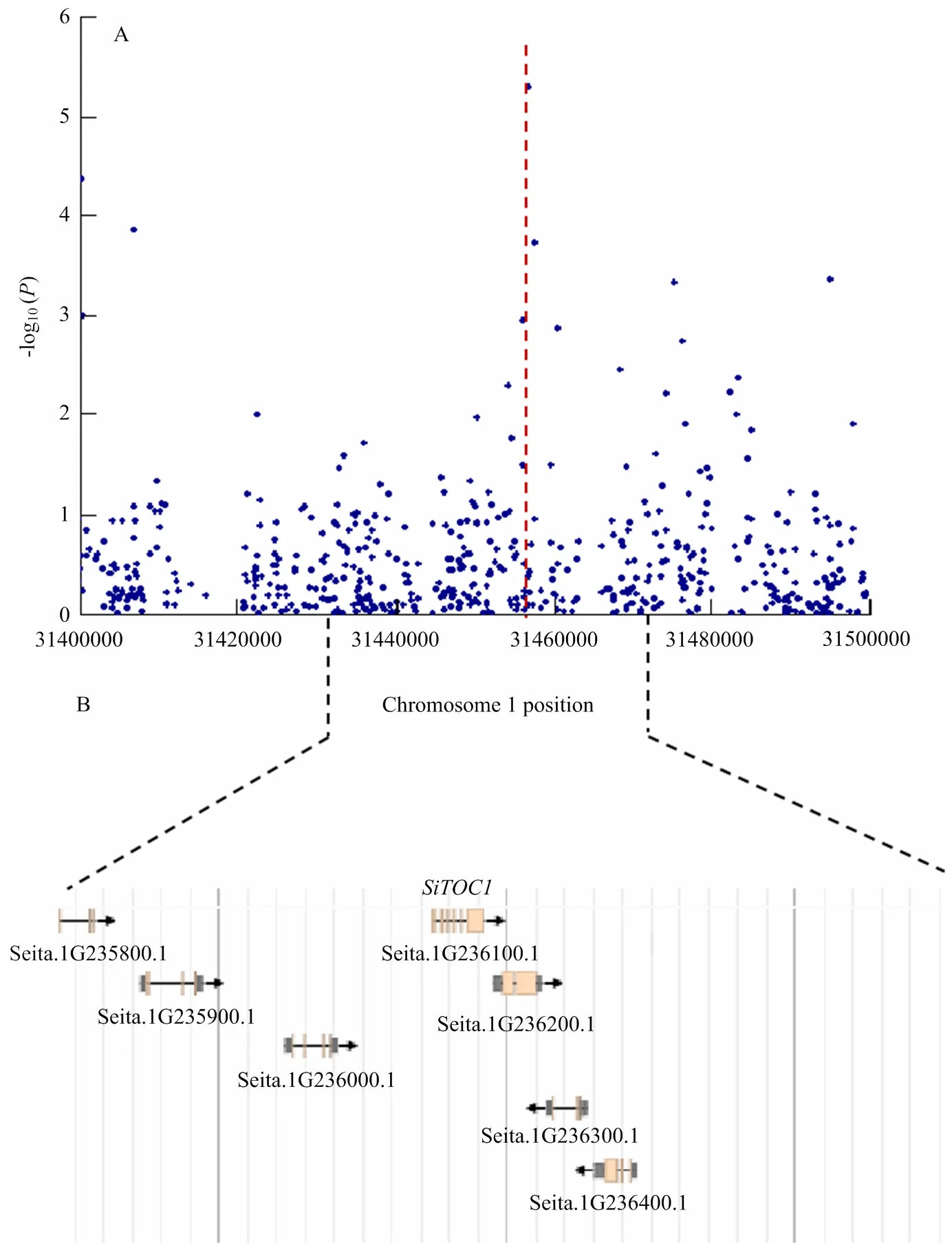
A:SiTOC1 GWAS定位结果;B:关联位点区间内的候选基因 A: Results of SiTOC1 GWAS; B: Candidate gene in the associated locus range
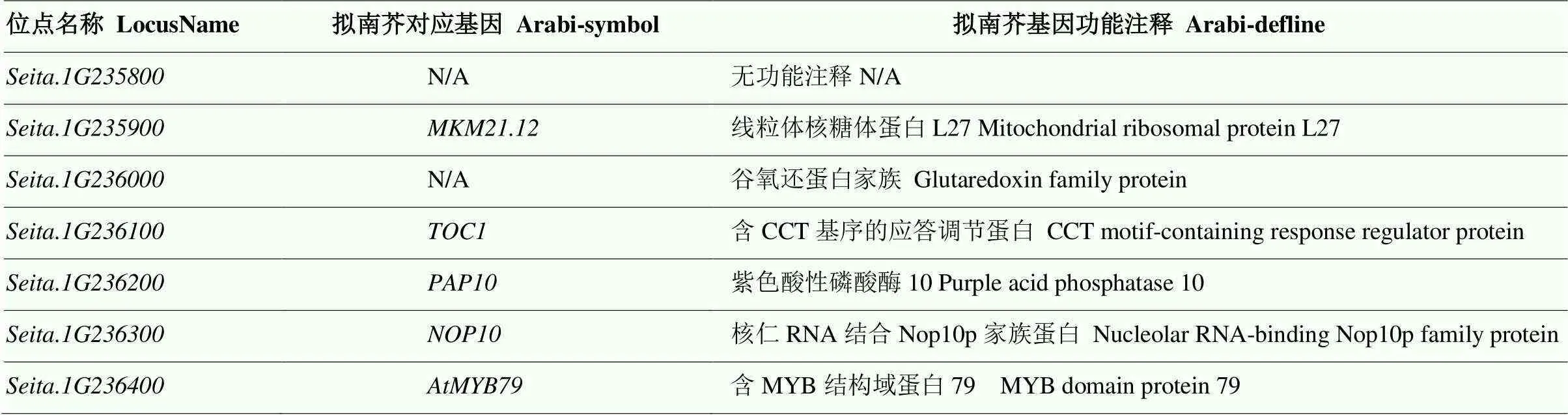
表3 候选基因注释信息
红色字体标注同源基因(Seita.1G236100);N/A表示无注释信息
homologous gene(Seita.1G236100) is marked in red font; N/A indicates no annotation

A:SiTOC1的基因结构;B:SiTOC1同源蛋白系统进化树和基因结构。GRMZM2G020081_T01:玉米;Sobic.004G216700.1:高粱;Sevir.1G241000.1:狗尾草;Seita.1G236100.1 (SiTOC1):谷子;LOC_Os02g40510.1:水稻;Traes_6AL_A0A31AA9F.1:小麦;AT5G61380.1:拟南芥;Gorial.003G098300.2:棉花;Glyma.06G196200.1:大豆;Medtr4g108880.2:蒺藜苜蓿
2.5 SiTOC1核苷酸序列遗传多态性分析
对不同地理来源的99份谷子品种(地方品种66份,育成品种33份)的编码区所有的变异位点进行分析,结果表明,编码区呈现出丰富的遗传变异,全长2 266 bp的编码区共存在148个变异位点,其中共有130个SNP和18个Indel,这些变异位点共组合成44种单倍型,且变异位点多集中于内含子区。外显子区的SNP多为同义突变,但存在13个非同义SNP位点,分别为g46a(V/M)、g109c(A/P)、g1295a(D/N)、g1428t(I/R)、g1551a(S/N)、t1556a(L/I)、g1707a(R/Q)、g1718t(G/C)、g1756t(Q/H)、a1824c(E/A)、t1847c(Y/H)、c1856t(P/S)和g2180a(V/I)(图5)。REC结构域共存在25个变异位点,其中20个SNP位点为无义突变,5个位点均导致了移码突变但均为稀有变异;CCT结构域则十分保守,未发生突变。编码区划分的44类单倍型中存在2个主型,分别为H-2(单倍型频率为13)和H-6(单倍型频率为10)(图6);两类主要单倍型之间共存在7个变异位点,其中1个Indel位点为1099+c(稀有变异),6个SNP位点中5个为无义突变分别是g232t、t305c、a351t、t412c和a831g,1个有义突变为g1428t(I/R)。对编码区的遗传变异分析发现编码区存在丰富的多态性,但其重要的2个功能域REC和CCT却高度保守。
启动子区的遗传变异常与基因的表达量紧密相关。对不同地理来源的29份谷子地方品种的启动子进行单倍型分析,共检测到60个变异位点,包括44个SNP位点和16个Indel位点,共有14种单倍型,包括2种主要单倍型Hp-3(单倍型频率为4)和Hp-4(单倍型频率为12)(图7-A)。这两类单倍型仅在ATG上游第591 bp处存在一个SNP(C-591A),其中单倍型Hp-3在该位点为C,单倍型Hp-4在该位点处为A,暗示该位点可能会影响的转录水平。启动子单倍型Hp-591C(单倍型频率为16)和Hp-591A(单倍型频率为13)的相对表达量分析结果显示,Hp-591C表达量高于Hp-591A(图7-B),上调了近2.5倍(=0.014)(图7-C)。

A:SiTOC1的组织特异性分析:a:2叶1心期整株;b:灌浆期穗下茎;c:灌浆期旗叶;d:灌浆期旗叶叶鞘;e:灌浆期顶端正数第二茎;f:灌浆期顶端正数第四叶;g:灌浆期顶端正数第四叶叶鞘;h:灌浆期根;i:发育早期穗部小码;j:发育晚期穗部小码;k:叶脉;l:叶肉。B:SiTOC1的亚细胞定位,红色荧光蛋白信号通道显示35S∷RFP∶OsMYB2的信号,比例尺bar=10 μm

顶部条框的白色部分对应光照时间段(7:00—17:00),黑色部分对应黑暗时间段(17:00—7:00)
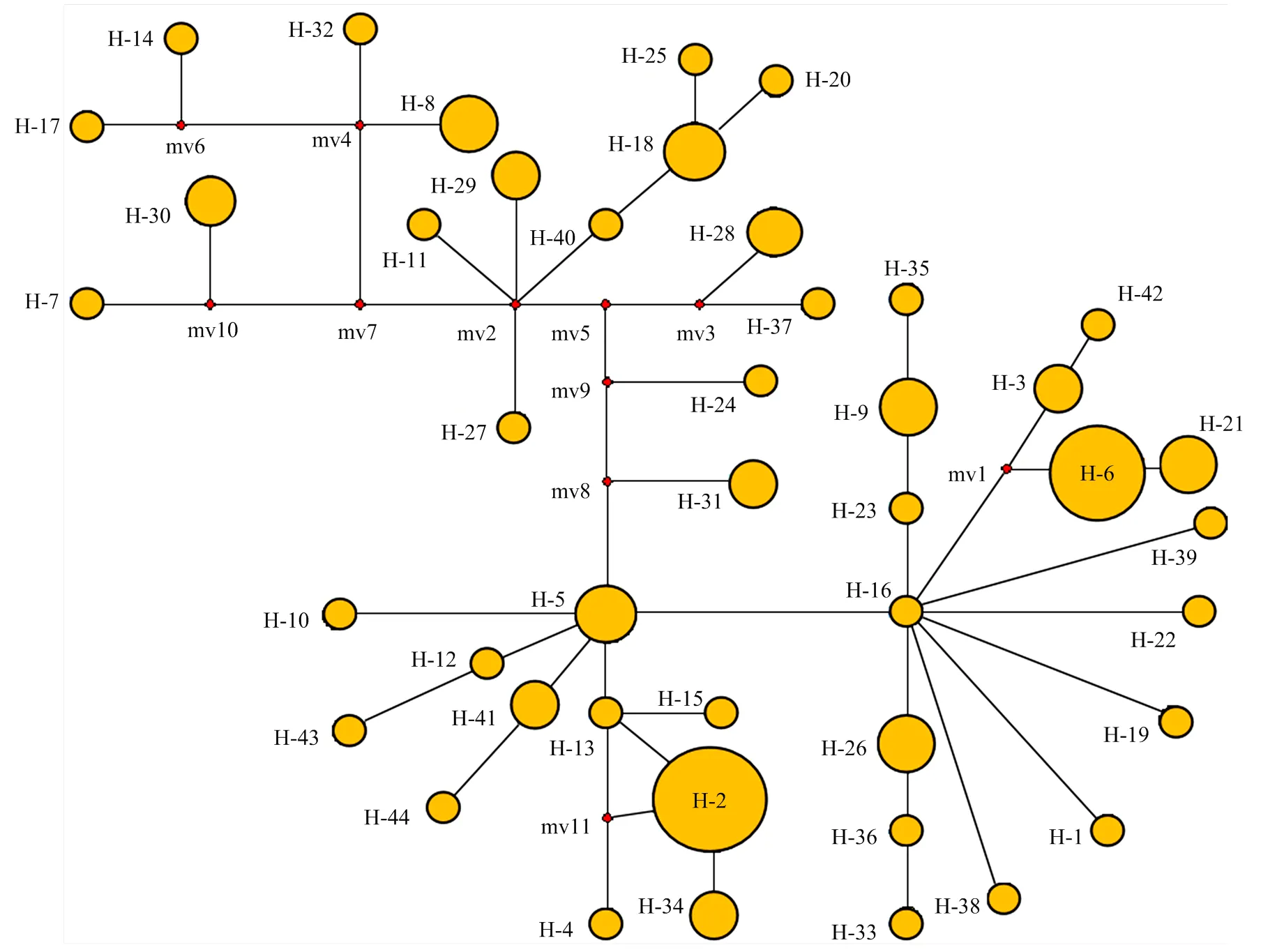
SiTOC1编码区单倍型Network图,不同实心圆代表不同单倍型,圆的面积和对应单倍型所包含的品种数量成正比,黑色连接线代表不同单倍型的突变步骤,连接线上的红色圆点代表大于一次的突变步骤
2.6 SiTOC1单倍型与抽穗时间的相关性分析
编码区两类单倍型抽穗时间差异分析结果(图8)表明,H-2单倍型在3个环境下(2010三亚市、2016长治市、2016乌鲁木齐市)的抽穗时间均显著晚于H-6单倍型,在2016乌鲁木齐市达到了极显著差异水平(=0.0089)(图8-A);启动子区单倍型Hp-591C和Hp-591A在3个环境下的抽穗时间差异显著性分析结果显示,Hp-591C单倍型在3个环境下的抽穗时间均显著晚于Hp-591A单倍型(图8-B),分别平均延迟9、11和12 d。通过比较编码区单倍型H-2和H-6,仅存在一个有义突变:g1428t(I/R),该分离位点在3个环境下的抽穗时间均无显著差异(电子附图1)。鉴于H-2单倍型和Hp-591C单倍型与H-6单倍型和Hp-591A单倍型共分离,推测在3个环境下抽穗时间的显著差异主要决定于启动子区的变异。
3 讨论
3.1 TOC1功能在禾谷类作物中具有保守型
从同源基因进化分析结果可以看出,不同物种中的具有保守的REC和CCT结构域(图2),暗示不同物种中的也许具有近似的功能,尤其是禾谷类作物中的由于具有较高的序列保守性,功能可能更为接近。拟南芥功能分析发现,该基因的突变可导致生物钟节律由24 h变为21 h左右,导致拟南芥植株对24 h光周期下的长日和短日响应变弱,相比野生型表现出了早熟、生物量降低的现象[10]。谷子编码基因的时空表达规律也表现出了生物钟基因特点,并且SiTOC1定位于细胞核,这和拟南芥中研究认为作为核定位的转录因子行使功能结果一致。谷子单倍型变异分析显示,该基因表达量的降低可导致早熟效应,这和拟南芥中观察到的结果趋势相同[10]。本研究的结果表明,禾谷类作物中功能与双子叶植物类似,突变或表达量降低可引起早熟效应,具有潜在的育种利用价值。
A:SiTOC1启动子单倍型Network图;B—C:SiTOC1启动子单倍型相对表达量分析,P=0.014。*:在P<0.05水平达到显著差异。下同

**:在P<0.01水平达到极显著差异。A:SiTOC1编码区单倍型与抽穗时间数据的差异显著性分析,其中2010三亚市P=0.0180,2016长治市P=0.0290,2016乌鲁木齐市P=0.0089;B:SiTOC1启动子单倍型与抽穗时间数据的差异显著性分析,其中2010三亚市P=0.0262,2016长治市P=0.0106,2016乌鲁木齐市P=0.0257
已知水稻CCT家族基因/Hd2和/Hd4 2种发生在CCT结构域的功能缺失的自然等位突变拓宽了水稻抽穗期的适应性[17]。分析不同谷子品种编码区的遗传多态性,发现编码区存在丰富的遗传多样性,全长2 266 bp的编码区在99份谷子不同品种中共检测到148个变异位点,单倍型分析发现所有变异位点组合成了丰富的单倍型变异类型共计49种。虽然存在丰富的核苷酸多态性,但编码区REC,CCT结构域却高度保守,REC结构域检测到25个变异位点,其中20个SNP位点均为同义突变,5个Indel位点均导致了移码突变但均为稀有变异。处在光周期途径中昼夜节律振荡器的核心位置,已知REC和CCT结构域是SiTOC1的关键作用基序,尤其CCT结构域涉及核定位、DNA结合和蛋白质-蛋白质相互作用,可直接作用于/并抑制其表达,该作用基序发生突变或者删除可导致SiTOC1对/的抑制作用消除[15-16],因此的REC、CCT结构域在不同地理来源的谷子品种中表现出了保守性,对于稳定谷子的抽穗时间表现具有重要意义。
3.2 SiTOC1具有主效单倍型并在多环境下表现早熟效应
本研究分析了编码区和启动子区的单倍型,发现编码区的2种主要单倍型H-2和H-6与启动子区Hp-591C和Hp-591A单倍型共分离,共同引起谷子抽穗时间在多环境下的显著差异。通过比较分析发现相比于编码区,启动子区C-591A可能是影响谷子抽穗时间的一个重要位点,该分离位点产生的单倍型Hp-591C和Hp-591A的相对表达量以及抽穗时间均存在显著差异,并且Hp-591C具有更高的表达量和较长的抽穗时间。因此Hp-591A可作为早抽穗单倍型用于育种选择。已有研究发现启动子区的EE元件(evening element,AAAATATCT)是节律响应的重要顺式作用元件,Myb类转录因子CCA1和LHY可直接结合启动子区的EE元件抑制的表达[20-21],而启动子区EE元件在所有品种中保守,未发生突变,因此C-591A分离位点可能位于其他特殊的顺式作用元件或者结合位点从而影响的转录表达,该位点的具体作用还需要深入开展遗传研究加以核实。本研究的结果直接证实了主效单倍型的存在,并发现在不同纬度条件下主效单倍型的效应稳定且显著,具有潜在的育种利用价值。
3.3 谷子广适性品种选育可能的技术途径
快速、有效地改良抽穗时间,实现农作物对不同光周期环境的适应性改良具有重要的实践意义。谷子是光周期敏感作物,对不同光周期生态区域的适应性较差。近年来,豫谷18、中谷2等广适性谷子新品种的选育成功[28],在一定程度上说明了开展谷子广适性育种的可行性。本研究发现主效单倍型的存在和潜在的利用途径,有望在未来的谷子新品种改良过程中发挥作用。
在禾谷类作物水稻中关于CCT类基因的研究进展表明,在不同的日长中显示出双功能,在日本晴中短日条件促进开花,长日条件延迟开花[29],而且可在昼夜节律的调节下触发下游的成花素表达[30]。此外,的双功能特性与背景有关:在长日照条件下,被诱导抑制谷物中编码B型响应调节剂的特异开花激活基因的表达,导致成花素减少和开花时间延迟[31],在镇山97中,持续促进开花,当基因组中存在时,与相互作用并导致开花延迟[32]。除了、和也能够实现从促进开花到延迟开花的功能逆转[33-34]。已有的调控网络分析结果表明,、和之间以及、和之间的遗传相互作用增强了对的抑制作用[35]。从水稻中已有的研究结果来看,CCT类基因普遍与抽穗期适应性调控紧密相关,开展相关基因的遗传变异分析对于寻找相关基因的育种利用途径具有重要的理论和实践指导意义。
可以看出,谷子CCT类基因之间的转录调控及其遗传相互作用也应该普遍存在,需要育种工作者进一步开展相关基因的自然变异及遗传效应研究,为谷子广适性新品种选育提供更多分子标记。此外,通过在禾谷类作物中开展更多CCT类基因的变异和单倍型效应研究,也必将极大地促进相关育种工作的高效开展,为广适性新品种选育及保障国家粮食安全提供更多指导信息。
4 结论
谷子SiTOC1具有保守的REC和CCT结构域,在响应光周期的组织(根、茎、叶)中高表达,具有CCT家族基因典型的昼夜节律性表达模式并定位于细胞核。编码区主要单倍型H-2和H-6与启动子区效应位点(C-591A)共分离,该效应位点单倍型Hp-591C的表达量较Hp-591A显著上调,导致谷子品种在三亚市、长治市和乌鲁木齐市3个不同环境下的抽穗时间分别平均延迟9、11和12 d。
[1] Tilman D, Balzer C, Hill J, Befort B L. Global food demand and the sustainable intensification of agriculture. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(50): 20260-20264.
[2] Barton L, Newsome S D, Chen F H, Wang H, Guilderson T P, Bettinger R L. Agricultural origins and the isotopic identity of domestication in northern China. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(14): 5523-5528.
[3] Jia G Q, Huang X H, Zhi H, Zhao Y, Zhao Q, Li W J, Chai Y, Yang L, Liu K Y, Lu H Y, Zhu C R, Lu Y Q, Zhou C C, Fan D L, Weng Q J , Guo Y L, Huang T, Zhang L, Lu T T, Feng Q, Hao H F, Liu H K, Lu P, Zhang N, Li Y H, Guo E,Wang S J, Wang S Y, Liu J R, Zhang W F, Chen G Q, Zhang B G, Li W, Wang Y F, Li H Q, Zhao B H, Li J Y, Diao X M, Han B. A haplotype map of genomic variations and genome-wide association studies of agronomic traits in foxtail millet (). Nature Genetics, 2013, 45(8): 957-961.
[4] Bennetzen J L, Schmutz J, Wang H, Percifield R, Hawkins J, Pontaroli A C, Estep M, Feng L, Vaughn J N, Grimwood J, Jenkins J, Barry K, Lindquist E, Hellsten U, Deshpande S, Wang X W, Wu X M, Mitros T, Triplett J, Yang X H, Ye C Y, Mauro-Herrera M, Wang L, Li P H, Sharma M, Sharma R, Ronald P C, Panaud O, Kellogg E A, Brutnell T P, Doust A N, Tuskan G A, Rokhsar D, Devos K M. Reference genome sequence of the model plant. Nature Biotechnology, 2012, 30(6): 555-561.
[5] Zhang G Y, Liu X, Quan Z W, Cheng S F, Xu X, Pan S K, Xie M, Zeng P, Yue Z, Wang W L, Tao Y, Bian C, Han C L, Xia Q J, Peng X H, Cao R, Yang X H, Zhan D L, Hu J C, Zhang Y X, Li H N, Li H, Li N, Wang J Y, Wang C C, Wang R Y, Guo T, Cai Y J, Liu C Z, Xiang H T, Shi Q X, Huang P, Chen Q C, Li Y R, Wang J, Zhao Z H, Wang J. Genome sequence of foxtail millet () provides insights into grass evolution and biofuel potential. Nature Biotechnology, 2012, 30(6): 549-554.
[6] Yang Z R, Zhang H S, Li X K, Shen H M, Gao J H, Hou S Y, Zhang B, Mayes S, Bennett M, Ma J X, Wu C Y, Sui Y, Han Y H, Wang X C. A mini foxtail millet with an-like life cycle as a C4 model system. Nature Plants, 2020, 6(9): 1167-1178.
[7] Colasanti J, Coneva V. Mechanisms of floral induction in grasses: something borrowed, something new. Plant Physiology, 2009, 149(1): 56-62.
[8] Andrés F, Coupland G. The genetic basis of flowering responses to seasonal cues. Nature Review Genetics, 2012, 13(9): 627-639.
[9] Rieseberg L H, Willis J H. Plant speciation. Science, 2007, 317(5840): 910-914.
[10] Strayer C, Oyama T, Schultz T F, Raman R, Somers D E, Más P, Panda S, Kreps J A, Kay S A. Cloning of theclock gene, an autoregulatory response regulator homolog. Science, 2000, 289(5480): 768-771.
[11] Cockram J, Thiel T, Steuernagel B, Stein N, Taudien S, Bailey P C, O'Sullivan D M. Genome dynamics explain the evolution of flowering time CCT domain gene families in the. PLoS One, 2012, 7(9): e45307.
[12] Wenkel S, Turck F, Singer K, Gissot L, Le Gourrierec J L, Samach A, Coupland G. CONSTANS and the CCAAT box binding complex share a functionally important domain and interact to regulate flowering of. The Plant Cell, 2006, 18(11): 2971-2984.
[13] Gendron J M, Pruneda-Paz J L, Doherty C J, Gross A M, Kang S E, Kay S A.circadian clock protein, TOC1, is a DNA-binding transcription factor. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(8): 3167-3172.
[14] Makino S, Matsushika A, Kojima M, Yamashino T, Mizuno T. The APRR1/TOC1 quintet implicated in circadian rhythms of: I. Characterization with APRR1- overexpressing plants. Plant Cell Physiology, 2002, 43(1): 58-69.
[15] Shim J S, Kubota A, Imaizumi T. Circadian clock and photoperiodic flowering in: CONSTANS is a hub for signal integration. Plant Physiology, 2017, 173(1): 5-15.
[16] Koo B H, Yoo S C, Park J W, Kwon C T, Lee B D, An G, Zhang Z, Li J, Li Z, Paek N C. Natural variation inregulates heading date and contributes to rice cultivation at a wide range of latitudes. Molecular Plant, 2013, 6(6): 1877-1888.
[17] SaloméP A, McClung C R. Theclock. Journal of Biological Rhythms, 2004, 19(5): 425-435.
[18] Más P. Circadian clock signaling in: from gene expression to physiology and development. The International Journal of Developmental Biology, 2005, 49(5/6): 491-500.
[19] Gardner M J, Hubbard K E, Hotta C T, Dodd A N, Webb A A. How plants tell the time. Biochemical Journal, 2006, 397(1): 15-24.
[20] Alabadí D, Oyama T, Yanovsky M J, Harmon F G, Más P, Kay S A. Reciprocal regulation betweenand/within thecircadian clock. Science, 2001, 293(5531): 880-883.
[21] Pruneda-Paz J L, Breton G, Para A, Kay S A. A functional genomics approach reveals CHE as a component of thecircadian clock. Science, 2009, 323(5920): 1481-1485.
[22] 陆平. 谷子种质资源描述规范和数据标准2-9. 北京: 中国农业出版社, 2006.
Lu P. Description Specification and Data Standard of Foxtail Millet Germplasm Resources 2-9. Beijing: China Agriculture Press, 2006. (in Chinese)
[23] Turner S D. qqman: an R package for visualizing GWAS results using Q-Q and manhattan plots. biorXiv, 2014, https://doi.org/10. 1101/005165.
[24] Yang A, Dai X Y, Zhang W H. A R2R3-type MYB gene,, is involved in salt, cold, and dehydration tolerance in rice. Journal of Experimental Botany, 2012, 63(7): 2541-2556.
[25] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods, 2001, 25(4): 402-408.
[26] Doyle J. DNA protocols for plants-CTAB total DNA isolation. Molecular Techniques in Taxonomy, 1991: 283-293.
[27] Librado P, Rozas J. DnaSP v5: a software for comprehensive analysis of DNA polymorphism data. Bioinformatics, 2009, 25(11): 1451-1452.
[28] 刁现民, 程汝宏. 十五年区试数据分析展示谷子糜子育种现状. 中国农业科学, 2017, 50(23): 4469-4474.
Diao X M, Cheng R H. Fifteen-year regional trial data analysis shows the current situation of millet and millet breeding. Scientia Agricultura Sinica, 2017, 50(23): 4469-4474. (in Chinese)
[29] Yano M, Katayose Y, Ashikari M, Yamanouchi U, Monna L, Fuse T, Baba T, Yamamoto K, Umehara Y, Nagamura Y, Sasaki T., a major photoperiod sensitivity quantitative trait locus in rice, is closely related to theflowering time gene. The Plant Cell, 2000, 12(12): 2473-2484.
[30] Hayama R, Yokoi S, Tamaki S, Yano M, Shimamoto K. Adaptation of photoperiodic control pathways produces short-day flowering in rice. Nature, 2003, 422(6933): 719-722.
[31] Xue W Y, Xing Y Z, Weng X Y, Zhao Y, Tang W J, Wang L, Zhou H J, Yu S B, Xu C G, Li X H, Zhang Q F. Natural variation inis an important regulator of heading date and yield potential in rice. Nature Genetics, 2008, 40(6): 761-767.
[32] Nemoto Y, Nonoue Y, Yano M, Izawa T. Hd1, a CONSTANS ortholog in rice, functions as an Ehd1 repressor through interaction with monocot-specific CCT-domain protein Ghd7. The Plant Journal, 2016, 86(3): 221-233.
[33] Du A, Tian W, Wei M H, Yan W, He H, Zhou D, Huang X, Li S G, Ouyang X H. The DTH8-Hd1 module mediates day-length- dependent regulation of rice flowering. Molecular Plant, 2017, 10(7): 948-961.
[34] Fujino K, Yamanouchi U, Nonoue Y, Obara M, Yano M. Switching genetic effects of the flowering time geneand
[35] Zhang Z Y, Zhang B, Qi F X, Wu H, Li Z X, Xing Y Z.function conversion in regulating heading is dependent on gene combinations of,, andunder long-day conditions in rice. Molecular Breeding, 2019, 39(92): 1-12.
Characterizations of Transcriptional and Haplotypic Variations of
ZHANG LinLin, ZHI Hui, TANG Sha, ZHANG RenLiang, ZHANG Wei, JIA GuanQing, DIAO XianMin
Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081
【】Identification of allelic variations of heading date adaptation related genes and laying foundation for breeding of wide-adapted varieties in foxtail millet.【】In this trial, a vital regulator of heading time in foxtail millet,, was identified using genome-wide association analysis. Spatio-temporal transcription (multi-omics database for,MDSi), sub-cellular localization and 24 hours rhythm expression pattern ofwas analyzed. Sequence variations of both promoter and encoding regions inand relationships between haplotypic variations and heading date were characterized in 99 foxtail millet accessions.【】A significant GWAS signal (Position: 31 456 761 bp) was detected on Chromosome 1 and only onehomologue was identified ().highly expressed in root, stem and leaf, and located into cell nucleus. An elevated expression ofwas identified at dusk across whole day transcription survey under short-day environment. Many haplotypic variations ofwere identified but REC and CCT domains of SiTOC1were conserved in foxtail millet accessions, and two main haplotypes including H-2 and H-6 in protein encoding regions combined with two co-segregated haplotypes including Hp-591C and Hp-591A were identified. Nearly 2.5 times higher expression of Hp-591C haplotype combined with 9,11 and 12 days delay of heading time through Hainan, Changzhi and Urumuqi were observed.【】The major haplotype Hp-591A identified at 591 bp in the promoter region ofmatures earlier than Hp-591C and could be selected as a main effective locus for molecular breeding of foxtail millet.
; heading time; genome-wide association study; haplotype; genetic variation; rhythmic expression

10.3864/j.issn.0578-1752.2021.11.003
2020-11-09;
2020-12-07
国家重点研发计划(2018YFD1000701/2018YFD1000700)、国家自然科学基金(31871630)、国家谷子高粱产业技术体系(CARS-06-13.5- A4)、中国农业科学院创新工程
张林林,E-mail:657044121@qq.com。通信作者贾冠清,E-mail:jiaguanqing@caas.cn。通信作者刁现民,E-mail:diaoxianmin@caas.cn
(责任编辑 李莉)

