有氧运动干预对抑郁症大鼠HPA轴激活状态的影响及其上游调控机制
刘威 晋倩 郝选明

摘 要:探讨有氧运动干预对抑郁症大鼠HPA轴激活状态的影响及其上游调控机制。以WKY抑郁大鼠作为动物模型,进行8周有氧运动干预,以下丘脑CRH分泌情况反映HPA轴激活状态,通过海马Glu和GABA以及下丘脑中这两种神经递质受体表达探讨HPA轴激活的上游调控机制。结果发现:(1)抑郁大鼠CRH显著升高,表明其HPA轴过度激活,其机理应该与海马Glu和下丘脑Glu受体高表达、海马GABA和下丘脑GABA受体低表达直接相关。(2)运动干预可以显著降低CRH的分泌从而改善HPA轴的过度激活状态,其机理在于运动干预可下调海马Glu和下丘脑Glu受体的表达,同时上调海马GABA和下丘脑GABA受体的表达。(3)运动干预可以取得与氟西汀干预相似的改善效应,表明有氧运动干预可以作为药物治疗抑郁症的良好替代手段。
关 键 词:运动生物化学;抑郁症大鼠;HPA轴;有氧运动干预
中图分类号:G804.7 文献标志码:A 文章编号:1006-7116(2021)02-0138-07
Abstract: This study aims to explore effect of aerobic exercise intervention on the activation degree of HPA axis in depressive rats and its upstream regulation mechanism. WKY depressive rats were used as animal models and to carry out 8-week aerobic exercise, and CRH secretion in hypothalamus were used to observe the activation degree of HPA axis, and through expression of Glu and GABA in hippocampus and their receptors in hypothalamus to observe upstream regulation mechanism activated by the HPA axis. The results suggested that: (1) CRH increased significantly in depressive rats, indicating that the HPA axis was over activated, and the mechanism should be directly related to the high expression of Glu in hippocampus and its receptor in hypothalamus, and the low expression of GABA in hippocampus and its receptor in hypothalamus. (2) Exercise intervention lowered HPA axis activation obviously so that the over activation degree of HPA axis could be improved, and the mechanism should be due to down-regulate the expression of Glu in hippocampus and its receptor in hypothalamus, and up-regulate GABA in hippocampus and its receptor in hypothalamus by exercise. (3) Exercise intervention could achieve improvement effect similar to fluoxetine intervention, which shows that aerobic exercise would be an advisable alternative means to replace the treatment of depression by drugs.
Key words: sports biochemistry;depressive rats;aerobic HPA axis;exercise intervention
抑郁症是一种以情绪低落、悲观厌世等为特点的常见的情感障碍性精神疾病,发病率高(7.8%~17.1%)、致残率高(47%)、治疗率低(不足10%)[1]。据世界卫生组织(WHO)2017年《抑郁症及其他常见精神障碍》报告,世界范围内有超过3亿人饱受抑郁症的困扰。我国的情况更不容乐观,超过9 500万中国人一生当中得过抑郁症[2]。鉴于此,探索防治抑郁症的有效手段及其机制,不仅是一个重大的科学问题,更有着突出的实践意义。
抑郁症的发病机制非常复杂。近年来神经内分泌假说得到了越来越多的支持[3]。该学说认为在抑郁症发病进程中,HPA轴(Hypothalamus -Pituitary-Adrenal Axis,下丘脑-垂体-肾上腺轴)的过度激活是抑郁症发生发展的病理基础,下丘脑过度分泌CRH(促肾上腺皮质激素释放激素)是抑郁症成病的关键。研究表明,持续的抑郁性刺激会激活HPA轴,并通过GC(糖皮质激素)反馈性地使海马受损,使患者出现各种抑郁表现,并促进抑郁症的病情恶化[4]。因此HPA轴功能亢進被公认为是情感障碍的神经生物学发病机理中“最后共同通路”,HPA轴功能状态正常化对抑郁症状的缓解显得至关重要[5]。
临床治疗抑郁症多采用氟西汀等抗抑郁药物,但其起效慢、副作用多、容易产生耐药性且复发率高。前人有关运动对抗抑郁方面的报道多集中于运动能够改善抑郁模型大鼠的行为学异常状态[6],但对影响抑郁症的调节机制研究不足。适度的运动已被证明可以影响多种神经递质系统,如5-羟色胺(5-HT)、多巴胺(DA)、去甲肾上腺素(NE)等激素的释放[7]。也有研究表明长期参加有氧运动可降低下丘脑室旁核内Glu能神经纤维密度,增加GABA能神经纤维密度,从而改变PVN内交感兴奋性神经元的“兴奋-抑制”平衡[8]。
鉴于此,本研究以WKY抑郁大鼠作为动物模型,进行8周有氧运动干预,通过下丘脑CRH分泌的变化,观察运动干预对HPA轴激活状态的影响,并从海马神经递质Glu和GABA以及下丘脑中这两种神经递质受体表达的变化,探讨运动干预影响HPA轴激活状态的上游调控机制。此外应用氟西汀单独干预以及与运动结合的联合干预,比较不同干预手段之间的效果差异及相互影响。
1 实验材料与方法
1.1 实验动物模型与分组
本实验研究抑郁症动物模型采用WKY(Wistar Kyoto)大鼠。WKY大鼠具有抑郁化的生理学行为特征,是一种公认的非诱导抑郁动物模型。抑郁状态稳定且对药物反应良好,是理想的内源性抑郁症模型[9]。
8周龄SPF级雄性WKY大鼠40只,Wistar大鼠10只,均购于北京维通利华实验动物技术有限公司,动物合格证编号:SCXK(京)2012-0001。所用饲料为国家标准颗粒型固体大鼠饲料,合格证号:0009161,购于广东中医药大学动物实验中心。动物饲养环境在华南师范大学体育科学学院动物房,温度(22±2)℃,湿度40%~50%。动物分笼饲养,每笼4~5只,自由饮水、饮食,12 h昼夜循环。饮用水采用双蒸水。为保持饲养环境垫料隔2天更换1次,并定期进行紫外灯消毒。
实验大鼠适应性喂养一周后分为5组:正常对照组(C,n=10只)、抑郁对照组(DC,n=10只)、运动干预组(DE,n=10只)、氟西汀干预组(DF,n=10只)、运动联合氟西汀干预组(DEF,n=10只)。
1.2 运动方案
运动干预组和运动联合氟西汀干预组采用跑台运动,跑台坡度均为0°。适应性训练1周后正式进行有氧运动干预,跑速15 m/min,30 min/d、3 d/周(周一、三、五),共持续8周。
1.3 氟西汀灌胃
氟西汀干预组、运动联合氟西汀干预组适应性喂养1周后,每日早晨给予氟西汀灌胃,灌胃量为1.8 mg/kg/d,1次/d,连续8周。其余组大鼠按体质量灌以相应体积的生理盐水。
1.4 取材
第8周最后一次运动后24 h,各组取材。具体过程:腹腔注射体积分数10%水合氯醛(0.35~0.40) mL/kg进行麻醉,打开胸腔,将灌注针头经左心室插至升主动脉,剪开右心耳,进行灌注,待大鼠全身僵直后无菌断头,剥离完整大脑,分离出海马及下丘脑,一侧海马用锡纸包裹,做好标记,迅速置于液氮中,随后转入-80℃超低温冰箱保存待测。另一侧海马及下丘脑放入固定液中保存待测。
1.5 主要实验试剂与设备
兔抗CRH、NR1、NR2B、GABAAα2多克隆抗体(Thermo);即用型免疫组化试剂盒(福州迈新生物技术有限公司);Glu、GABA Elisa试剂盒(江苏酶免生物科技);酶标仪及洗板机(Bio-Rad);荧光显微镜(Olympus);切片机、组织脱水机、包埋机(德国Leica);超纯水机(美国ELGA);动物跑台(广州飞迪生物科技有限公司)。
1.6 测试指标与方法
1)海马组织Glu与GABA测定。
采用酶联免疫吸附法(ELISA)进行测定。海马组织冰上解冻,冰上研磨制成匀浆,3 000 r离心20 min,取上清液保存待测。50 μL不同浓度标准品滴入相应孔中。待测样本50 μL滴入样本孔中。标准品孔和样本孔中滴入辣根过氧化物酶(HRP)标记的被检测抗体100 μL,封板膜密封温育60 min(37°C),洗板5次。底物A、B各50 μL滴入每个孔,避光(37°C)孵育15 min。每孔加入终止液各50 μL,用酶标仪在450 nm波长下测定光密度值D(λ),通过标准曲线计算样品中所含Glu的质量浓度和GABA的浓度。
2)下丘脑室旁核(pvn)Glu受体(NR1、NR2B亚基)、GABA受体(GABAAα2亚基)以及CRH测定。
采用SP法进行下丘脑免疫组化染色,DAB显色。常规脱水、透明、封固。40×10光镜视野下,每个切片选取3~5个视野,采用ImagePro plus软件进行阳性面积定量分析,得出IOD(积分光密度)和Area(阳性面积),由Density=IOD/Area计算平均光密度(OD·μm-2)。
1.7 数据分析及处理
本实验的数据均采用SPSS21.0统计软件进行处理,采用平均数±标准差()表示,组间比较采用单因素方差分析,两组间比较采用成对样本T检验,以P<0.05作为差异显著性水平。
2 实验结果与分析
2.1 各组大鼠海马Glu、GABA的表达
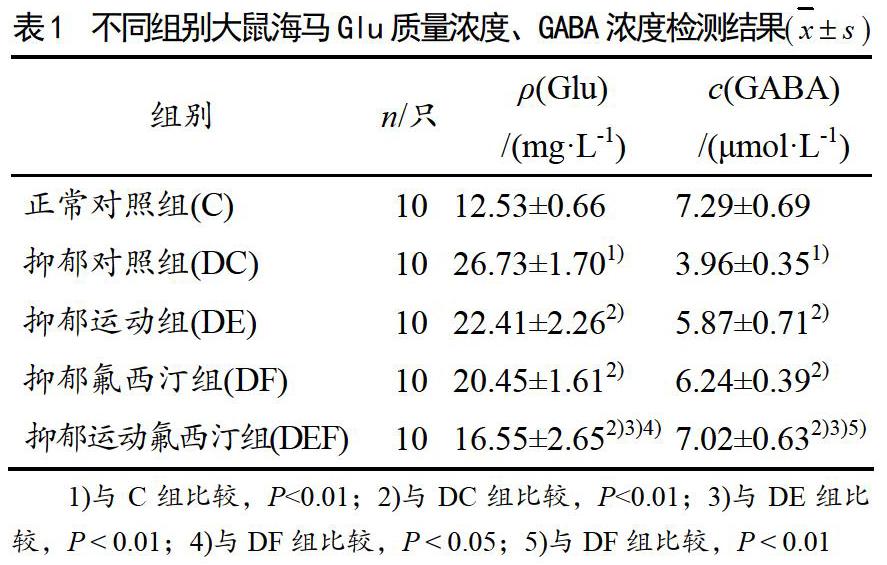
各组大鼠海马中Glu和GABA的表达情况参见表1。
与正常对照组相比,抑郁组对照组Glu水平提升非常显著(P<0.01),而GABA则出现非常显著降低 (P<0.01),提示抑郁大鼠海马兴奋性氨基酸遞质Glu表达显著升高,而抑制性氨基酸递质GABA的表达则明显受到抑制,兴奋性氨基酸递质与抑制性氨基酸递质处于明显的失衡状态。
与抑郁对照组相比,运动干预组海马中Glu的表达非常显著降低(P<0.01);而海马中GABA的表达则非常显著性升高(P<0.01),提示有氧运动干预在显著降低海马Glu表达的同时明显地提升海马GABA表达水平,以此改善海马神经递质表达的平衡状态。
氟西汀干预组的干预效果与运动干预组相类似,其Glu表达相对抑郁组出现非常显著降低(P<0.01),而GABA表达则提升显著(P<0.01),提示氟西汀干预也能够显著下调海马Glu的表达并显著上调GABA的表达。
运动联合氟西汀干预组的干预效果最为显著,与单一干预手段相比,其海马Glu表达呈现显著性下降(P<0.05),而海马GABA的表达则出现显著性升高(P<0.01),提示联合干预效果优于运动干预或药物干预单一干预手段,更有助于改善海馬神经递质表达的平衡状态。
2.2 各组大鼠下丘脑室旁核Glu受体(NR1亚基,NR2B亚基)的表达
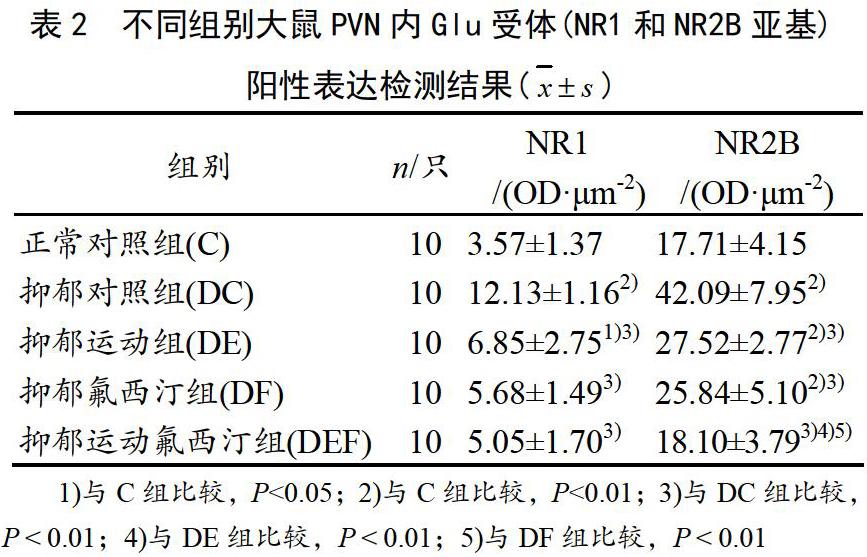
各组大鼠下丘脑PVN内NR1和NR2B两种受体表达情况见表2。
与正常对照组相比,抑郁对照组两种受体表达均非常显著性升高(P<0.01),提示抑郁对照组大鼠下丘脑PVN内Glu的两种受体亚型的表达均非常显著性升高。
与抑郁对照组相比,运动干预组下丘脑PVN内两降种Glu受体亚型NR1和NR2B呈现非常显著性降低(P<0.01),提示有氧运动干预能够显著下调兴奋性神经递质Glu受体的过度表达。
氟西汀干预组两种Glu受体亚型变化趋势与运动组类似,提示氟西汀也能够有效下调Glu受体的过度激活。
运动联合氟西汀干预组下调两种Glu受体亚型NR1和NR2B效果最佳,甚至可将因抑郁升高的受体表达水平下调至基本接近对照组水平,差异没有统计学意义(P>0.05),提示运动联合氟西汀干预其效果优于单一干预手段,具有一定的叠加效应。
2.3 各组大鼠下丘脑室旁核GABA受体(GABAAα2)的表达
各组大鼠在下丘脑PVN内GABA受体GABAAα2的表达情况见表3。
与正常对照组相比,抑郁对照组抑制性氨基酸GABA受体GABAAα2的表达呈现非常显著性降低(P<0.01),提示抑郁对照组大鼠下丘脑PVN内GABA受体的表达受到明显抑制。
与抑郁对照组相比,运动干预组下丘脑PVN内GABA受体亚型GABAAα2呈现非常显著性升高(P<0.01),提示有氧运动干预能够显著上调抑制性神经递质GABA受体的表达。
氟西汀干预组GABA受体亚型变化趋势与运动组类似,GABAAα2相对于抑郁对照组出现非常显著升高(P<0.01),提示氟西汀也能够有效上调GABA受体的表达。
运动联合氟西汀干预组上调GABA受体亚型GABAAα2的效果最佳,其值与正常对照组相比未出现显著性差异(P>0.05),提示运动联合氟西汀干预效果优于单一干预手段,具有一定的叠加效应。
2.4 各组大鼠下丘脑室旁核(PVN)CRH的表达
各组大鼠下丘脑PVN内CRH的表达情况见表4。
与正常对照组相比,抑郁对照组大鼠下丘脑PVN内CRH表达出现非常显著性升高(P<0.01),提示抑郁大鼠HPA轴被强烈激活。
与抑郁对照组相比,运动干预组CRH表达水平出现非常显著性下降(P<0.01),提示运动干预可明显抑制抑郁大鼠HPA轴的过度激活。
氟西汀干预组CRH表达变化趋势与运动干预组类似,CRH表达水平与抑郁对照组之间差异具有非常显著统计学意义(P<0.01),提示氟西汀干预可明显抑制HPA轴的激活程度。
运动联合氟西汀干预组对CRH表达水平的下调作用优于单一干预手段,并具有一定的叠加效应。
3 讨论
3.1 抑郁大鼠HPA轴的功能状态及其调控机理
HPA轴(下丘脑-垂体-肾上腺轴)持续性的过度激活是抑郁症形成和发展的重要病因学基础。HPA轴是机体重要的神经内分泌免疫调控通路,是神经内分泌免疫网络的枢纽[10]。HPA轴最上位的下丘脑充当着神经系统和内分泌系统的“联络员”,即神经-体液调节的“连接器”,当机体感受到体内外各种刺激时,会通过向下丘脑释放神经递质,并与相应受体结合后,促使下丘脑释放CRH,从而激活HPA轴[11]。下丘脑所释放的CRH,会在HPA轴产生瀑布式的级联放大效应,形成一个效能极高的生物放大系统。0.1 μg CRH可以使腺垂体释放1 μg ACTH (促肾上腺皮质激素),后者再进一步引起肾上腺皮质分泌40 μg GC[12]。
本实验研究发现,与正常对照组相比,抑郁对照组大鼠下丘脑PVN内CRH表达出现非常显著性升高,其值高达正常值的2.87倍(参见图1a),表明抑郁大鼠HPA轴处于高度激活状态。
CRH的分泌活动(HPA轴的激活程度)受控于海马兴奋性氨基酸递质Glu(以及在下丘脑PVN内相应受体的表达)和抑制性氨基酸递质GABA(以及在下丘脑PVN内相应受体的表达)的综合作用,前者促进CRH的分泌从而激活HPA轴,后者则对HPA轴的激活起着抑制作用[13]。
神经递质通过与各自的特异性受体结合来对细胞的行为及生理活动进行调节。Glu是哺乳动物脑内最重要且含量最高的兴奋性神经递质,对中枢神经系统中几乎所有的神经元都有兴奋作用。Glu的受体分为离子型受体(iGluR)和代谢型受体(mGluR),其中离子型受体中的NMDA受体多存在于海马和皮质中,并与应激导致的兴奋性神经毒性、突触可塑性、神经退行性变等功能密切相关[14]。NR1和NR2B作为NMDA受体中的功能亚基和调节亚基,对于保持受体功能的完整性具有不可或缺的作用[15]。而GABA则是哺乳类动物中枢神经系统最重要的抑制性神经递质,几乎对所有的神经元都有抑制作用。GABAAα2则作为GABA受体亚单位逐渐成为研究情感障碍疾病的焦点因子[16]。
本实验研究发现,与正常对照组大鼠相比,抑郁大鼠海马兴奋性氨基酸递质Glu水平升高达2.13倍,同时,下丘脑PVN内Glu受体亚型NR1和NR2B表达也分别提升了3.39倍和2.38倍(参见图1b)。海马Glu的高表达以及下丘脑相应受体的高表达势必会显著加强对下丘脑CRH阳性神经元的刺激,促使CRH表达显著增多,HPA轴被过度激活。本实验研究还发现,作为与兴奋性氨基酸Glu起拮抗作用的抑制性氨基酸递质,GABA在抑郁大鼠海马的表达只占到正常对照组大鼠的54.3%,同时,下丘脑PVN内GABA受体GABAAα2的表达只占到正常对照组大鼠的62.3%(参见图1c),海马GABA的低表达以及下丘脑相应受体的低表达势必会显著减弱对CRH分泌的抑制作用,使HPA轴更易于被过度激活。
综上所述,抑郁会造成海马兴奋性、抑制性氨基酸神经递质及其受体表达失衡,促使CRH分泌增多,过度激活HPA轴;通过应激轴的级联放大效应会导致肾上腺皮质分泌更多的GC。这些GC通过血液循环,与海马神经元富含的GR(糖皮质激素受体)结合,导致海马神经元出现萎缩、凋亡及神经再生障碍等一系列的可塑性损伤,使抑郁现象进行性加重。海马神经元受损,并进一步上调兴奋性氨基酸递质Glu在海马的表达(以及下丘脑Glu受体的表达),同时下调抑制性氨基酸递质GABA的表达(以及下丘脑GABA受体的表达),促使下丘脑释放更多的CRH,由此造成HPA轴被进一步激活,从而形成一个恶性循环,促使抑郁症发生和发展。
3.2 运动干预对抑郁大鼠HPA轴功能状态的影响及调控机制
HPA轴持续性过度激活是抑郁症神经内分泌的主要变化之一。本实验研究发现,有氧运动干预可以显著降低CRH的分泌,从而有效纠正HPA轴的过度激活状态。从图2a可见,与正常对照组大鼠相比,抑郁大鼠下丘脑CRH表达水平显著升高,表明抑郁大鼠HPA轴处于明显的过度激活状态,而运动大鼠下丘脑CRH的表达水平较之抑郁大鼠呈现非常显著性降低,降低幅度高达49.5%,表明长期有氧运动可以非常有效地改善抑郁症所形成的HPA轴过度激活状态。
如前所述,抑郁大鼠CRH分泌增多,HPA轴过度激活的主要原因在于兴奋性氨基酸递质及其受体的高表达、抑制性氨基酸递质及其受体的低表达共同作用的结果。本实验研究表明,运动干预对HPA轴的影响也是通过这一机制。与抑郁组大鼠相比,运动干预组大鼠海马Glu水平降幅达16.1%,下丘脑内Glu受体亚型NR1和NR2B表达分别降至抑郁组的56.4%和65.4%(参见图2b)。可见运动干预会通过下调海马Glu的表达,尤其是通过显著下调下丘脑相应受体NR1和NR2B的表达,会显著减弱对下丘脑CRH阳性神经元的兴奋作用。而在功能上与兴奋性氨基酸相对抗的抑制性氨基酸递质,则出现明显的上调现象。由图2c可见,与抑郁大鼠GABA的低表达比较,运动组大鼠的表达水平则明显增高,升幅高达48.2%。同时,下丘脑内GABA的受体GABAAα2表达也升高了28.6%。可见运动干预主要通过显著上调海马GABA的表达,其次上调下丘脑GABA受体GABAAα2的表达来显著加强对下丘脑CRH阳性神经元的抑制作用。
综上所述,运动干预主要通过兴奋性氨基酸和抑制性氨基酸的相互作用来调控CRH的分泌和HPA轴的激活状态。一方面,通过下调兴奋性氨基酸递质及其受体表达水平减弱对下丘脑CRH阳性神经元的兴奋作用;另一方面,通过上调抑制性氨基酸递质及其受体表达水平加强对下丘脑CRH的抑制作用。两者共同作用的结果,下丘脑CRH表达水平显著降低,HPA轴过度激活状态显著改善,GC分泌减少,GC减少后与海马神经元GR结合量降低;一方面改善抑郁症造成的海马神经元萎缩、凋亡及神经再生障碍等,使抑郁现象减轻,另一方面则会进一步下调兴奋性氨基酸递质Glu在海马的表达(以及下丘脑Glu受体的表达),同时上调抑制性氨基酸递质GABA的表达(以及下丘脑GABA受体的表达);两者共同作用的结果使下丘脑释放的CRH进一步减少,HPA轴过度激活状态进一步改善,从而形成良性循环,促使抑郁症状不断改善。
3.3 氟西汀干预与联合干预对抑郁大鼠HPA轴功能状态的影响及调控机制
目前抑郁症的主要治疗方法是药物治疗,氟西汀是常用药物[17]。本实验研究在观察运动干预对抑郁大鼠HPA轴功能状态影响的同时,还观察了氟西汀对HPA轴的影响。由图3a可见,与抑郁对照组大鼠相比,氟西汀组大鼠下丘脑CRH水平显著降低,降低幅度高达53.5%,甚至稍优于运动组干预效果,表明氟西汀干预也可以有效地改善抑郁症所形成的HPA轴持续性过度激活状态。
本实验研究发现,氟西汀干预组大鼠较之抑郁对照组大鼠,兴奋性氨基酸递质Glu在海马的表达降低了23.5%,下丘脑Glu受体NR1和NR2的表达水平也出现明显降低,降幅分别达到53.2%和38.6%(見图3b),表明氟西汀可以显著下调兴奋性氨基酸及其受体的高表达。与抑郁大鼠相比,海马抑制性氨基酸递质GABA表达极显著升高,升幅高达57.6%,下丘脑中相应受体GABAAα2也提升了36.1%(见图3c),表明氟西汀可以有效上调抑制性氨基酸的表达。两种对抗性神经递质及其受体表达变化综合作用的结果,会明显抑制CRH阳性神经元的兴奋程度,减少CRH的分泌,从而改善抑郁大鼠HPA轴的过度激活状态。
比较运动干预和药物干预实验结果可以看出,药物干预对HPA轴过度激活的改善效果及其机理与运动干预相类似,那么氟西汀干预是否可以替代运动干预?分析认为,药物虽可控制抑郁病情,但并未从根本上改变抑郁症发病机制,因此长期服药效果会越来越差,且一旦停药后,对HPA轴的抑制效应就会解除,HPA轴又会重新陷入CRH升高—HPA轴过度激活—GC升高—同海马GR过度结合—海马萎缩—神经可塑性降低—抑郁病情加重—CRH升高……这样恶性循环,导致抑郁症复发甚至恶化。而长期的有氧运动干预则不同,它可从根本上改善海马和下丘脑的形态、结构和功能,从内在机制上改善HPA轴的过度激活状态,进入良性循环,以延缓抑郁症的发生和发展。因此,从调控HPA轴过度激活、改善抑郁症状这个意义上而言,药物不能代替运动,相反,长期有氧运动干预可以作为药物治疗抑郁症的良好替代手段。
本实验研究还设置了联合干预组,即氟西汀干预+运动干预,以观察运动结合药物干预对HPA轴激活状态的影响,结果见图4。
由图4可见,与抑郁对照组大鼠相比,联合干预组大鼠CRH下降59.3%(见图4a),Glu以及受体NR1、NR2表达分别下降38.1%、58.4%和57%(见图4b);而GABA和受体GABAAα2的表达则分别提升77.3%和54.5%(见图4c)。实验发现,与运动或药物单一干预手段相比,联合干预时CRH、Glu、NR1、NR2的降幅更大,而GABA和GABAAα2的升幅也更明显。可见,从改善HPA轴过度激活的角度而言,运动和药物联合干预时,两种干预手段之间没有出现拮抗效应,反而具有一定程度的叠加效应。
4 结论
1)抑郁大鼠CRH表达水平显著升高,表明HPA轴处于过度激活状态。其机理在于抑郁会造成海马兴奋性、抑制性氨基酸神经递质及其受体表达失衡,即海马兴奋性氨基酸递质Glu以及相应受体NR1、NR2在下丘脑的高表达,会加强CRH阳性神经元的兴奋作用,而海马抑制性氨基酸GABA以及相应受体GABAAα2在下丘脑的低表达,则减弱对CRH分泌的抑制作用。
2)运动大鼠CRH表达水平显著降低,表明HPA轴过度激活状态得到明显改善。其机理在于运动干预一方面通过下调兴奋性氨基酸递质及其受体表达水平减弱对下丘脑CRH阳性神经元的兴奋作用;另一方面则上调抑制性氨基酸递质及其受体表达水平加强对下丘脑CRH的抑制作用。
3)氟西汀干预可对HPA轴产生与运动干预相似的改善效应,表明有氧运动干预可以作为药物治疗抑郁症的良好替代手段。运动联合药物干预未出现相互拮抗现象,甚至具有一定叠加效应,提示两者可以并用。
参考文献:
[1] NARROW W E,RAE D S. Revised prevalence estimates of mental disorders in the United States: using a clinical significance criterion to reconcile 2 surveys' estimates[J]. Arch Gen Psychiatry,2002,59(2):115-123.
[2] HUANG Y,WANG Y,WANG H,et al. Prevalence of mental disorders in China:A cross-sectional epidemiological study[J]. Lancet Psychiatry,2019,6(3):211-224.
[3] MAKRIS AP,KARIANAKI M,TSAMIS K I,et al. The role of the gut-brain axis in depression:endocrine,neural,and immune pathways[J]. Hormones (Athens),2020,10.1007/s42000-020-00236-4.
[4] WILEY J W,HIGGINS G A,ATHEY B D. Stress and glucocorticoid receptor transcriptional programming in time and space: Implications for the brain-gut axis[J]. Neurogastroenterol Motil,2016,28(1):12-25.
[5] COWEN P J. Not fade away: the HPA axis and depression[J]. Psychol Med,2010,40(1):1-4.
[6] 魏宏文,矯玮,张有志,等. 运动对慢性应激抑郁模型大鼠行为学及体重的影响[J]. 体育学刊,2010,17(11):100-105.
[7] ZEMBERI N,ISMAIL M M,ABDULLAH M. Exercise interventions as the primary treatment for depression: Evidence from a narrative review[J]. Malays J Med Sci,2020,27(5):5-23.
[8] 王松涛,曾云贵,王安利. 有氧运动对大鼠心血管自主神经中枢Glu能神经和GABA能神经的影响[J]. 体育科学,2007,27(4):64-71.
[9] SOLBERG L C,AHMADIYEH N,BAUM A E,et al. Depressive-like behavior and stress reactivity are independent traits in a Wistar Kyoto x Fisher 344 cross[J]. Mol Psychiatry,2003,8(4):423-33.
[10] FUTCH H S,MCFARLAND K N,MOORE B D,et al. An anti-CRF antibody suppresses the HPA axis and reverses stress-induced phenotypes[J]. J Exp Med,2019,216(11):2479-2491.
[11] KLAMPFL S M,BRUNTON P J,BAYERL D S,et al. CRF-R1 activation in the anterior-dorsal BNST induces maternal neglect in lactating rats via an HPA axis-independent central mechanism[J]. Psychoneuro Endocrinology,2016,64:89-98.
[12] CASSARINO M F. Proopiomelanocortin,glucocorticoid,and CRH receptor expression in human ACTH-secreting pituitary adenomas[J]. Endocrine,2017,55(3):853-860.
[13] MAGUIRE J. Stress-induced plasticity of GABAergic inhibition[J]. Front Cell Neuro Sci, 2014(8):157.
[14] LIU Y,ZHANG J. Recent development in NMDA receptors[J]. Chin Med J,2000,113(10):948-956.
[15] BORZA I,BOIO E,BARAT-SIALAI B,et al. Selective NR1/2B N-methyl-D-aspartate receptor antagonists among indole-2-carboxamides and benzimidazole-2- carboxamides[J]. J Med Chem,2007,50(5):901-914.
[16] VOLLENWEIDER I,SMITH K S,KEIST R. Antidepressant- like properties of alpha2-containing GABA(A) receptors[J]. Behav Brain Res,2011,217(1):77-80.
[17] PANWAR R,SIVAKUMAR M. Changes in the levels of comet parameters before and after fluoxetine therapy in major depression patients[J]. Anatomy Cell Biology,2020,53(2):194-200.

