甘蔗渣对灵芝菌丝生长的影响及菌种保藏评价
张柳莲 黄清铧 王丽宁 王庆福 梁磊 林明威
摘 要:为了筛选出最适合灵芝菌种复壮的培养基和灵芝菌种的保藏方法,通过添加不同含量的甘蔗渣提取液作为灵芝菌株复壮的培养基,观察灵芝菌丝在不同培养基下的生长速度和生长状况,并通过对灵芝菌种酶活力进行测定分析,比较几种不同保藏方法对灵芝菌种活力的影响。结果表明:马铃薯葡萄糖培养基(PDA)培养基添加甘蔗渣提取液能更好促进灵芝菌丝生长,添加100 g/L甘蔗渣提取液,赤灵芝GL102、紫灵芝GS63和GS15菌丝生长速率分别提高48%、70%和28%。与PDA保藏和石蜡油保藏培养基相比,甘蔗渣保藏的灵芝菌丝生长快、长势好,脱氢酶活力高。因此,甘蔗渣可用于灵芝菌种的复壮和保藏。
关键词:甘蔗渣;灵芝菌种;菌丝生长;培养基;脱氢酶活性
中图分类号:Q939.99 文献标识码:A
Effect of Bagasse on Growth of Ganoderma Mycelium and Evaluation of Strain Preservation
ZHANG Liulian1, HUANG Qinghua1, WANG Lining1, WANG Qingfu1*, LIANG Lei2, LIN Mingwei2
1. Institute of Bioengineering, Guangdong Academy of Sciences / Guangdong Provincial Engineering Laboratory of Biomass High Value Utilization, Guangzhou, Guangdong 510316, China; 2. Heyuan Provincial Academy of Sciences, Heyuan, Guangdong 517000, China
Abstract: In order to select the most suitable culture medium for the rejuvenation and preservation method of Ganoderma strains, by adding different contents of bagasse extract as the medium for the rejuvenation and observed hypha growth rate under different culture medium and growth conditions, and through the comparison of several different preservation methods on the vigor and the analysis of the enzyme activity. The results showed that the mycelium growth was better promoted by adding extraction solution of bagasse into PDA medium, and the mycelium growth rate of Ganoderma lucidum GL102, Ganoderma sinensis GS63 and GS15 increased by 48%, 70% and 28% respectively with the addition of 100 g/L bagasse extract. Compared with PDA preservation and paraffin oil preservation medium, bagasse preservation of Ganoderma mycelia grew fast, grew well and had high dehydrogenase activity. It was concluded that bagasse can be used for the rejuvenation and preservation of Ganoderma strains.
Keywords: bagasse; ganoderma strains; mycelium growth; medium; dehydrogenase activity
DOI: 10.3969/j.issn.1000-2561.2021.04.019
靈芝属多孔菌科,灵芝属,是我国最著名的药食两用真菌,具有抗肿瘤[1]、保肝护肝[2]、增强人体免疫力[3]、调节血糖血压等多方面功效[4-5]。近年来,随着灵芝栽培行业的迅速发展,作为生产源头的菌种成为直接关系到产品产量和质量的关键因素。菌种保藏方法与效果作为种质资源研究的重要方面,是菌种质量的前提和保证[6-8]。建立经济有效的菌种保藏方法,不仅可以有效保存菌种的优良性状、保持其活力与产量,而且对于种质资源的保存与后续研究都有极其重要的作用。
甘蔗渣是制糖工业的重要副产品,约占榨蔗量的24%~27%。甘蔗渣含有丰富的纤维素、半纤维素、木质素和一定量的氮素[9],可为多数食用菌提供生长代谢所需营养物质,目前有关甘蔗渣在食用菌栽培方面的相关研究集中在栽培方面[10-11],鲜见甘蔗渣在食用菌菌种保藏方面的相关报道。笔者研究甘蔗渣提取物对灵芝菌丝生长的影响及其在灵芝保藏中的应用,筛选出最适合灵芝菌种复壮的培养基和最适合灵芝菌种的保藏方法,为灵芝的种植提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 赤灵芝(GL102、GL57)、紫灵芝(GS63、GS15)菌株由广东省生物工程研究所(广州甘蔗糖业研究所)提供。4 ℃冰箱保藏1 a,期间未进行转管。
1.1.2 实验材料 马铃薯葡萄糖琼脂培养基由青岛高科园海博生物技术有限公司提供,甘蔗渣由广东省生物工程研究所(广州甘蔗糖业研究所)提供。红四氮唑和二甲基亚砜等试剂均由上海阿拉丁生化科技股份有限公司提供。
1.2 方法
1.2.1 培养基配方 在马铃薯葡萄糖培养基(PDA)的基础上加入不同含量的甘蔗渣提取液,分别配制含有0、20、40、60、80、100 g/L浓度的甘蔗渣提取液PDA培养基。
1.2.2 培养基配制方法 称取300 g甘蔗渣,清水室温浸泡2 h,煮沸30 min,过滤,滤渣重复煮2次,合并滤液,制得甘蔗渣提取液。向甘蔗渣提取液中加入适量(46 g/L)马铃薯葡萄糖琼脂(PDA),分别配制成含有0、20、40、60、80、100 g/L浓度的甘蔗渣提取液培养基。小火加热,不断用玻璃棒搅拌,防止糊底,直至马铃薯葡萄糖琼脂全部融化。分装在带塞的三角瓶内,于115 ℃高压蒸汽灭菌30 min,出锅备用。
1.2.3 灵芝菌种的活化与复壮 将保存1 a的灵芝母种试管从冰箱取出置于室温下放置24 h,将母种切割成0.4 cm×0.4 cm大小的有菌丝的琼脂块接入PDA平板培养3~5 d,用打孔器(内径0.6 mm)打孔,分别接入不同配方含量的培养基平板,每种培养基5个重复。于25 ℃培养,菌丝萌发后每2 d记录菌丝的生长速率、菌丝长势及菌落圆整度,待其中任一皿出现菌丝长满培养皿时停止数据的采集。筛选最适合的复壮培养基。
1.2.4 PDA斜面保藏法 称取46 g马铃薯葡萄糖琼脂粉置于烧杯中,加适量水,加热溶解后,加水定容至1 L。分装,121 ℃灭菌20 min,灭菌后摆斜面。将灵芝斜面母种转接至PDA平板中,置于培养箱中25 ℃培养,待菌丝长满平板。将此菌丝的一部分作为原始种使用,不经保藏,直接参与指标检测;另一部分作为各种保藏方法的初始菌种使用。
用直径5 mm打孔器在长有初始菌种的平板上打孔,挑取菌块接种于试管斜面上,于25 ℃的培养箱中培养。培养7 d后,观察菌落的生长形态及其他特征,检查是否染杂菌。将长好的斜面试管置于4 ℃冰箱内保藏,平行保藏5支试管斜面,3个月后进行指标检测。
1.2.5 石蜡油保藏法 将长好的斜面试管灌入无菌石蜡油,石蜡油液面高于斜面1 cm,置于常温保藏,平行保藏5支试管斜面,3个月后进行指标检测。
1.2.6 甘蔗渣保藏法 用2~3目的筛子对甘蔗渣进行过筛处理,去掉颗粒较小的木屑和碎皮。甘蔗渣预湿,添加砂糖1%,石灰粉1%,含水量65%~70%,分装试管,121 ℃灭菌1 h。待保藏培养基温度降至室温时,从供试菌种平板中挑取菌块接种于培养基表面,25 ℃恒温培养箱培养10~20 d。待菌丝长满试管后,将其放在4 ℃冰箱中保藏,平行保藏5支试管斜面,保藏3个月后进行指标检测。
1.2.7 菌种保藏效果与菌种活力检测 菌丝生长情况:将3种不同保藏方法下的灵芝菌种分别接入纯PDA培养基平板,每种5个重复。于25 ℃培养,观察菌丝萌发时间,记录菌丝的生长速率、菌丝长势及菌落圆整度,待其中任一皿出现菌丝长满培养皿时停止数据的采集。
菌丝生长速度:采用十字交叉法测量菌落平均直径(打孔器内径6 mm),菌丝生长速率(mm/d)=(平均菌落直径–0.6)/(菌丝生长天数×2)。
菌丝长势:观察并记录,用“+”表示菌絲体生长密度程度,+稀疏,++较稀疏,+++较浓密,++++浓密,+++++非常浓密。
菌落形态:菌落半径达培养皿一半时进行观察并记录,用“+”表示其程度,-菌丝不生长,+边缘不整齐、菌落不规则,++边缘较整齐、菌落较圆整,+++边缘整齐、菌落圆整。
灵芝菌种酶活力测定:从培养7 d的平板中刮取菌丝体适量,称取0.1 g菌丝体装入10 mL离心管中,依次加入蒸馏水2 mL和TTC溶液(0.5%红四氮唑)0.4 mL至离心管中,于37 ℃反应3 h。反应完成后4 ℃离心再水洗2次,在离心后的细胞沉淀中加入2 mL二甲基亚砜(DMSO)萃取剂,室温下从细胞中提取三苯基甲臜(TF)。10 000 r/min,离心5 min后,取上清500 μL于485 nm,测定OD值,每个处理设3个重复。以光吸收值反映脱氢酶活性,光吸收值越大,脱氢酶的活性越高。
1.3 数据处理
采用SPSS 22.0软件对实验数据进行单因素方差分析(One-way ANOVA),使用LSD、S-N-K检验方法和T检验法进行显著水平分析。
2 结果与分析
2.1 甘蔗渣对赤灵芝菌丝生长的影响
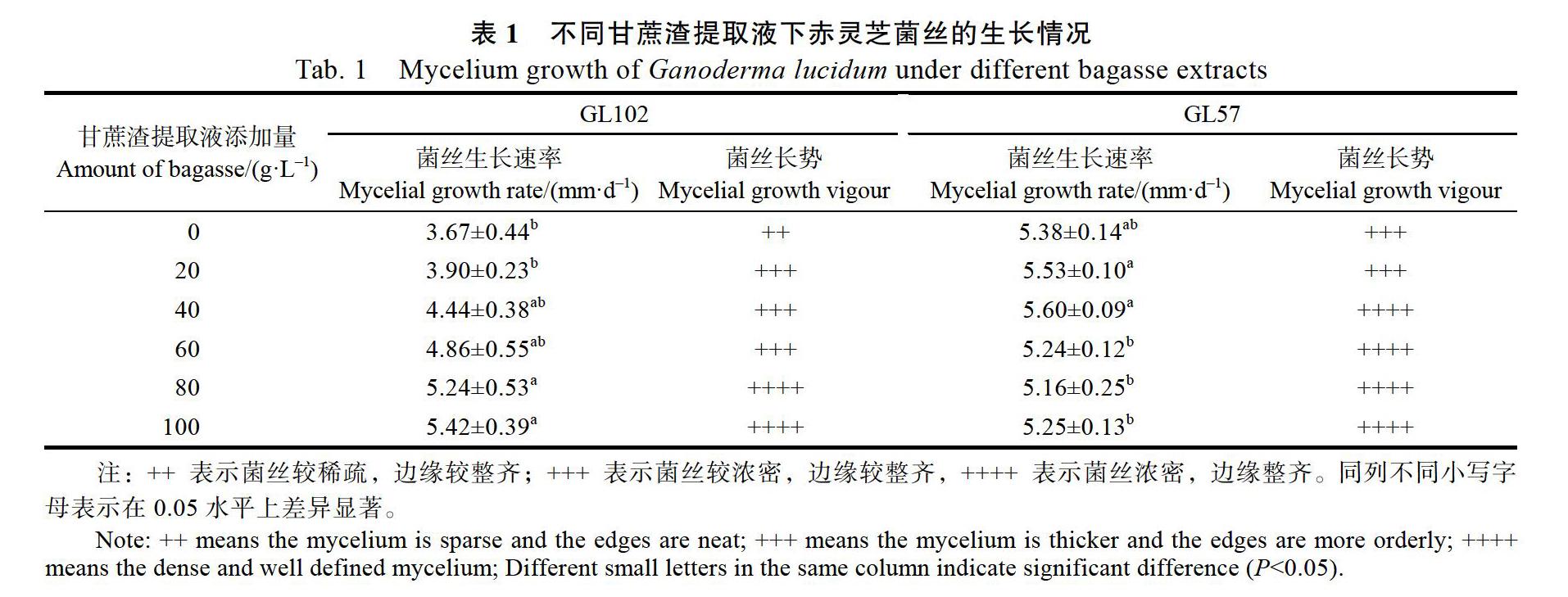
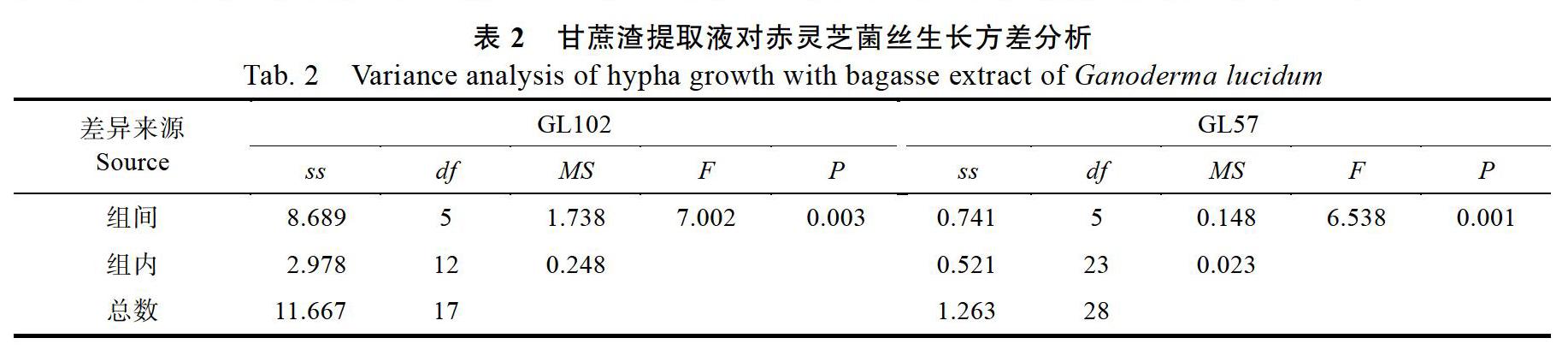
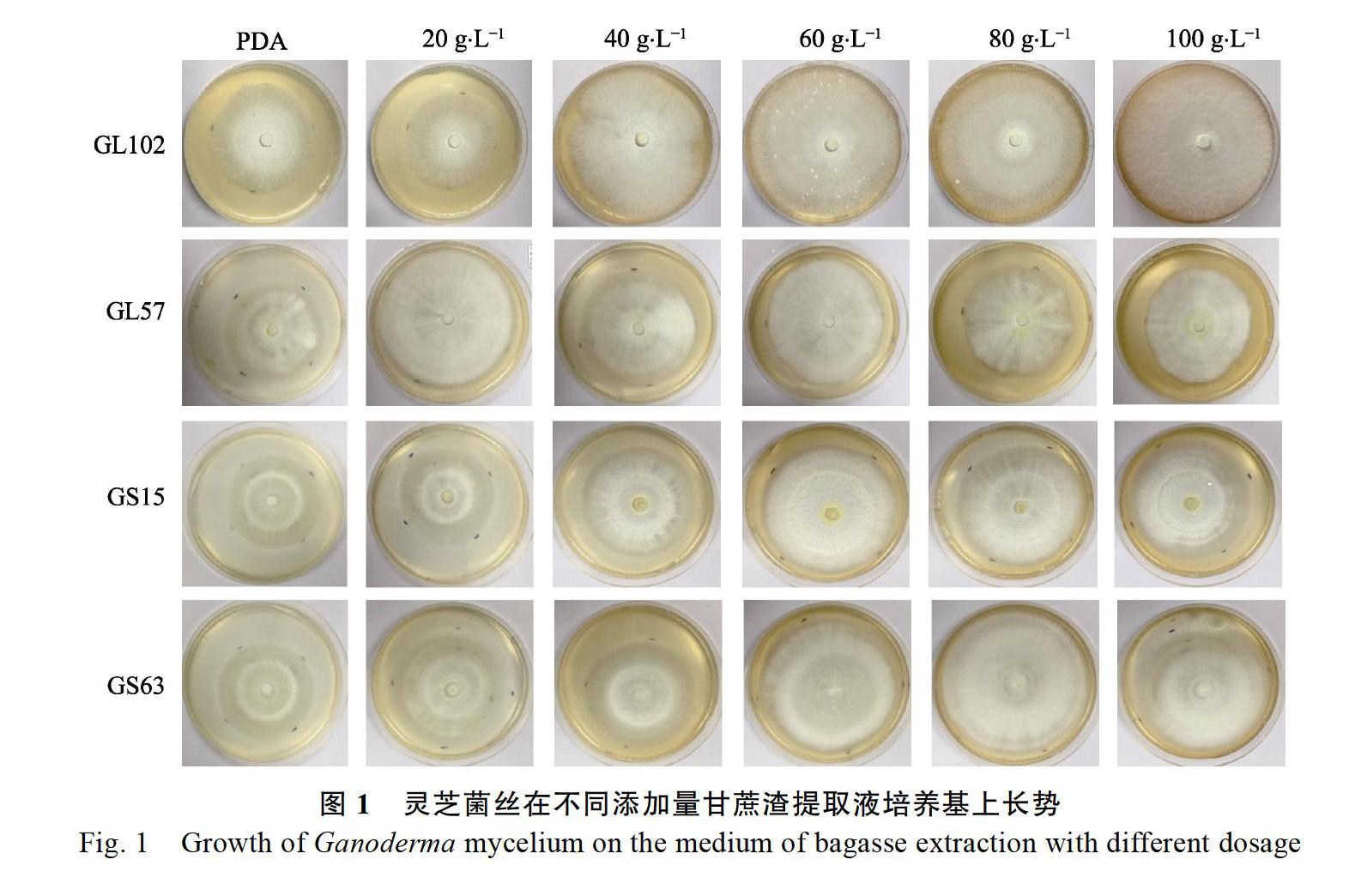
表1和表2结果显示,在0、20、40、60 g/L 4个不同浓度甘蔗渣提取液用量下,GL102菌丝生长速度无显著差异;添加量达到80 g/L或100 g/L时,GL102菌丝的生长速率明显大于对照;添加浓度为100 g/L时,菌丝生长速率比对照提升了48%。甘蔗渣提取液浓度为0、20、40 g/L时,GL57菌丝生长速率无显著差异;浓度为60、80、100 g/L时,GL57菌丝生长速率下降,与20、40 g/L浓度下菌丝生长速率有显著差异,但与对照差异不显著。赤灵芝(GL102和GL57)在PDA培养基的菌丝比较稀疏,而添加甘蔗渣提取液后的培养基菌丝浓密、粗壮、洁白,菌落整齐、圆整,长势明显提升(图1)。
2.2 甘蔗渣对紫灵芝菌丝生长的影响
从表3和表4可知,紫灵芝在添加不同浓度甘蔗渣提取液培养基下,菌丝的生长存在着比较大的差别。添加不同浓度甘蔗渣提取液的培养基中紫灵芝菌丝的生长速率不同,GS63在添加40 g/L以上甘蔗渣提取液的培养基中,菌丝生长速率明显高于对照;添加40~100 g/L甘蔗渣提取液后,GS63菌丝生长速率提升31%~70%。GL15紫灵芝菌丝生长速率在添加20~100 g/L甘蔗渣提取液后显著高于对照,但是不同添加量对GS15菌丝生长无显著差异。紫灵芝(GS63和GS15)在添加甘蔗渣培养基的菌落圆整、菌丝浓密、粗壮、洁白,菌丝长势明显优于PDA培养基(图1)。
2.3 不同保藏方法對灵芝生长的影响
从表5可见,以甘蔗渣作为灵芝菌种保藏基质,4个灵芝菌种萌发时间均在1 d以内,在PDA斜面培养基上菌种萌发时间均为2 d,4个石蜡油保藏的菌种萌发时间为3~6 d。
不同保藏方法下不同菌株的生长速率有所差异,GS15在3种保藏方法上菌丝生长速度没有显著差异,甘蔗渣保藏的GL102菌丝生长速率显著高于石蜡油保藏的,但是与PDA培养基保藏的没有显著性差异;GL57和GS63用甘蔗渣保藏方法的菌丝生长速率明显高于另外2种保藏方法。图2显示,甘蔗渣保藏与PDA斜面保藏的菌丝长势
相差不大,石蜡油保藏的菌丝长势较弱,这可能与刚开始菌种被石蜡油包裹,不易萌发有关。
2.4 灵芝菌种酶活力测定结果
从图3可以看出,在保藏时间和温度一致的情况下,4种灵芝菌种在不同的保藏方法下测得的脱氢酶活力不同,其中用甘蔗渣保藏的菌种脱氢酶活力测得最强,而PDA和石蜡油保藏的菌种脱氢酶活力相差不大。甘蔗渣保藏的菌种脱氢酶活力提升17%~175%,赤芝GL102和紫芝GS63两个菌种的脱氢酶活力较高。这与不同保藏方法下灵芝菌丝生长速率结果趋势一致,进一步说明甘蔗渣可作为灵芝菌种的保藏基质。
3 讨论
甘蔗渣富含纤维素,半纤维素和木质素,结构蓬松,是多数食用菌良好的栽培基质[12-14]。甘蔗渣在食用菌菌种保藏方面的研究甚少。本研究探讨了甘蔗渣对灵芝菌丝生长的影响和对菌种保藏的效果,结果表明:在PDA培养基中适当添加甘蔗渣,可促进赤灵芝和紫灵芝菌丝生长,添加100 g/L甘蔗渣提取液,赤灵芝GL102、紫灵芝GS63和GS15菌丝生长速率分别提高48%、70%和28%,且赤灵芝和紫灵芝长势优于PDA培养基,且甘蔗渣保藏的灵芝菌种萌发定植较快,菌丝生长速率较快,脱氢酶活力强,表现出较强的生长优势。代彦满等[15]在PDA培养基中添加小麦提取物对赤灵芝菌丝生长有较强的促进作用。袁学军等[16]报道灵芝菌丝在PDA加木屑培养基上生长快速,菌丝浓密粗壮。说明在PDA培养基中添加甘蔗渣、小麦、木屑等生物质提取液对灵芝菌丝生长具有不同程度的促进作用。
由于保藏时间所限,本研究尚未能对超低温冰箱及液氮长期保藏效果进行评价,在后续的研究中,将完善这方面的数据。随着分子生物学技术的兴起,基因组学、蛋白组学和代谢组学的发展带动了菌种保藏在基因层面上的研究。Zhang等[17]研究了热应激对灵芝菌丝体生长的影响发现,钙离子参与热激信号转导并调节菌丝体生长。而鲜见针对菌种保藏阶段培养基质等环境因子对菌丝体代谢影响的机理研究。今后将通过对菌种保藏过程中调控菌丝生长的关键基因的发掘,探明保藏过程中的生理变化及其机理机制,可为灵芝菌种以及其他食药用菌菌种的稳定、高效地保藏提供理论支持,以期最终解决菌种保藏中菌种退化的难题。
参考文献
[1]Sun Z, Huang K, Fu X, et al. A chemically sulfated polysaccharide derived from Ganoderma lucidum induces mitochondrial-mediated apoptosis in human osteosarcoma MG63 cells[J]. Tumor Biology, 2014, 35(10): 9919-9926.
[2]Sudheesh N P, Ajith T A, Mathew J, et al. Ganoderma lucidum protects liver mitochondrial oxidative stress and improves the activity of electron transport chain in carbon tet-
[3]rachloride intoxicated rats[J]. Hepatol Research, 2012, 42(2): 181-191.
[4]Pan K, Jiang Q, Liu G, et al. Optimization extraction of Ganoderma lucidum polysaccharides and its immunity and antioxidant activities[J]. International Journal of Biological Macromolecules, 2013, 55: 301-306.
[5]Hu R K, Guo W L, Huang Z R, et al. Extracts of Ganoderma lucidum attenuate lipid metabolism and modulate gut microbiota in high-fat diet fed rats[J]. Journal of Functional Foods, 2018, 46: 403-412.
[6]Kawahara Y, Kamiuchi S, Okazaki M, et al. Inhibitory effects of a water-soluble extract from culture medium of Ganoderma lucidum (Rei-shi) mycelia on postprandial blood glucose elevation in mice and additional effect with alpha-glucosidase inhibitor[J]. Japanese Journal of Complementary and Alternative Medicine, 2011, 8(1): 1-9.
[7]郭玲玲. 微生物菌种保藏方法及关键技术[J]. 微生物学杂志, 2019, 39(3): 105-108.
[8]刘远超, 梁晓薇, 莫伟鹏, 等. 食用菌菌种保藏方法的研究进展[J]. 中国食用菌, 2018, 37(5): 1-6.
[9]崔凤江, 宋 烨. 食用菌引种的重要性及相关问题[J]. 中国林副特产, 2005(3): 84.
[10]邓 强, 张 馄. 甘蔗渣纤维索的微生物和酶降解研究进展[J]. 化学工程与装备, 2008(5): 79-83.
[11]Zhang R Y, Hu D D, Ma X T, et al. Adopting stick spawn reduced the spawn running time and improved mushroom yield and biological efficiency of Pleurotus eryngii[J]. Scientia Horticulturae, 2014, 175: 156-159.
[12]黄清铧, 王庆福, 张柳莲, 等. 甘蔗渣栽培的不同颜色侧耳中的氨基酸组成与蛋白质营养评价[J]. 北方园艺, 2019(10): 127-133.
[13]马海霞, 马子龙, 马国营, 等. 甘蔗渣栽培玉木耳培养基配方的筛选[J]. 中国食用菌, 2018, 37(3): 25-29.
[14]李营营, 徐勇士, 陆登俊, 等. 甘蔗渣栽培食用菌的应用与研究进展[J]. 中国农学通报, 2016, 32(17): 44-48.
[15]陆海勤, 史昌蓉, 黄 耘, 等. 利用甘蔗渣和亚硫酸法糖厂滤泥栽培双孢蘑菇[J]. 食用菌学报, 2015, 22(4): 31-36.
[16]代彦满, 陈书明, 张 棋. 赤灵芝菌种培养基的比较与筛选[J]. 西北林学院学报, 2019, 34(4): 162-165.
[17]袁学军, 李艳丽, 陈永敢, 等. 野生灵芝菌种培养基筛选的研究[J]. 中国食用菌, 2012, 31(4): 24-26.
[18]Zhang X, Ren A, Li M J, et al. Heat stress modulates mycelium growth, heat shock protein expression, ganoderic acid biosynthesis, and hyphal branching of Ganoderma lucidum via cytosolic Ca2+[J]. Applied and Environmental Microbiology, 2016, 82(14): 4112-4125.
責任编辑:白 净

