泛基因型直接抗病毒药物治疗慢性丙型肝炎的成本-效用分析
魏霞 杨莉


中圖分类号 R956 文献标志码 A 文章编号 1001-0408(2021)08-0979-07
DOI 10.6039/j.issn.1001-0408.2021.08.14
摘 要 目的:评价泛基因型直接抗病毒药物(DAAs)治疗慢性丙型肝炎患者的成本-效用,为相关医疗卫生决策提供药物经济学证据。方法:从全社会角度出发,以中国初治慢性丙型肝炎患者为目标人群,参考文献资料建立Markov模型,以索磷布韦维帕他韦为对照,分析格卡瑞韦派伦他韦、索磷布韦+可洛派韦治疗慢性丙型肝炎患者的质量调整生命年(QALYs)和增量成本-效用比(ICERs);采用敏感性分析验证结果的稳健性。结果:与索磷布韦维帕他韦相比,格卡瑞韦哌仑他韦增加了0.002 1 QALYs,成本增加25 021元,ICERs为12 129 031元/QALY(意愿支付阈值为70 892元/QALY),不具有成本-效用;当其单价下降至1 679元时(降价64.65%)将具有成本-效用。索磷布韦+可洛派韦增加了0.002 0 QALYs,成本减少515元,是成本节约的绝对优势方案。敏感性分析显示,持续病毒学应答率和药品价格对结果的影响最大,索磷布韦+可洛派韦具有成本-效用的概率高于格卡瑞韦哌仑他韦。结论:格卡瑞韦哌仑他韦需大幅降低价格,才可达到更好的可负担性;索磷布韦+可洛派韦具有良好的经济性。
关键词 慢性丙型肝炎;直接抗病毒药物;成本-效用分析;Markov模型;泛基因型
Cost-utility Analysis of the Pan-genotypic Direct-acting Antivirals in the Treatment of Chronic Hepatitis C Infection
WEI Xia,YANG Li(School of Public Health, Peking University/Health Policy and Technology Assessment Center, Peking University Health Science Center, Beijing 100191, China)
ABSTRACT OBJECTIVE: To evaluate the cost-utility of the pan-genotypic direct-acting antivirals (DAAs) in the treatment of patients with chronic hepatitis C infection, and to provide pharmacoeconomic evidence for relevant health care decisions. METHODS: A Markov model was established from a societal perspective with newly diagnosed chronic hepatitis C patients in China as the target population, and analyzed quality-adjusted life years (QALYs) and incremental cost-utility ratios (ICERs) of patients with chronic hepatitis C with sofosbuvir/velpatasvir, glecaprevir/pibrentasvir, sofosbuvir+coblopasvir. Sensitivity analysis was used to verity the robustness of the results. RESULTS: Glecaprevir/pibrentasvir increased QALYs by 0.002 1 and costs by 25 021 RMB, compared to sofosbuvir/velpatasvir; its ICERs was 12 129 031 yuan/QALY (willingness to pay threshold was 70 892 yuan/QALY), which had no cost-utility; glecaprevir/pibrentasvir need to cut down the price by 64.65% to have cost-utility. Sofosbuvir+coblopasvir increased QALYs by 0.002 0 and saved costs by 515 yuan, so it was the optimal regimen which was cost-saving. Sensitivity analysis showed that SVR rates and drug prices were the most influential factors. The probability of having cost-utility for sofosbuvir+coblopasvir was higher than glecaprevir/pibrentasvir. CONCLUSIONS: Glecaprevir/pibrentasvir need to reduce the price to achieve better affordability. Sofosbuvir+coblopasvir shows economical advantage.
KEYWORDS Chronic hepatitis C virus infection; Direct-acting antivirals; Cost-utility analysis; Markov model; Pan-genotypic
丙型肝炎是由丙型肝炎病毒(HCV)感染引起的传染性肝病。HCV是多变异病毒,主要包括7种基因型,我国丙型肝炎患者常见的HCV基因型从多到少依次为1b型(56.8%)、2型(24.1%)、3型(9.1%)及6型(6.3%),少见4型和5型的相关报道[1]。HCV慢性感染可导致肝脏慢性炎症坏死和纤维化,并可发展为肝硬化甚至肝癌,对患者的健康和生命危害极大,已成为严重的社会和公共卫生问题[1]。
世界卫生组织(WHO)发布的全球肝炎报告指出,2015年全球丙型肝炎发病率为23.7/10万,约有7 100万人为慢性感染患者[2]。近年来,我国丙型肝炎的发病率也逐年增高,从2008年的8.21/10万人增长至2018年的15.79/10万人[3-4]。肝硬化及肝癌是丙型肝炎患者的主要死因,我国2016年由于丙型肝炎导致的肝癌病死率为0.4/10万,肝硬化病死率为0.2/10万[2]。与此同时,丙型肝炎医疗费用随患者病情的进展也不断升高,有报道显示,慢性丙型肝炎、肝硬化、肝癌患者的中位住院费用分别为8 111、8 399、14 425元[5],给患者家庭和社会均造成了沉重的疾病负担。
丙型肝炎慢性化率较高,且目前尚无有效的HCV预防疫苗,治疗是防止其传播的重要手段,即“治等于防”[1]。丙型肝炎以药物抗病毒治疗为主,主要疗效指标为持续病毒学应答(SVR)率。近年来,临床治疗HCV的药物由早期以干扰素为代表的药物发展到直接抗病毒药物(DAAs),患者从注射给药转为口服给药,不仅提高了治疗效果和用药依从性,而且还缩短了治疗周期,且使不良反应发生率显著下降。然而随着DAAs的进一步发展,丙型肝炎患者在药物治疗时已不再需要检测基因型,丙型肝炎治疗进入了泛基因型时代。目前,在我国上市的泛基因型直接抗病毒药物包括索磷布韦维帕他韦、格卡瑞韦哌仑他韦、可洛派韦及索磷维伏等,其中可洛派韦需与索磷布韦联用[1]。
2020版《国家基本医疗保险、工伤保险和生育保险药品目录》纳入了4种丙型肝炎治疗药物——艾尔巴韦格拉瑞韦、来迪派韦索磷布韦、索磷布韦维帕他韦、可洛派韦,由于可洛派韦需与索磷布韦联用,故上述药物中仅索磷布韦维帕他韦为可用于非基因1b型患者的单一制剂泛基因型药物。尽管纳入医保后上述药物降价明显,但其总费用仍然较高,患者的可负担性仍然较差[6]。因此,有必要对我国已上市的泛基因型药物进行经济学评价,以丰富患者的治疗选择,减少其疾病治疗负担。目前,基于我国社会背景发表的药物经济学研究多针对基因1b型HCV治疗药物,且多数采用传统的聚乙二醇干扰素作为对照进行评价分析,尚缺乏针对抗丙型肝炎的泛基因型药物的相关研究。基于此,本研究从全社会角度出发,以索磷布韦维帕他韦为对照,采用Markov模型对我国已上市的抗丙型肝炎泛基因型药物——索磷布韦维帕他韦、格卡瑞韦派伦他韦、索磷布韦+可洛派韦3种方案进行成本-效用分析,以期为相关医疗卫生决策提供药物经济学证据。
1 资料与方法
1.1 模型结构与假设
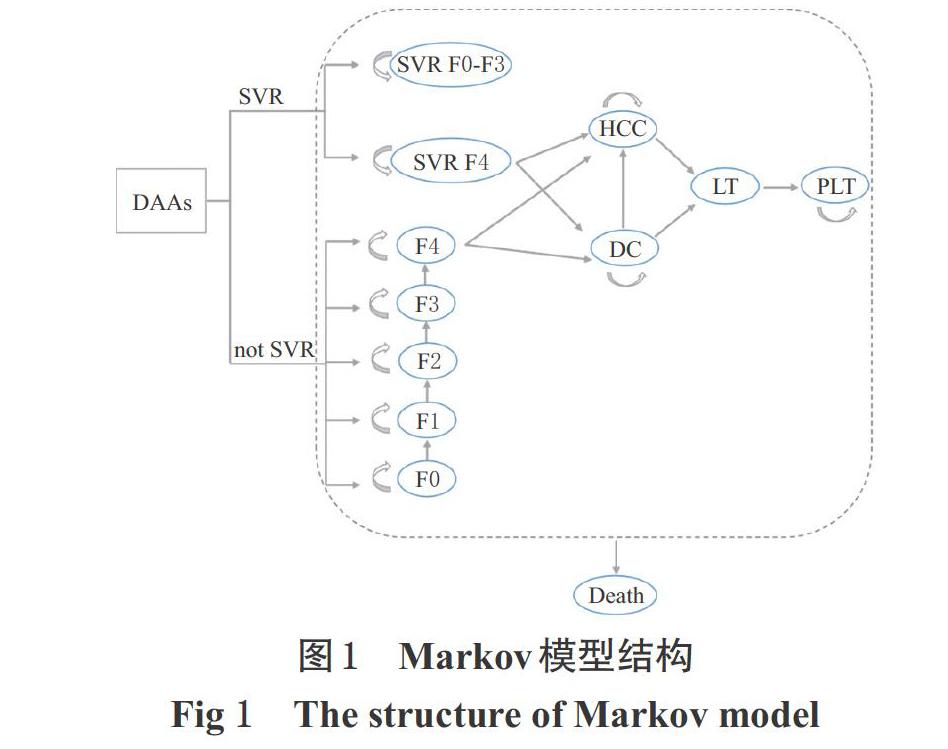
由于丙型肝炎为慢性进展性疾病,本研究选择Markov模型进行模拟。根据丙型肝炎疾病进展和其治疗药物经济学评价的常用模型[7],本研究模型共包含15种健康状态:Metavir肝纤维化评分为F0~F4阶段(F0~F3为肝纤维化,F4为代偿性肝硬化)及各阶段获得SVR后的状态,和失代偿性肝硬化(DC)、肝细胞癌(HCC)、肝移植(LT)、肝移植后(PLT)和死亡(Death),详见图1。
模型分为治疗和疾病进展阶段两部分,模型循环周期设为1年。假设患者均需药物治疗,治疗阶段患者接受不同的方案治疗,根据初始健康状态和是否获得SVR决定后续阶段的治疗走向。其中,F0~F3阶段患者获得SVR后不再发生疾病进展,获得SVR的F4阶段患者仍有一定概率进展为DC或HCC,但其概率低于未获得SVR的患者[8]。未获得SVR的患者将进入疾病自然演变过程,即进展为DC或HCC;DC状态的患者可进展为HCC或接受肝移植,HCC状态患者也可接受肝移植。所有患者均可能發生死亡,F0~F4阶段及获得SVR的患者不会直接因肝病死亡,按全因死亡率发生死亡;其余患者需同时考虑肝病相关死亡和全因死亡[9]。
1.2 模型参数设置
1.2.1 模拟队列人群特征 本研究目标人群为中国初治慢性丙型肝炎患者,包括处于F0~F3阶段(无肝硬化)和F4阶段(代偿性肝硬化)的患者;排除处于DC或HCC阶段以及合并感染艾滋病病毒或乙型肝炎病毒的患者。模拟队列基线特征来自Rao等[10]的横断面观察性研究,该研究对28家医院收治的997例初治慢性丙型肝炎汉族患者进行了相关分析,患者确诊时的平均年龄为43.5岁,男性比例为54.76%,因此本研究将模型起始年龄设定为45岁。基线F0~F4各阶段患者占比来自Li等[11]对121例初治慢性丙型肝炎汉族患者的随访研究,通过测定患者的Metavir评分,得到F0~F4各阶段患者占比分别为0.8%(1人)、45.5%(55人)、41.3%(50人)、9.9%(12人)、2.5%(3人)。
1.2.2 治疗方案和疗效 进入我国市场且可以获得公开价格和疗效数据的泛基因型药物(索磷布韦维帕他韦、格卡瑞韦哌仑他韦)及联合治疗方案(索磷布韦+可洛派韦)均被纳入本研究。由于索磷维伏仅被推荐用于基因3型代偿性肝硬化患者[1],故本研究未纳入该方案。
采用SVR率为疗效指标,各治疗方案在无肝硬化和代偿性肝硬化患者中的SVR率来源于亚洲或中国临床试验(如表1所示)。索磷布韦维帕他韦的SVR率来自一项亚洲3期单臂临床试验,该研究共纳入各基因型丙型肝炎患者375例,中国患者占比70.13%;接受12周治疗后,无肝硬化和代偿性肝硬化患者的SVR率分别为97.16%和98.95%[12]。格卡瑞韦哌仑他韦的SVR率来自两项亚洲3期临床试验VOYAGE-1和VOYAGE-2,其中VOYAGE-1为一项3期随机对照临床试验,该研究共纳入546例无肝硬化患者,疗程8周,中国患者占比71.24%,得到无肝硬化患者的SVR率为97.34%;VOYAGE-2为一项3期单臂临床试验,共纳入160例代偿性肝硬化患者,疗程12周,中国患者占比76.87%,得到代偿性肝硬化患者的SVR率为96.82%[13]。索磷布韦+可洛派韦的SVR率来自一项中国3期单臂临床试验,该研究共纳入371例患者,疗程12周,无肝硬化和代偿性肝硬化患者的SVR率分别为97.47%和94.81%[14]。
1.2.3 转移概率和死亡率 Markov模型各状态间的转移概率见表2。其中,慢性丙型肝炎患者由F0进展至F4的转移概率来自一项大样本的Meta分析,该研究共纳入111项研究中的33 121例慢性丙型肝炎患者,采用Markov极大似然估计获得相应的转移概率[15];F4进展至DC和HCC的转移概率来自于对384例代偿性肝硬化患者进行的5年随访研究[16];DC进展至HCC、DC进展至死亡和HCC进展至死亡的转移概率来自于对200例失代偿性肝硬化患者进行的随访研究[17];DC和HCC患者进行肝移植的概率及移植后的死亡概率来自于对34项丙型肝炎治疗药物经济学评价研究的文献综述[18];获得SVR的F4状态患者进展为DC和HCC的概率低于未获得SVR患者,其相应数据来自于对1 050例慢性丙型肝炎患者进行的5年随访研究[19]。F0~F4阶段及获得SVR后的患者不会直接因肝病死亡,按全因死亡率发生死亡,全因死亡率参考WHO公布的各国平均寿命表(因篇幅所限,此处省略)[20]。此外,全因死亡率需转换成状态间转移概率,换算公式为:P=1-e-rt(式中,t为时间间隔,r为事件发生率,P为该时间间隔内状态间转移概率)[21]。
1.2.4 成本 本研究从我国全社会角度出发进行分析,成本包括直接医疗成本、直接非医疗成本和间接成本。所有成本均以我国医疗保健消费价值指数(CPI)转换为2019年值。
直接医疗成本包括药品费用、检测费用和各健康状态年均直接医疗费用。药品费用通过药品单价和治疗周期计算得到,药品单价来自于药智网公布的各省截至2019年12月的中标价中位数[22]或企业提供的市场零售价,具体数值见表3。根据我国《丙型肝炎防治指南(2019年版)》[1],检测包括治疗前和治疗期间的检测,由于泛基因型方案不需要进行基因检测,因此治疗前检测仅包括肝纤维化分期检测,治疗期间每次检测至少包括肝肾功能检查、病毒载量检查、血常规检查和B超检查。笔者咨询感染专科医师并参考天津市三级甲等医院2019年收费标准,最终确定肝纤维化分期检测费用为140元,治疗期间每次检测费用为1 000元,再根据治疗周期计算检测总费用。各状态年均直接医疗费用来自一项对中国大陆9个城市丙型肝炎患者的问卷调查,调查得到F0~F3、F4、DC和HCC状态患者的年均直接医疗费用分别为6 219、17 700、39 422、83 212元[23];肝移植及移植后患者年均直接医疗费用来自中国某器官移植中心肝移植患者费用负担研究,分别为377 594和60 025元[24]。此外,F4状态患者获得SVR后的年均直接医疗费用来自美国对1 924例慢性丙型肝炎患者治疗完成后的5年随访研究,获得SVR患者的费用为未获得患者的0.709倍[25]。
目前有关慢性丙型肝炎直接非医疗成本和间接成本的相关研究较少,这两部分成本通过对门诊患者进行问卷调查收集,得到每次就诊的直接非医疗成本和间接成本见表4。由于天津市开展了对丙型肝炎治疗药物的按人头付费试点工作,患者管理更为集中和规范,且该市丙型肝炎患者主要就诊于天津市某定点医院,因此选择该院丙型肝炎门诊开展现场调查。通过电话通知患者参与问卷调查,收集其每次就诊的交通时间、就诊时间、陪同人数和交通费用等信息。调查时间为2018年11月-2019年1月,共收集到患者问卷145份,2018年调查患者的费用按CPI转化为2019年值。直接非医疗成本为患者及陪同家属的交通费,间接成本为患者及陪同家属的误工费。其中,每次就诊交通费=单程单人交通费×2×(1+陪同人数);误工费采用人力资本法由误工时间和人均可支配收入计算得到,每次就诊误工天数=(单程交通时间分钟数×2/60+医院就诊时间小时数)×(1+陪同人数)/8[26],结合2019年全国人均可支配收入(30 733元)[27],计算每次就诊的误工费。根据我国《丙型肝炎防治指南(2019年版)》,患者需在基线、治疗4 周、治疗结束、治疗结束后12 周时进行疗效和安全性的监测[1],因此本研究设定患者就诊次数为4次。将与治疗相关的药品、检测、交通和误工费相加,得到索磷布韦维帕他韦、格卡瑞韦哌仑他韦和索磷布韦+可洛派韦的总成本分别为17 752、43 024和17 648元。
1.2.5 健康效用值 健康效用值包括慢性丙型肝炎患者各状态效用值、治疗期间效用值以及获得SVR后的效用值等3部分,各状态健康效用值详见表5。其中,各状态中F0~F3、F4、DC、HCC的效用值来自Thein等[28]对丙型肝炎患者生活质量研究的系统综述;LT、PLT的效用值来自McLernon等[29]对丙型肝炎患者生活质量研究的系统综述。治疗期间效用值由于不良反应而下降[30],获得SVR后的效用值来自Wright等[31]的研究。
1.3 模型分析
应用Excel 2016建立Markov模型,对成本和产出按5%的贴现率进行贴现[32],设定意愿支付阈值为每质量调整生命年(QALYs)70 892元(2019年国内人均GDP的1倍)。单因素敏感度分析中,对于从文献中收集的数据,若该文献提供相应数据的置信区间或分布范围,则将其作为相应变量的最大值和最小值;若未提供,则取基础值±25%作为最大值和最小值,贴现率取8%和0作为最大值和最小值,结果以飓风图表示;概率敏感度分析采用Monte Carlo模拟,模拟1 000次,成本数据服从Gamma分布,SVR率服从Uniform分布,转移概率及效用值服从Beta分布,结果以增量成本-效用散点图和成本-效用可接受曲线表示。采用阈值分析计算各方案具有成本-效用的阈值价格。
2 结果
2.1 基础分析
3种治疗方案的成本-效用分析结果见表6。由表6可见,与索磷布韦维帕他韦相比,格卡瑞韦哌仑他韦增加了0.002 1 QALYs,其成本增加25 021元,增量成本-效用比(ICERs)为12 129 031元/QALY,远高于本研究的意愿支付阈值(70 892元/QALY),因此格卡瑞韦哌仑他韦在当前价格下不具有成本-效用。而相比于索磷布韦维帕他韦,索磷布韋+可洛派韦增加了0.002 0 QALYs,其成本减少515元,是绝对优势治疗方案。
2.2 单因素敏感度分析
单因素敏感度分析分为格卡瑞韦哌仑他韦vs.索磷布韦维帕他韦和索磷布韦+可洛派韦vs.比索磷布韦维帕他韦两部分,其对应的飓风图见图2(图中展示了对结果影响最大的前10位参数)。由图2A可见,对于格卡瑞韦哌仑他韦,排在第1位的影响因素为索磷布韦维帕他韦在代偿性肝硬化患者中的SVR率,并且所有参数在设定范围内变化时,格卡瑞韦哌仑他韦相比于索磷布韦维帕他韦均不具有成本-效用(部分ICERs由于格卡瑞韦哌仑他韦QALYs更少、成本更高而为负数)。由图2B可见,对于索磷布韦+可洛派韦,排在第1位的影响因素为索磷布韦维帕他韦的价格,当索磷布韦维帕他韦价格下调时,索磷布韦+可洛派韦不再具有成本-效用,其余参数在设定范围内变化时,索磷布韦+可洛派韦均具有成本-效用。
2.3 概率敏感度分析
概率敏感度分析也分为格卡瑞韦哌仑他韦vs.索磷布韦维帕他韦和索磷布韦+可洛派韦vs.索磷布韦维帕他韦两部分,其对应的增量成本-效用散点图见图3。由图3A可见,格卡瑞韦哌仑他韦相比于索磷布韦维帕他韦的增量成本和增量效用散点大多在意愿支付线的上方,说明格卡瑞韦哌仑他韦在多数情况下不具有成本-效用。由图3B可见,索磷布韦+可洛派韦相比于索磷布韦维帕他韦的增量成本和增量效用散点部分位于意愿支付线的下方(包括第四象限),说明索磷布韦+可洛派韦在部分情况下具有成本-效用。
3种治疗方案的成本-效用可接受曲线见图4。由图4可见,当意愿支付阈值从70 892元/QALY(2019年国内人均GDP的1倍)增加到212 676元/QALY(2019年国内人均GDP的3倍)时,格卡瑞韦哌仑他韦具有成本-效用的概率从0.30%变化为6.40%,索磷布韦+可洛派韦从62.70%变化为57.00%,索磷布韦维帕他韦从37.00%变化为36.60%。
2.4 阈值分析
基础分析中,格卡瑞韦哌仑他韦相比于索磷布韦维帕他韦不具有成本-效用。为使格卡瑞韦哌仑他韦具有成本-效用,保持其他参数不变,需要降低格卡瑞韦哌仑他韦的价格。当格卡瑞韦哌仑他韦单价下降至1 679元时(降低64.65%),其相比于索磷布韦维帕他韦的ICERs恰为70 892元/QALY(2019年国内人均GDP的1倍),此时该方案具有成本-效用。
3 讨论
目前我国临床已有多种泛基因型直接抗病毒治疗方案,但仅索磷布韦维帕他韦进入了2019年版国家医保药品目录,丙型肝炎患者尤其是非基因1b型患者用药选择较为局限。本研究从我国全社会角度建立了Markov模型,以索磷布韦维帕他韦为对照,对常用泛基因型方案进行了比较。本研究结果表明,相比于索磷布韦维帕他韦,格卡瑞韦哌仑他韦在当前价格下不具有成本-效用;若其价格下降64.65%时,该药将具有成本-效用。相比于索磷布韦维帕他韦,索磷布韦+可洛派韦在当前价格下是成本节约的。敏感度分析显示,SVR率和药品价格对结果的影响最大,当意愿支付阈值从2019年国内人均GDP的1倍增加到3倍时,索磷布韦+可洛派韦具有成本-效用的概率均高于格卡瑞韦哌仑他韦。
以往基于我国社会背景发表的经济学评价研究主要针对基因1b型丙型肝炎患者,主要评价基因型特异性DAAs方案,如阿舒瑞韦+达拉他韦、索磷布韦+利巴韦林以及艾尔巴韦格拉瑞韦等[23,32- 34];而对泛基因型方案的评价则主要集中于索磷布韦维帕他韦,且仍按照基因型的分类框架进行比较,缺乏对泛基因型方案和全患者人群的研究[35-36]。2019年,我国首次对DAAs开展药品谈判后,DAAs的价格大幅下降,之前的经济学评价结果可能将不再适用。此外,既往研究多采用付费方角度,涵盖的成本主要为直接医疗成本。本研究采用我国全社会角度,且从患者调查的真实世界数据中获取直接非医疗成本和间接成本,可反映除医疗费用以外的疾病负担。
但本研究也存在一定的局限性。第一,虽然本研究所选取的临床试验中患者具有相似的基线特征,但SVR率来自单独的临床试验而不是相应方案的直接比较;第二,由于缺乏我国丙型肝炎患者人群的效用数据和F4状态患者获得SVR后的年均直接医疗费用,本研究使用了国外人群的相关数据,可能会对结果产生一定影响;第三,直接非医疗成本和间接成本调查的样本量需进一步扩大以提高结果的普遍性;第四,本研究假设患者仅接受1次治疗,未考虑治疗失败和再次感染的情形,由于缺乏相应的流行病学数据,有待后续研究进行相应补充。
WHO已推荐优先使用泛基因型直接抗病毒治疗方案进行丙型肝炎治疗,该方案可简化临床治疗路径,更适合于难以配备基因检测设备的基层医疗机构[37]。我国后续上市的泛基因型直接抗病毒治疗方案中,格卡瑞韦哌仑他韦可以提供更短的8周治疗方案,但其需要较大幅度的降价以提高患者的可负担性;索磷布韦+可洛派韦作為首个泛基因型直接抗病毒治疗国产药物方案,具有良好的经济性,且可洛派韦在最近结束的2020年医保药品谈判中进入了国家医保药品目录,降价幅度为16%[38],其经济性将得以进一步提升,未来丙型肝炎患者的治疗选择将更为丰富。
参考文献
[ 1 ] 中华医学会肝病学分会,中华医学会感染病学分会.丙型肝炎防治指南:2019年版[J].中华临床感染病杂志,2020,38(1):429-450.
[ 2 ] World Health Organization. Global hepatitis report:2017
[EB/OL]. (2017-04)[2020-12-20]. https://www.who.int/hepatitis/publications/global-hepatitis-report2017/en/.
[ 3 ] 卫生部.中国卫生统计年鉴[M].北京:中国协和医科大学出版社,2009:235-245.
[ 4 ] 國家卫生健康委员会.中国卫生健康统计年鉴[M].北京:中国协和医科大学出版社,2019:251-262.
[ 5 ] DUAN Z P,ZHOU H Y,DUAN C,et al. Survey of treatment costs to hepatitis C in China[J]. Value Health,2014,17(7):A805.
[ 6 ] 魏来,李洪,贾继东,等.中国直接抗病毒药物治疗丙型肝炎时代的关键任务(英文)[J].中国病毒病杂志,2017,7(6):405-407.
[ 7 ] 魏霞,杨莉.丙型肝炎治疗药物经济学评价研究综述[J].中国新药杂志,2020,29(9):1059-1068.
[ 8 ] SINGAL A G,VOLK M L,JENSEN D,et al. A sustained viral response is associated with reduced liver-related morbidity and mortality in patients with hepatitis C virus[J]. Clin Gastroenterol Hepatol,2010,8 (3):280-288.
[ 9 ] WOLFE R A,ROYS E C,MERION R M. Trends in organ donation and transplantation in the United States,1999- 2008[J]. Am J Transplant,2010,10 (4 Pt 2):961-972.
[10] RAO H,WEI L,LOPEZ-TALAVERA J C,et al. Distribution and clinical correlates of viral and host genotypes in Chinese patients with chronic hepatitis C virus infection[J]. J Gastroenterol Hepatol,2014,29 (3):545-553.
[11] LI J F,LIU S,REN F,et al. Fibrosis progression in interferon treatment-naive Chinese plasma donors with chronic hepatitis C for 20 years:a cohort study[J]. Int J Infect Dis,2014,27:49-53.
[12] WEI L,LIM S G,XIE Q,et al. Sofosbuvir-velpatasvir for treatment of chronic hepatitis C virus infection in Asia:a single-arm,open-label,phase 3 trial[J]. Lancet Gastroenterol Hepatol,2019,4 (2):127-134.
[13] WEI L,WANG G,ALAMI N N,et al. Glecaprevir-pibrentasvir to treat chronic hepatitis C virus infection in Asia:two multicentre,phase 3 studies:a randomised,double-blind study (VOYAGE-1)and an open-label,single-arm study (VOYAGE-2)[J]. Lancet Gastro Hep,2020,5 (9):839-849.
[14] GAO Y,KONG F,LI G,et al. Coblopasvir and sofosbuvir for treatment of chronic hepatitis C virus infection in China:a single-arm,open-label,phase 3 trial[J/OL]. Liver International,2020.[2020-08]. https://www.researchgate.net/publication/343538817_Coblopasvir_and_sofosbuvir_for_
treatment_of_chronic_hepatitis_C_virus_infection_in_
China_A_single-arm_open-label_phase_3_trial. DOI:10.
1111/liv.14633.
[15] THEIN H H,YI Q,DORE G J,et al. Estimation of stage-specific fibrosis progression rates in chronic hepatitis C virus infection:a meta-analysis and meta-regression[J]. Hepatology,2008,48 (2):418-431.
[16] FATTOVICH G,GIUSTINA G,DEGOS F,et al. Morbidity and mortality in compensated cirrhosis type C:a retrospective follow-up study of 384 patients[J]. Gastroentero- logy,1997,112 (2):463-472.
[17] PLANAS R,BALLEST? B,ALVAREZ M A,et al. Na- tural history of decompensated hepatitis C virus-related cirrhosis: a study of 200 patients[J]. J Hepatol,2004,40 (5):823-830.
[18] TOWNSEND R,MCEWAN P,KIM R,et al. Structural frameworks and key model parameters in cost-effectiveness analyses for current and future treatments of chronic hepatitis C[J]. Value Health,2011,14 (8):1068-1077.
[19] DIENSTAG J L,GHANY M G,MORGAN T R,et al. A prospective study of the rate of progression in compensa- ted,histologically advanced chronic hepatitis C[J]. Hepatology,2011,54 (2):396-405.
[20] World Health Organization. Life tables of the World Health Organization member states (2016)[EB/OL]. [2019-12- 20].http://apps.who.int/gho/data/view.main.60340?lang=en.
[21] 孙利华.药物经济学[M].北京:中国医药科技出版社,2016:135.
[22] 药智网.药品中标信息查询[EB/OL]. [2019-12-20].https://db.yaozh.com/.
[23] CHEN GF,WEI L,CHEN J,et al. Will sofosbuvir/ledipasvir (harvoni)be cost-effective and affordable for Chinese patients infected with hepatitis C virus:an economic ana- lysis using real-world data[J]. PLoS One,2016,11 (6):e0155934.
[24] 高琴.某器官移植中心肝、肾移植患者费用负担研究[D].长沙:中南大学,2007.
[25] MANOS M M,DARBINIAN J,RUBIN J,et al. The effect of hepatitis C treatment response on medical costs:a longitudinal analysis in an integrated care setting[J]. J ManagCare Pharm,2013,19 (6):438-447.
[26] 吴久鸿,吴晶,赵绯丽,等.药物经济学[M].北京:高等教育出版社,2017:14-15.
[27] 国家统计局.年度数据[EB/OL]. [2020-12-28]. https://data.stats.gov.cn/easyquery.htm?cn=C01.
[28] THEIN H H,KRAHN M,KALDOR J M,et al. Estimation of utilities for chronic hepatitis C from SF-36 scores[J]. Am J Gastroenterol,2005,100 (3):643-651.
[29] MCLERNON D J,DILLON J,DONNAN P T. Health- state utilities in liver disease:a systematic review[J]. Med Decis Making,2008,28 (4):582-592.
[30] YOUNOSSI Z M,SINGER M E,MIR H M,et al. Impact of interferon free regimens on clinical and cost outcomes for chronic hepatitis C genotype 1 patients[J]. J Hepatol,2014,60 (3):530-537.
[31] WRIGHT M,GRIEVE R,ROBERTS J,et al. Health benefits of antiviral therapy for mild chronic hepatitis C:randomised controlled trial and economic evaluation[J]. Health Technol Assess,2006,10 (21):55-60.
[32] 《中國药物经济学评价指南》课题组.中国药物经济学评价指南:2020版[M].北京:中国市场出版社,2020:27-28.
[33] CHEN W,WARD T,TAN M,et al. Daclatasvir combined with asunaprevir is a cost-effective and cost-saving treatment for hepatitis C infection in China[J]. J Comp Eff Res,2018,7(8):785-795.
[34] LI X,CHAN N S,TAM A W,et al. Budget impact and cost-effectiveness analyses of direct-acting antivirals for chronic hepatitis C virus infection in Hong Kong[J]. Eur J Clin Microbiol Infect Dis,2017,36 (10):1801-1809.
[35] WEI X,ZHAO J,YANG L. Cost-effectiveness of new antiviral treatments for non-genotype 1 hepatitis C virus infection in China:a societal perspective[J]. BMJ Glob Health,2020,5 (11):e003194.
[36] YUN H,ZHAO G,SUN X,et al. Cost-utility of sofosbuvir/velpatasvir versus other direct-acting antivirals for chronic hepatitis C genotype 1b infection in China[J]. BMJ Open,2020,10 (8):e035224.
[37] 陈仲丹.全球丙型肝炎消除的进展、挑战及应对[J].中华肝脏病杂志,2020,28(10):812-816.
[38] 国家医疗保障局.国家医保局、人力资源社会保障部关于印发《国家基本医疗保险、工伤保险和生育保险药品目录(2020年)》的通知:医保发〔2020〕53号[Z]. 2020-12- 28.
(收稿日期:2020-10-23 修回日期:2021-02-25)
(编辑:孙 冰)

