藏紫菀不同溶剂提取物的体外抗氧化活性
赵 彤邵 瑾杨 颖贾正平马慧萍*景临林*
(1.甘肃中医药大学,甘肃 兰州730000; 2.联勤保障部队第九四〇医院药剂科,甘肃 兰州730050;3.兰州大学药学院,甘肃 兰州730000)
生物体内存在氧化与抗氧化平衡系统,当该系统失衡就会产生活性氧,过量的活性氧可能攻击细胞蛋白质、脂质、核酸,导致细胞功能障碍,还能引发氧化应激反应,诱导细胞损伤、阻碍细胞增殖、抑制细胞活力[1⁃2]。研究发现急性高山病、神经退行性疾病、癌症、心血管疾病及炎症等均与氧化应激损伤密切相关[3⁃6]。相关报道指出,抗氧化剂可有效清除体内自由基,消除过量的活性氧,从而达到预防和治疗相关疾病的目的[7]。
藏紫菀是菊科紫菀属植物缘毛紫菀Aster soulieiFranch.的干燥花序,是青藏高原的特有物种,生长在海拔3 000~4 500 m 的高原湿地。作为一种传统藏药,其具有止咳、祛痰、散热、解毒的功效[8]。迄今为止,已有文献报道藏紫菀的主要化学成分包括黄酮和多酚类,如山柰酚、槲皮素等[9⁃10]。课题组前期研究发现藏紫菀的醇提取物具有较好的抗氧化活性[11],本研究将在前期研究的基础上,进一步考察藏紫菀不同极性提取部位的抗氧化活性,以及抗氧化活性与总多酚和总黄酮含量的关系,以期达到初步富集和明确抗氧化活性成分的目的,为进一步分离藏紫菀中的活性成分奠定基础。
1 材料与方法
1.1 样品 藏紫菀购于西宁三江宝商务有限公司(青海西宁),经兰州大学药学院杨永健教授鉴定为正品。保藏号为2014⁃002 的凭证样本存放在生药部的植物标本馆。
1.2 试剂与药物 1,1⁃二苯基⁃2⁃三硝基苯肼(DPPH,批号D9312)、2,2′⁃联氮基双(3⁃乙基苯并噻唑啉⁃6⁃磺酸)二铵盐(ABTS,批号1001393091)、硝基蓝四唑(NBT,批号N6876,日本Sigma 公司);芦丁(批号CHB170303)、没食子酸(批号CHB171107)对照品均购于成都克洛玛生物科技有限公司;还原型辅酶Ⅰ⁃二钠(β⁃NADH,批号N106933)、硫代巴比妥酸(TBA,批号T108505)、2,4,6⁃三吡啶基三嗪(TPTZ,批号T106623)、硝普钠(批号S110755)、萘乙二胺(批号201307251)、对氨基苯磺酰胺(批号S108476)、吩嗪硫酸甲酯(PMS,批号48805)均购于阿拉丁控股集团有限公司;三氯乙酸(TCA,批号149771,成都博瑞特化学技术有限公司);抗坏血酸(批号2016070201,成都市科龙化工试剂厂);磷酸二氢钠(批号20111005,莱阳市双双化工有限公司);磷酸氢二钠(批号20160812,天津市光复科技发展有限公司);盐酸(批号20090818,天津市风船化学试剂科技有限公司)。
1.3 萃取和极性分段 称取干燥的藏紫菀200 g,70%乙醇在室温条件下搅拌6 h,料液比为1 ∶10,重复3 次,合并提取物,滤过,浓缩,得到粗提物(70%乙醇粗提物)。将部分粗提物悬浮在水中,依次用正己烷、乙酸乙酯、正丁醇萃取,各萃取3 次,然后将不同溶剂的萃取物过滤、浓缩,得到正己烷部位(非极性部位)、乙酸乙酯部位(中等极性部位)、正丁醇部位(极性部位)、水提部位(高极性部位)。
1.4 总黄酮和总多酚含量测定 取500 μL 不同浓度提取液于离心管中,加入50 μL 5% NaNO2溶液,混匀,反应5 min后,加入50 μL 10%AlCl3溶液,静置5 min 后,加入250 μL 4%NaOH 溶液,摇匀,在510 nm 波长处测定吸光度,各浓度平行3 次。在同样条件下使用不同浓度芦丁的对照品溶液制备标准曲线,计算藏紫菀不同极性部位总黄酮含量,将其表示为每1 g 提取物的芦丁当量(mg RU/g提取物)。
使用改良的Folin⁃Ciocalteu 方法测定总多酚含量,稍作修改进行测定[12]。在100 μL不同浓度提取液中加 入1.0 mL Folin⁃Ciocalteu 试剂,5 min 后,加入1.0 mL 7.5%NaHCO3溶液,室温下避光放置90 min,在725 nm 波长处测定吸光度,平行3 次。在同样条件下使用不同浓度没食子酸的对照品溶液制备标准曲线,计算藏紫菀不同提取部位总多酚含量,将其表示为每1 g 提取物的没食子酸当量(mg GAE/g 提取物)。
1.5 抗氧化活性测定
1.5.1 DPPH 自由基清除试验 DPPH 测定基于根据文献[13] 的方法,稍作修改。将150 μL 不同浓度提取液加入到150 μL DPPH(0.1 mmol/L)自由基甲醇溶液中。剧烈振摇,在室温下避光孵育30 min,用抗坏血酸(VC)作为阳性对照,使用酶标仪在517 nm 波长处测定吸光度,平行3 次。使用公式[1-(A1-A2)/A0] ×100%计算DPPH 自由基的清除率,式中A0是不加待测液的吸光度值,A1是待测液吸光度值,A2是不加自由基的吸光度值。抗氧化活性表示为EC50(μg/mL),即在517 nm 波长处引起吸光度降低50%所需的样品剂量,较低的EC50值对应较强的抗氧化活性。
1.5.2 ABTS 自由基清除试验 ABTS 自由基清除能力根据文献[14] 描述的方法进行测定。将等体积的ABTS 溶液(7 mmol/L)和过硫酸钾溶液(2.45 mmol/L)均匀混合,在室温条件下避光放置16 h,得到深色溶液,即为ABTS+·贮备液。将100 μL 不同浓度的提取物与3.9 mL ABTS+·工作溶液混合,室温下避光温育10 min 后测定自由基清除活性,以VC作为阳性对照,测量所得溶液在734 nm 波长处的吸光度值(A1)。再用100 μL 蒸馏水代替不同浓度的提取液测定吸光度值(A0),用蒸馏水代替ABTS+·工作溶液测定吸光度值(A2),计算提取物的ABTS+·的清除率,并计算EC50。
1.5.3 羟基自由基清除试验 根据文献[15] 的方法测定提取物的羟自由基清除活性,略有改变。在500 μL 不同浓度提取液中,依次加入100 μL 脱氧核糖[28 mmol/L,溶于pH 7.4 的50 mmol/L 磷酸盐 缓冲液(PBS)],100 μL EDTA(1 mmol/L)、100 μL FeCl3(1 mmol/L)、100 μL H2O2(1 mmol/L)、500 μL H2O,最后加入100 μL Vc 引发反应。在37 ℃下水浴中孵育1 h 后,加入500 μL的10% TCA 终止反应,再加入500 μL 0.5% TBA(溶于50 mmol/L NaOH 水溶液中),在沸水浴中加热30 min 后,冷却至室温,以Vc 作为阳性对照,记录532 nm 波长处的吸光度(A1)。再用500 μL 蒸馏水代替不同浓度的提取液测定吸光度(A0),用PBS 代替脱氧核糖测得吸光度值(A2),计算提取物的羟基自由基清除率、EC50。
1.5.4 超氧阴离子自由基清除试验 根据文献[16] 的方法稍微修改,测定提取物的超氧阴离子清除活性。将100 μL不同浓度的提取液、50 μL NADH 溶液(0.5 mmol/L,溶于0.1 mol/L Tris⁃HCl,pH 8.0)和50 μL NBT(0.2 mmol/L)混合均匀,然后加入50 μL PMS 水溶液(25 μmol/L)。将反应混合物在室温下孵育15 min,以Vc 为阳性对照。在570 nm 波长处测定吸光度(A1),用100 μL 蒸馏水代替提取物溶液测定吸光度(A0),用蒸馏水代替脱氧核糖测定吸光度(A2)。反应混合物的吸光度降低表明超氧阴离子清除活性增加,计算清除率及EC50。
1.5.5 一氧化氮自由基清除试验 根据根据文献[17]的方法略微修改进行测定。将50 μL 各种浓度的提取物加入的50 μL 硝普钠(10 mmol/L,溶解在PBS 中,pH 7.4)中,在室温光照下孵育150 min 后,加入50 μL 0.33%对氨基苯磺酰胺(溶解于20%冰醋酸中),10 min 后加入50 μL 0.1%萘乙二胺盐酸盐,将所得溶液静置30 min,Vc 作为阳性对照,用酶标仪在540 nm 波长处测量吸光度值(A1),用50 μL 蒸馏水代替提取物溶液测得吸光度值(A2),用蒸馏水代替萘乙二胺溶液测得吸光度(A0),计算NO 自由基清除率及EC50。
1.5.6 铁还原/抗氧化能力(FRAP)测定 根据根据文献[18] 的方法计算提取物的还原/抗氧化能力(FRAP)。将25 mL 乙酸盐 缓冲液(0.3 mmol/L,pH 3.6)、2.5 mL TPTZ 溶液(10 mmol/L,溶于40 mmol/L HCl)和2.5 mL FeCl3·6H2O(20 mmol/L)中均匀混合制备新鲜FRAP⁃试剂,使用前加热至37 ℃。将30 μL 不同浓度的提取液加到900 μL FRAP 试剂中,水浴加热30 min,冷却至室温后,在595 nm 波长处测定吸光度。用FeSO4对照品溶液制备标准曲线,提取物的铁还原能力表示为mmol FeSO4/g 提取物。
2 结果
2.1 样品含量分析 本实验先用70%乙醇提取藏紫菀,得到藏紫菀70%乙醇粗提物33.97 g,然后用正己烷、乙酸乙酯、正丁醇依次萃取,分别得到正己烷部位(2.85 g)、乙酸乙酯部位(5.46 g)、正丁醇部位(6.00 g)、水提部位(14.56 g)。以上结果表明,极性化合物是藏紫菀的主要成分,非极性组分的含量非常少,见表1。(51.02±2.39)μg/mL,而正己烷部位和水提部位表现出较弱的清除效果。
表1 不同提取物中总多酚、总黄酮含量测定结果()
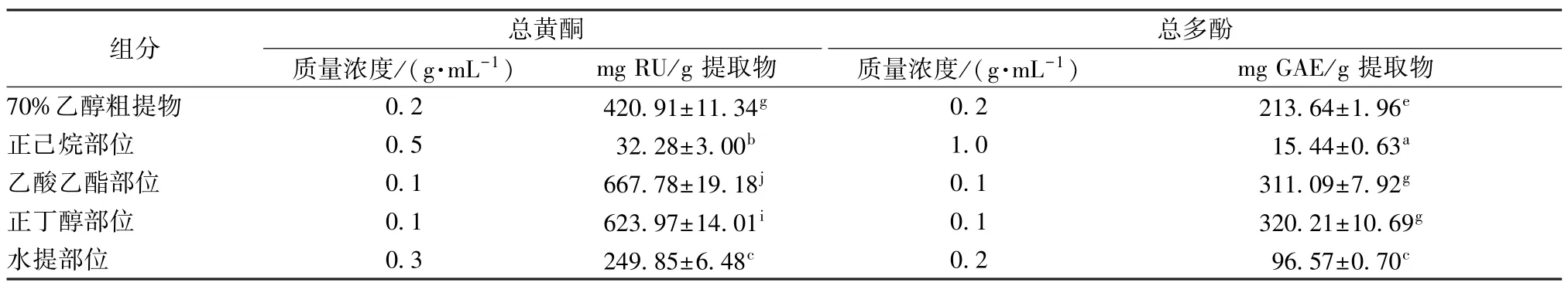
表1 不同提取物中总多酚、总黄酮含量测定结果()
注:同一列中不同上标表示平均值有统计学差异。
表1 显示,正己烷部位中总黄酮和总多酚的含量较低,其原因可能与糖基化酚类化合物在正己烷中的溶解度较小有关。酚类、黄酮类成分大多属于中等极性。Kumkrai等[19]也发现,石竹的乙酸乙酯部分具有最高的总黄酮含量,而水和石油醚部分具有最低总多酚含量。
2.2 清除DPPH 自由基作用 DPPH 是一种稳定的自由基,可以从抗氧化剂中接受电子或氢自由基,形成其非自由基形式DPPH⁃H,使DPPH 溶液的颜色从紫色变为黄色,在517 nm 波长处的吸光度降低[20]。抗氧化剂的DPPH 清除活性反映了其对氢的贡献能力,EC50值越低,DPPH 自由基清除活性越好。图1 显示了不同浓度提取物表现出对DPPH 自由基呈剂量依赖性抑制,表2 显示了藏紫菀粗提取物及不同提取部位对不同自由基的EC50值,其中70%乙醇粗提物的DPPH 自由基EC50为(58.00±2.17)μg/mL,与其相比,乙酸乙酯、正丁醇部位对DPPH 清除效果更好,EC50分别为(35.15±2.46)、(35.94±2.26)μg/mL,而正己烷部位和水提部位对DPPH 清除能力较弱。

图1 藏紫菀不同极性提取物的DPPH 自由基清除活性
2.3 清除ABTS+·作用 在ABTS+·测定中,不同提取部位之间的EC50值显著不同,范围为(49.83±2.66)~(156.89±1.64)μg/mL,见图2、表2。与DPPH 自由基清除试验结果相似,乙酸乙酯、正丁醇部位仍然表现出强于70%乙醇粗提物的清除效果,EC50为(49.83±2.66)、

图2 藏紫菀不同极性提取物的ABTS 自由基清除活性
表2 粗提物和不同极性提取物对不同自由基清除活性的影响()
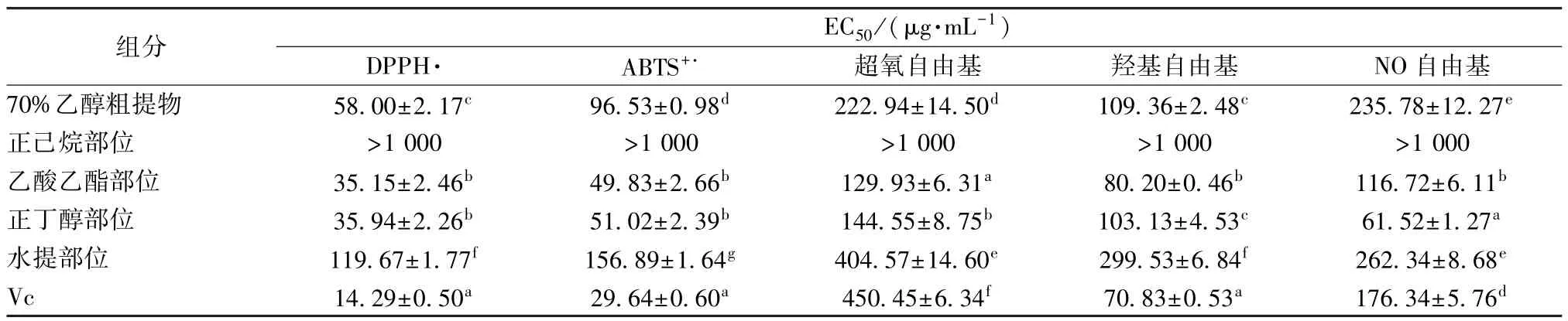
表2 粗提物和不同极性提取物对不同自由基清除活性的影响()
注:同一列中不同上标表示平均值有统计学差异。
2.4 清除·OH 作用 羟基自由基(·OH)被认为是活性氧化物中反应性最强的自由基,可以非特异性地破坏活细胞中几乎所有类别的生物大分子[21]。图3、表2 显示,除正己烷部位外其他提取部位都显示出·OH 清除活性,EC50范围为(80.20±0.46)~(299.53±6.84)μg/mL,但均弱于Vc 清除效果。乙酸乙酯、正丁醇部位有较强的清除效果,EC50分别为(80.20±0.46)、(103.13±4.53)μg/mL,均强于70%乙醇粗提物清除效果。由此推测,·OH 的清除可能是由于提取物中存在供氢能力的酚类化合物。

图3 藏紫菀不同极性提取物的羟基自由基清除活性

图4 藏紫菀不同极性提取物的超氧自由基清除活性
2.6 清除NO 自由基作用 机体产生的NO 是一种必不可少的生物调节分子,具有许多生理功能,如调节血压、传递神经信号、控制血管扩张、松弛平滑肌和影响免疫反应[23]。另一方面,过量浓度的NO 可与反应,形成氧化活性更强的分子——过氧亚硝酸盐(ONOO-),通过攻击脂质,蛋白质和DNA 产生细胞毒素[24]。图5、表2 显示,NO 清除活性与剂量有明显的量效关系。其中70% 乙醇粗提物清除活性低于正丁醇和乙酸乙酯部位,正丁醇部位对NO 具有最高的清除活性,EC50值为(61.52±1.27)μg/mL,乙酸乙酯部位也表现出比Vc 和其他提取部位更高的自由基清除活性。正己烷部位对NO 清除能力最弱。

图5 藏紫菀不同极性提取物的NO 自由基清除活性
2.7 对铁还原抗氧化能力(FRAP)测定 抗氧化剂可以将铁三嘧啶三嗪(Fe3+⁃TPTZ)复合物还原为有色亚铁三吡啶三嗪(Fe2+⁃TPTZ)络合物,最大吸收波长为593 nm[18],吸光度越大,表明铁的总还原能力越强。表3 显示,正丁醇部位对Fe3+还原能力最强,乙酸乙酯部位还原能力也强于70%乙醇粗提物,正己烷部位、水提部位显示出较低的还原能力。
表3 藏紫菀粗提物和不同极性提取物的FRAP 测定()

表3 藏紫菀粗提物和不同极性提取物的FRAP 测定()
注:C 为用于测定FRAP 活性的浓度,同一列中不同上标表示平均值有统计学差异。
2.8 抗氧化活性和化学成分的相关性 多酚和黄酮是与植物提取物抗氧化活性相关的主要生物活性成分[25]。对藏紫菀中总多酚和总黄酮含量与DPPH、ABTS、·、·OH 和NO 自由基清除活性及还原能力进行相关性分析,见表4,可知抗氧化活性与二者含量表现出良好的相关性,进一步表明总黄酮和总多酚是藏紫菀提取物抗氧化活性的成分基础。

表4 抗氧化活性与藏紫菀提取物中总酚类、总黄酮类成分的相关性
3 讨论
抗氧化剂可以通过清除自由基,破坏链式反应,结合金属离子并作为氧清除剂来干扰氧化应激过程,虽然在市场上可购买到数种有效的合成抗氧化剂,但合成氧化剂具有潜在的毒理作用[26]。传统藏药是治疗多种炎症和氧化应激疾病的首选药,高海拔地区生长的植物总是处于氧化应激状态,可以推测这些植物中必然存在某些特征的化学成分,使其生长不会受到干预。Gharibi 等[27]发现从较高海拔采集的植物比从低海拔栽培的植物具有更高的酚类含量和抗氧化活性。较低的温度以及紫外线辐射的增加可导致某些抗氧化剂的生物合成速率增加[28]。
本实验采用6 种不同的抗氧化活性研究方法,对藏紫菀粗提物及不同极性提取部位抗氧化活性进行研究,并将其与总多酚和总黄酮含量进行相关性分析,结果发现,藏紫菀的不同提取部位均具有抗氧化活性。黄酮类和酚类成分是多数天然产物中发挥抗氧化活性的基础,藏紫菀抗氧化活性与其所含的总黄酮和总多酚密切相关,而该两类化合物大多具有酚羟基,显示中等极性,可以与自由基发生结合,体现出较强的抗氧化活性,可以推测乙酸乙酯部位、正丁醇部位中抗氧化的成分基础很可能是黄酮类和酚类。因此,藏紫菀可作为一类潜在的天然抗氧化备用药材,具有极大的开发价值,但其具体抗氧化活性成分及作用机理仍需进一步研究。

