补肾安胎合剂对肾虚流产小鼠EPCs 动员、归巢的影响
江慧敏余欣慧李 赟张源源宣跃廷杨天平
(1.安徽中医药大学,安徽 合肥230000; 2.安徽中医药大学第一附属医院,安徽 合肥230000)
自然流产是指在自然状态下非人为因素发生的流产,目前在我国的发生率为10%~15%,其中早期自然流产(孕周≤12 周)占比达80% 以上[1],严重影响女性身心健康和今后妊娠[2⁃3],其发病机制尚未完全明确,病因复杂多样。目前,母胎界面血管新生障碍是国内外相关研究的焦点,母胎界面血管修复过程(即母胎界面血管重铸)从细胞学角度而言,与血管内皮祖细胞(endothelial progenitor cells,EPCs)的动员、归巢息息相关,可被人体组织器官所释放的生长因子、多种细胞因子和激素等物质所促进。
组织损伤后,血液会释放VEGF、SDF⁃1α 等细胞因子,并通过SDF⁃1α/CXCR⁃4 轴使骨髓造血系EPCs 与骨髓间质细胞脱离,迁移至外周血[4],即SDF⁃1α 参与该动员过程,然后EPCs 顺着其浓度进入损伤部位,完成归巢,表明SDF⁃1α/CXCR⁃4 信号转导通路在胚胎发育、血管发育、心脏发育过程中发挥着关键的作用[5⁃6]。本实验通过监测肾虚流产小鼠EPCs 动员、归巢过程,探究补肾安胎合剂对自然流产的影响。
1 材料
1.1 动物 雌性绿色荧光蛋白(green fluorescent protein,GFP)转基因小鼠6 只(用于活体追踪的活性骨髓来源干细胞),4 周龄,体质量(20±2)g;SPF 级雌性ICR 小鼠100 只(未产),3 周龄,体质量(19±2)g;SPF 级雄性ICR 小鼠50 只,3 周龄,体质量(20±2)g,均由江苏集萃药康生物科技有限公司提供,动物生产许可证号SCXK(苏)2018⁃0008,室内恒定温度23~26 ℃,相对湿度40%~45%,在安徽中医药大学第一附属医院的动物实验中心进行清洁级标准饲养,自由进食饮水,适应性饲养1 周后无异常后开始实验。
1.2 药物 补肾安胎合剂,购自安徽中医药大学第一附属医院(处方组成菟丝子、桑寄生、川断、熟地等,皖药制字BZ20080017);羟基脲,购自齐鲁制药有限公司(国药准字H37021289);米非司酮片,购自安徽中医药大学第一附属医院(国药准字H20033551)。
1.3 试剂 DMEM/F⁃12 培养基、Phsphate Buffered Saline(1×)、MEM/EBSS、改良型RPMI⁃1640 培养基,购自美国Hyclone 公司;胎牛血清(FBS),购自德国Sera&Pro 公司;胰酶Trypsin、DMSO,购自美国Amresco公司;小鼠SDF⁃1α、CXCR4 ELISA 试剂盒,购自上海科顺生物科技有限公司。
1.4 仪器 CO2恒温培养箱,购自日本Sanyo 公司;洁净工作台,购自苏州安泰空气技术有限公司;生物倒置显微镜,购自重庆光电仪器有限公司;倒置荧光显微镜,购自日本Nikon 公司;离心机,购自上海力康生物医疗科技控股有限公司;流式细胞仪,购自美国Beckman 公司;酶标仪,购自美国Bio⁃Rad 公司;水浴锅,购自上海一恒科技有限公司;移液器、排枪,购自德国Eppendorf公司。
2 方法
2.1 模型建立
2.1.1 骨髓移植模型 参考文献[7] 报道。
2.1.1.1 GFP 转基因小鼠骨髓单个核细胞的提取、分离、冻存 取6 周左右供体GFP 小鼠,脱臼处死,70%乙醇浸泡5 min,无菌分离供体鼠的股骨和胫骨,PBS 缓冲液冲洗数次,置于低糖的DMEM中剪碎,反复吹打冲出骨髓,过滤除去组织碎片,离心去上清,加入含10%胎牛血清的DMEM 培养基,调整细胞浓度后接种于培养瓶里。48 h 后换液除去悬浮细胞,每3 d 进行1 次,冻存液将细胞悬浮起来,分装到冻存管,置于液氮罐中保存备用。
2.1.1.2 野生型受体小鼠骨髓移植 采用X 线加速器放射源,对100 只雌性野生型ICR 小鼠全身进行均匀照射,总剂量8.0 Gy,剂量率0.53 Gy/min,放射后2 h 内每只受体鼠尾静脉注射0.1 mL“2.1.1.1”项下单个核细胞悬液。小鼠骨髓重建4周后断尾取血,保存于肝素钠采血管中,EDTA 抗凝,样品在4 ℃冰箱中保存,24 h 内用流式细胞仪测定骨髓中GFP 阳性细胞比例,以判断造模成功与否。
2.1.2 肾虚流产模型 参考文献[8⁃9] 报道。将“2.1.1.2”项下造模成功的雌性小鼠与同种雄性小鼠合笼交配,建立正常妊娠模型,以检出阴栓者或雌性小鼠阴道内见精子者为妊娠第0 天。在妊娠第1~9 天,雌性小鼠灌胃给予450 mg/kg 羟基脲进行造模,在妊娠第10 天上午灌胃给予4.0 mg/kg米非司酮,以复制肾虚流产模型。
2.2 分组与给药 将40 只“2.1.1.2”项下造模成功、GFP 标记的骨髓移植雌性小鼠随机分为4组,分别为模型组及中药低、中、高剂量组,每组10 只,另取10 只GFP 标记的骨髓移植正常小鼠作为空白组,依据体表面积计算法、补肾安胎合剂临床应用剂量换算成小鼠给药剂量。模型组及中药低、中、高剂量组小鼠分别灌胃给予生理盐水及3.0、6.0、12.0 g/kg 补肾安胎合剂,而空白组小鼠灌胃给予生理盐水,各组均连续给药4 周。
2.3 小鼠胚胎丢失率检测 剖视小鼠子宫,观察胚胎丢失情况,计算胚胎丢失率,公式为丢失率=[丢失胚胎数/(丢失胚胎数+存活胚胎数)]×100%。
2.4 EPCs 数量检测 处死小鼠,浸泡于75%乙醇中消毒,在超净台上无菌分离双侧股骨和胫骨,浸泡于PBS 缓冲液中,反复冲洗骨髓腔,制备骨髓单个核细胞悬液,采用流式细胞术检测。采集经肝素钠抗凝的外周血,直接采用流式细胞术检测。蜕膜组织用PBS 缓冲液冲洗数次,制备单细胞悬液后,经流式细胞仪检测GFP、Flk⁃1、Sca⁃1 阳性细胞占单核细胞的比例,通过Cell Quest 软件分析单个核细胞中GFP+/Flk⁃1+/Sca⁃1+的EPCs 占比。
2.5 外周血SDF⁃1α 水平及蜕膜组织CXCR⁃4 表达检测 小鼠外周血离心后取上清液,采用ELISA法检测SDF⁃1α 水平。将蜕膜组织制成混悬液后,采用ELISA 法检测蜕膜组织CXCR⁃4 表达。
2.6 统计学分析 通过SPSS 21.0 软件进行处理,计量资料以()表示,所有数据均先进行正态性检验,2 组间比较采取独立样本t检验,3 组及3组以上之间比较采取方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 GFP 骨髓嵌合率检测 如图1 所示,小鼠骨髓单个核细胞的GFP 阳性率为94.2%。骨髓移植后,小鼠死亡6 只,采用流式细胞仪测定其骨髓中GFP 阳性细胞比例,发现44 只造模失败,50 只造模成功,成功率为53.2%。
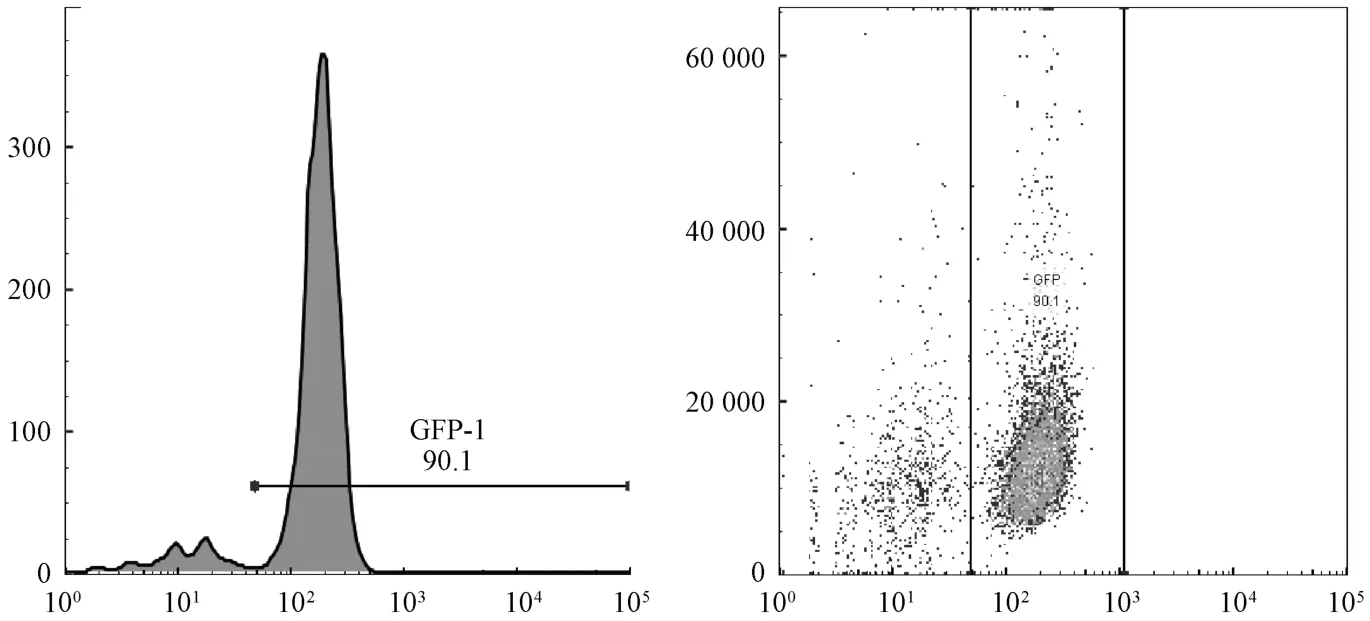
图1 骨髓移植小鼠GFP 阳性率Fig.1 GFP positive rates in bone marrow transplantation mice
3.2 小鼠胚胎丢失率 如表1 所示,空白组小鼠胚胎丢失率低于模型组、中药低剂量组(P<0.01);模型组小鼠胚胎丢失率高于中药各剂量组(P<0.05,P<0.01);与中药高剂量组比较,中药低剂量组小鼠胚胎丢失率升高(P<0.05);与中药低剂量组比较,中药中剂量组小鼠胚胎丢失率降低(P<0.05)。
表1 各组小鼠流产率及胚胎丢失率比较(, n=10)Tab.1 Comparison of abortion rates and embryo loss rates of mice among various groups(, n =10)

表1 各组小鼠流产率及胚胎丢失率比较(, n=10)Tab.1 Comparison of abortion rates and embryo loss rates of mice among various groups(, n =10)
注:与空白组比较,■■P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01;与中药高剂量组比较,●P <0.05;与中药低剂量组比较,★P<0.05。
3.3 小鼠骨髓EPCs 数量 如表2、图2 所示,与空白组比较,模型组、中药各剂量组小鼠骨髓EPCs 数量降低(P<0.01);与模型组比较,中药高剂量组小鼠骨髓EPCs 数量升高(P<0.01);与中药高剂量组比较,中药中、低剂量组小鼠骨髓EPCs 数量降低(P<0.01)。
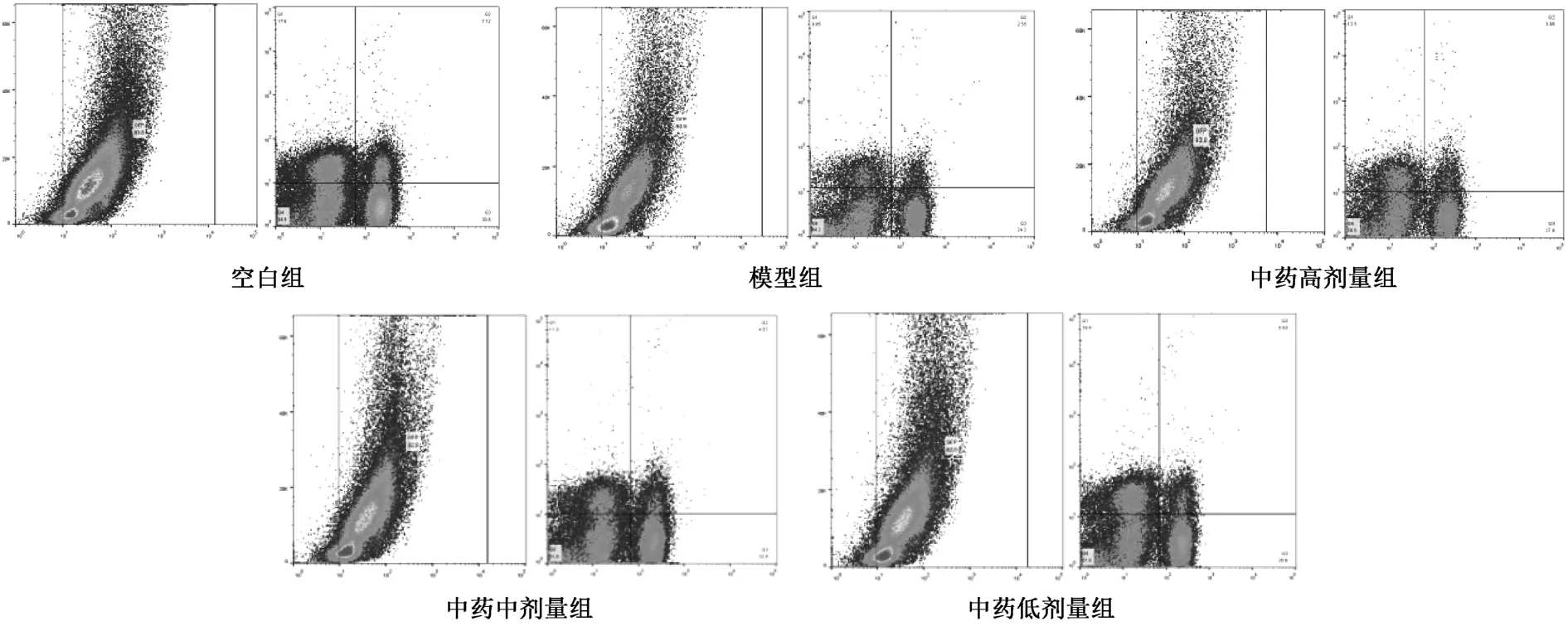
图2 小鼠骨髓流式细胞检测Fig.2 Detection of bone marrow of mice by flow cytometry
表2 各组小鼠骨髓EPCs 数量比较(, n=10)Tab.2 Comparison of EPCs counts in bone marrow of mice among various groups(, n=10)
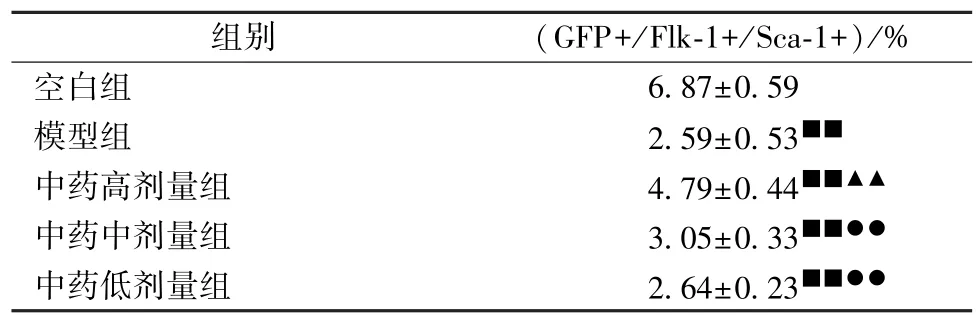
表2 各组小鼠骨髓EPCs 数量比较(, n=10)Tab.2 Comparison of EPCs counts in bone marrow of mice among various groups(, n=10)
注:与空白组比较,■■P<0.01;与模型组比较,▲▲P<0.01;与中药高剂量组比较,●●P<0.01。
3.4 小鼠外周血EPCs 数量 如表3 所示,与空白组比较,模型组、中药各剂量组小鼠外周血EPCs 数量降低(P<0.05,P<0.01);与模型组比较,中药各剂量组小鼠外周血EPCs 数量升高(P<0.01)。
表3 各组小鼠外周血EPCs 数量比较(, n=10)Tab.3 Comparison of EPCs counts in peripheral blood of mice among various groups(, n=10)

表3 各组小鼠外周血EPCs 数量比较(, n=10)Tab.3 Comparison of EPCs counts in peripheral blood of mice among various groups(, n=10)
注:与空白组比较,■P <0.05,■■P <0.01;与模型组比较,▲▲P<0.01。
3.5 小鼠蜕膜组织EPCs 数量 如表4 所示,与空白组比较,模型组、中药各剂量组小鼠蜕膜组织EPCs 数量降低(P<0.01);与模型组比较,中药各剂量组小鼠蜕膜组织EPCs 数量升高(P<0.05,P<0.01);与中药高剂量组比较,中药低、中剂量组小鼠蜕膜组织EPCs 数量降低(P<0.05,P<0.01);与中药低剂量组比较,中药中剂量组小鼠蜕膜组织EPCs 数量升高(P<0.05)。
表4 各组小鼠蜕膜组织EPCs 数量比较(, n=10)Tab.4 Comparison of EPCs counts in decidual tissue of mice among various groups(, n=10)

表4 各组小鼠蜕膜组织EPCs 数量比较(, n=10)Tab.4 Comparison of EPCs counts in decidual tissue of mice among various groups(, n=10)
注:与空白组比较,■■P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01;与中药高剂量组比较,●P<0.05,●●P<0.01;与中药低剂量组比较,★P<0.05。
3.6 小鼠外周血SDF⁃1α 水平、蜕膜组织CXCR⁃4表达 如图3 所示,空白组小鼠外周血SDF⁃1α 水平高于模型组及中药低、中剂量组(P<0.05,P<0.01);模型组小鼠外周血SDF⁃1α 水平低于中药各剂量组(P<0.01);中药低剂量组小鼠外周血SDF⁃1α 水平低于中药中、高剂量组(P<0.05)。与空白组比较,模型组小鼠蜕膜组织CXCR⁃4 表达低于中药各剂量组(P<0.01);与模型组比较,中药各剂量组小鼠蜕膜组织CXCR⁃4 表达升高(P<0.05,P<0.01)。
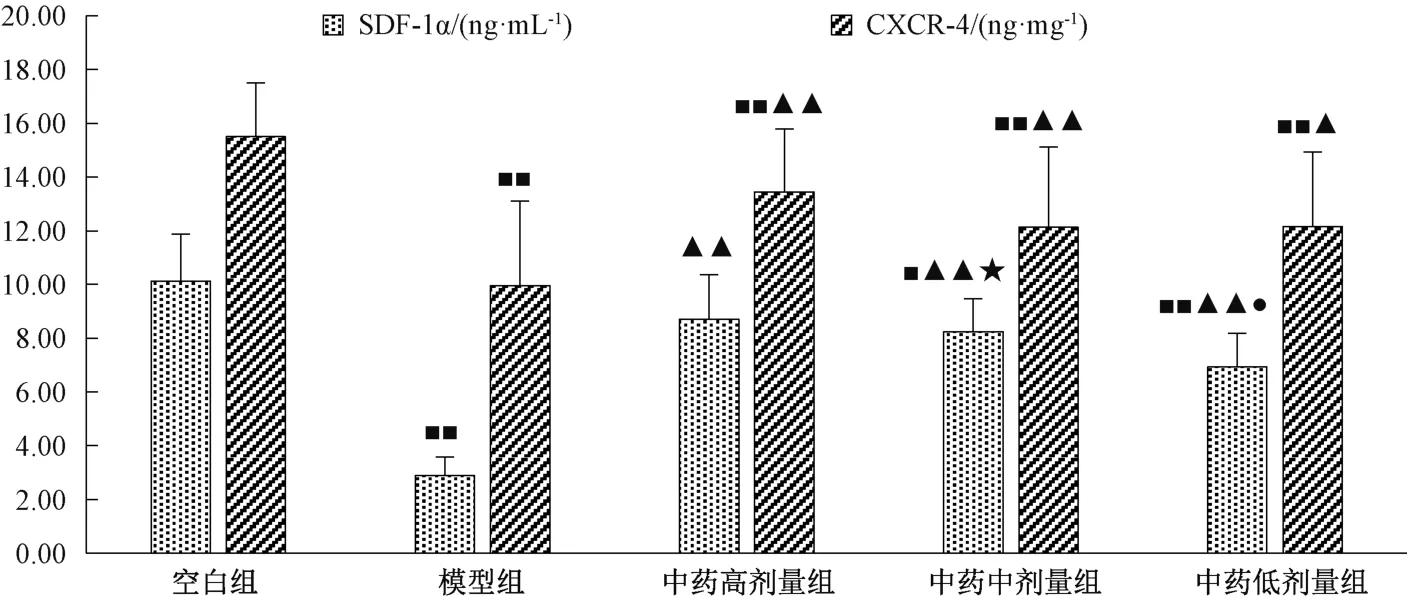
图3 各组小鼠外周血SDF⁃1α 水平、蜕膜组织CXCR⁃4 表达Fig.3 SDF⁃1α levels in peripheral blood and CXCR⁃4 expressions in decidual tissue of mice in various groups
4 讨论
自然流产在中医角度属“胎漏”“胎动不安”“滑胎”“堕胎”“小产”范畴。历代医家多认为该病以肾虚为本,加之后天外感六淫,内伤七情等病因多造成脾的功能失司。肾气不足,不能维系胞脉,以致胎失所系;脾气亏虚,不能充养胞脉,以致胎失所养,二者相互影响,导致胎元不固。因此胞胎难以维系在于脾肾不足所致胞脉不系不充之病。胞脉为隶属于胞宫之血脉,胞络为络属于胞宫的脉络,胞宫通过胞脉、胞络与其他脏腑相联系,它们将汇聚于冲任二脉的阴血下注与胞宫,并与足少阴肾经发生经络上的联系。胞脉是络脉的组成部分,络脉将一身气血灌溉到脏腑组织内,是维持人体生命活动、保持内环境稳定的网络结构[10]。中医的络脉较西医的血管功能更甚,络脉之血络的功能与西医微血管类似。因此,从血管角度研究中医药防治自然流产成为目前的研究热点。
从现代医学角度,由血管新生促进的母胎界面血管重铸是妊娠维持的关键[11]。EPCs 在维持母体血管系统功能稳定及子宫胎盘形成过程中发挥重要作用,其可以通过动员、归巢影响自然流产母胎界面血管重铸[12]。在生理状态下,骨髓EPCs 处于静息状态。当存在各种外源性或内源性因素干预骨髓局部的微环境时,会诱导干细胞穿过窦状内皮离开骨髓进入血流。该动员过程,将EPCs 由骨髓转移至外周血,增强代偿性血管重建。研究表明,外周中SDF⁃1α表达上调可诱导EPCs动员[13⁃14]。当EPCs 动员到外周循环血中后,血管损伤部位产生释放趋化因子如VEGF、SDF⁃1α,分别与EPCs 表面表达的受体VEGFR⁃2 及CXCR⁃4 相结合,EPCs顺趋化因子梯度浓度趋化到内皮损伤部位或组织缺血部位;趋化过程完成后,EPCs 迁移至内皮细胞表面,侵袭入内皮下基质完成内皮修复。由此可见,SDF⁃1a 诱导的EPCs 动员和归巢可能在母胎界面血管重铸过程中扮演了重要角色。
补肾安胎合剂是我院的院内制剂,为寿胎丸加减而成,具有补肾健脾、益气安胎的作用,唯有肾气足、脾气充方能使冲任汇聚精血于胞宫、胞脉,使胎元稳固,与现代医学中,促进母胎界面血管生成有异曲同工之妙。我们既往已有制备肾虚流产模型进行研究,结果显示流产大鼠母胎界面胰岛素样生长因子⁃1(IGF⁃1)与血管内皮因子VEGF 表达呈正相关,补肾安胎冲剂可以上调肾虚流产大鼠蜕膜IGF⁃1 和VEGF 表达[15]。郝乐乐等[16]通过复制正常妊娠模型、复发性流产模型后进行分组研究,结果显示补肾安胎冲剂可通过调控VHL/HIF⁃1α 信号通路改善复发性流产小鼠母胎界面血管生成,从而降低流产率。本实验在既往研究基础上,着重对内皮祖细胞动员、归巢的研究,由实验结果可知:补肾安胎合剂可提高骨髓、外周血、蜕膜组织中EPCs 数目,其可能的机制与上调外周血SDF⁃1α水平与蜕膜组织中CXCR⁃4 表达有关。即补肾安胎合剂可通过促进骨髓EPCs 的动员、诱导EPCs 归巢至母胎界面缺血部位,从而起到防治流产的发生,验证了中医“胞脉系于肾”“肾主骨生髓”、自然流产“从脾肾论治”的科学内涵。

