猫须草水提物对痛风性肾病大鼠肾脏URAT1、OAT1 及病理的影响
符静泉郭 为韦曼莉赵凯丽蒋伟哲*付书婕*
(1.广西医科大学药学院,广西 南宁530021; 2.南宁市卫生学校,广西 南宁530007; 3.广西医科大学玉林校区,广西 玉林537000)
随着人们生活水平不断提高,痛风发生率逐渐上升,其临床表现通常有急性期、间歇期、慢性期、肾脏病变期,其中痛风性肾病的严重程度,防治不容小觑[1]。目前,治疗痛风的西药不良反应较多,故对中药的相关研究成为热点[2⁃3]。
猫须草是一种药食两用的传统中草药,广泛分布于中国、印度、马来西亚、澳大利亚的热带地区和亚热带地区,其抗痛风作用广为人知,包括利尿、排尿酸、抗肾结石、抗炎、镇痛[4],也可用于肝硬化、草酸钙结石、肾炎、糖尿病等疾病的治疗[5⁃7],但作用机制尚未明确。迄今为止,尚未见关于猫须草水提物对痛风性肾病大鼠尿酸盐转运体及有机阴离子转运体(organic anion transporter,OATs 家族)表达影响的报道,故本实验采用酵母粉+腺嘌呤致痛风性肾病大鼠模型,探讨猫须草水提物对其肾组织尿酸盐转运体1(urate transporter,URAT1)、有机阴离子转运蛋白1(organic anion transporter 1,OAT1)蛋白表达及病理的影响,以期为该药材临床应用及进一步推广提供实验依据。
1 材料
1.1 动物 SPF 级SD 雄性大鼠60 只,体质量180~220 g,购自广西医科大学实验动物中心,实验动物使用许可证号SYXK(桂)2014⁃0003。
1.2 药材、试剂与药物 猫须草购自南宁市生源中药饮片有限责任公司(产地广西壮族自治区北海市合浦县),经广西中医药研究院赖茂祥研究员鉴定为唇形科肾茶属植物猫须草Clerodendranthus spicatus(Thunb.)C.Y.Wu ex H.W.Li 的地上部分(茎枝、叶、花序)。别嘌醇片(广东彼得药业有限公司,批号20130803)。腺嘌呤(上海源叶生物科技有限公司,批号XJ0606MA14);酵母粉(广西湘桂酵母科技有限公司,批号P20140912);尿素氮检测试剂盒(南京建成生物工程研究所,批号20150512);rabbit anti⁃oat⁃1(货号bs⁃0607r)、rabbit anti⁃urat⁃1(货号bs⁃0603r)(北京博奥森生物技术有限公司);PBS 缓冲液(武汉博士德生物工程有限公司)。甲醇(上海鑫达精细化工有限公司);dd H2O(广西医科大学科学实验中心);无水乙醇(成都市科龙化工试剂厂)。
1.3 仪器 Micro CL17R 型高速低温离心机[赛默飞世尔科技(中国)有限公司];日立7100 全自动生化分析仪(日本日立公司);EL602 电子天平(百分之一)、EL204 电子天平(万分之一)[梅特勒⁃托利多仪器(上海)有限公司];1334 无菌操作台(长沙米淇仪器设备有限公司);202⁃4电热恒温干燥箱(上海跃进医疗器械厂);UPT⁃Ⅱ⁃20T 超纯水器(成都超纯科技有限公司);1512石蜡切片机(德国Leitz 公司);2BE⁃70⁃35 实验室制冰机(德国Zigera 公司);MDF⁃U4086S 超低温冰箱(日本Sanyo 公司);BX40 显微镜(日本Olympus公司)。
2 方法
2.1 猫须草水提物制备 将干燥药材粉碎得粗粉,称取250 g,加10 倍量蒸馏水,100 ℃水浴回流3次,每次1 h,合并滤液,减压浓缩至膏状,浓缩液转移至蒸发皿内,置于80 ℃电热恒温干燥箱中干燥,即得,质量为14.533 g,得率为5.81%,再用蒸馏水将其制成灌胃给药液。
2.2 造模 将促进尿酸生成的尿酸前体物质(黄嘌呤氧化酶)酵母粉和抑制尿酸排泄的腺嘌呤联合应用,以建立痛风性肾病大鼠模型[8⁃9]。造模组大鼠每天上午灌胃给予腺嘌呤混悬液(100 mg/kg)1 次,同时给予混合酵母干粉的大鼠粗粉饲料(酵母干粉含量为10%),尽量控制酵母摄入剂量为10 g/kg,而空白组大鼠仅给予普通颗粒饲料,2 组均自由摄食饮水。
2.3 分组与给药 采用区组随机分组法,将60 只大鼠按体质量随机分为6 组,分别为空白组,模型组,猫须草水提物高、中、低剂量组,别嘌醇组,每组10 只,适应性饲养1 周。除空白组外,各组大鼠于每天上午固定时间给予酵母饲料,同时给予腺嘌呤混悬液造模,再于下午固定时间灌胃给药,剂量分别为猫须草水提物高剂量组6 000 mg/kg、猫须草水提物中剂量组3 000 mg/kg、猫须草水提物低剂量组1 500 mg/kg、别嘌醇组5 mg/kg,连续30 d。
2.4 一般情况观察 实验期间每天观察各组大鼠毛色、神态、摄食量、进水量、尿量、行为活动度等一般情况,并于0(给药前)、5、10、15、20、25、25、30 d 观察其体质量变化情况。
2.5 大鼠血清尿酸(SUA)、血清肌酐(SCr)、尿素氮(BUN)水平检测 末次给药3 h 后,10%水合氯醛麻醉大鼠,腹主动脉采血,室温下自然凝血1 h,3 500×g离心10 min,分离血清,生化分析仪检测SUA、SCr 水平,试剂盒检测BUN 水平。
2.6 大鼠尿尿酸(UUA)、尿肌酐(UCr)水平及24 h 尿液排泄量、尿酸分级排泄率检测 实验结束前1 d,各组大鼠上代谢笼收集24 h 尿液,测量24 h 尿液排泄量并观察其颜色,生化分析仪检测UUA、UCr 水平。尿酸分级排泄率= [(UUA×SCr)/(SUA×UCr)] ×100%。
2.7 大鼠肾组织病理学观察 大鼠腹主动脉采血后,置于冰台上迅速取出右肾组织,10%中性福尔马林溶液固定,石蜡包埋、切片(厚度4~6 μm),65 ℃烤片,HE 染色,在光学显微镜(×200)下观察其病理变化。
2.8 大鼠肾组织URAT1、OAT1 蛋白表达检测采用链霉素抗生物素蛋白⁃过氧化酶法(SP 法)。大鼠肾组织取材、石蜡包埋、切片、脱水后,3%H2O2去离子水孵育10 min 以阻断内源性过氧化物酶,高压抗原修复后自然冷却至室温,10%山羊血清封闭,在湿盒中室温孵育20 min,URAT1 抗体按1 ∶400 比例、OAT1 抗体按1 ∶800 比例配成工作液,滴加一抗工作液50 μL,置于4 ℃冰箱中过夜,复温后PBS 缓冲液冲洗2~3 次,滴加二抗50 μL,在湿盒中室温孵育30 min,滴加SP 溶液50 μL,室温孵育30 min,滴加新鲜配制的DAB 液显色,在显微镜下控制显色,苏木素复染细胞核,梯度乙醇脱水,透明,中性树胶封片,在光学显微镜下观察。采用Q550CW 计算机图像分析系统进行分析,高倍视野(×200)拍照,再通过Image Pro Plus 软件测量窗口区域内的阳性总面积和灰度值(IOD),取平均值。
2.9 统计学分析 通过SPSS16.0 软件进行处理,结果以()表示,多组间计量资料比较采用单因素方差分析(one⁃way ANOVA),2 组间均数比较采用t检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 大鼠一般情况 在整个实验进程中,空白组大鼠精神和食欲良好,反应灵敏,体毛光泽度理想,体质量逐渐递增,尿量、尿液颜色均正常;与空白组比较,模型组大鼠逐渐出现食欲不振、精神萎靡、少动、畏寒拱背、皮毛干枯、体质量逐渐下降等症状,在第22、26 天各有1 只死亡,解剖后发现两者均表现为肾脏明显肿大,表面大片白斑,呈红白相间状态,推测可能为急性肾功能衰竭致死;猫须草水提物各剂量组、别嘌醇组均能不同程度地改善大鼠异常变化,减轻其肾脏病理性改变。
3.2 猫须草水提物对痛风性肾病大鼠体质量的影响 由表1 可知,模型组大鼠体质量减轻,进食量低于空白组,在10 d 后更明显,导致其体质量增量低于空白组(P<0.01);猫须草水提物各剂量组、别嘌醇组大鼠体质量增量虽低于空白组,但均高于模型组(P<0.01)。
表1 猫须草水提物对痛风性肾病大鼠体质量的影响(, n=10)Tab.1 Effect of aqueous extract of O.stamineus on body weight of rats with gouty nephropathy(, n =10)

表1 猫须草水提物对痛风性肾病大鼠体质量的影响(, n=10)Tab.1 Effect of aqueous extract of O.stamineus on body weight of rats with gouty nephropathy(, n =10)
注:与空白组比较,△△P<0.01;与模型组比较,▲▲P<0.01。
3.3 猫须草水提物对痛风性肾病大鼠SUA、SCr、BUN 水平的影响 由表2 可知,与空白组比较,模型组大鼠SUA、SCr、BUN水平升高(P<0.01);与模型组比较,猫须草水提物高、中剂量组和别嘌醇组大鼠SUA 水平降低(P<0.01),猫须草水提物各剂量组、别嘌醇组大鼠SCr 水平降低(P<0.05,P<0.01);猫须草水提物高、中剂量组和别嘌醇组大鼠BUN 水平降低(P<0.05,P<0.01)。
表2 猫须草水提物对痛风性肾病大鼠SUA、SCr、BUN 水平的影响(, n=10)Tab.2 Effects of aqueous extract of O.stamineus on SUA,SCr and BUN levels in rats with gouty nephropath(, n=10)

表2 猫须草水提物对痛风性肾病大鼠SUA、SCr、BUN 水平的影响(, n=10)Tab.2 Effects of aqueous extract of O.stamineus on SUA,SCr and BUN levels in rats with gouty nephropath(, n=10)
注:与空白组比较,△△P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01。
3.4 猫须草水提物对痛风性肾病大鼠24 h UUA、24 h UCr 水平及24 h 尿液排泄量、尿酸分级排泄率的影响 由表3 可知,与空白组比较,模型组大鼠24 h UUA、24 h UCr 水平及尿酸分级排泄率降低(P<0.01),24 h 尿液排泄量升高(P<0.01);与模型组比较,猫须草水提物高、中剂量组及别嘌醇组大鼠24 h UUA、24 h UCr 水平及尿酸分级排泄率升高(P<0.05,P<0.01),猫须草水提物各剂量组大鼠24 h 尿液排泄量高于模型组,而别嘌醇组大鼠更低,但差异均无统计学意义(P>0.05)。
表3 猫须草水提物对痛风性肾病大鼠24 h UUA、24 h UCr 水平及24 h 尿液排泄量、尿酸分级排泄率的影响(, n=10)Tab.3 Effects of aqueous extract of O.stamineus on 24 h UUA and 24 h UCr levels,24 h urine excretion and uric acid frac⁃tional excretion rate of rats with gouty nephropathy(, n=10)
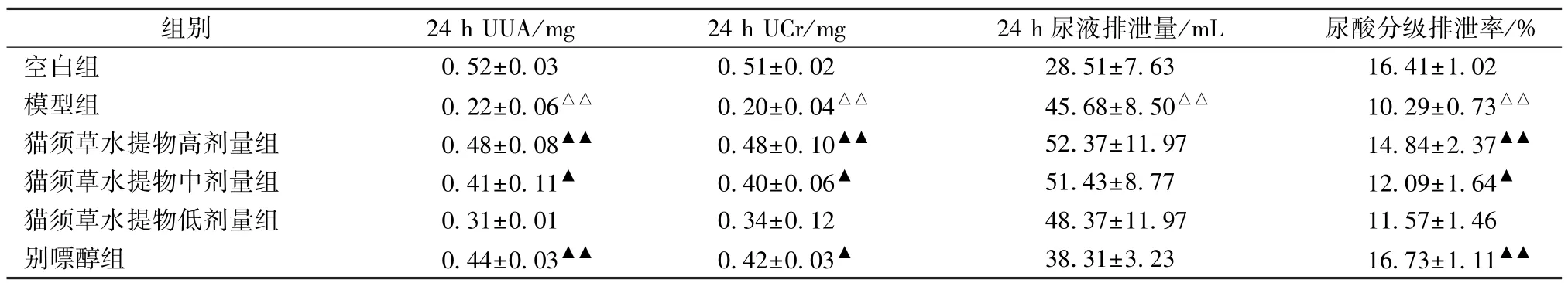
表3 猫须草水提物对痛风性肾病大鼠24 h UUA、24 h UCr 水平及24 h 尿液排泄量、尿酸分级排泄率的影响(, n=10)Tab.3 Effects of aqueous extract of O.stamineus on 24 h UUA and 24 h UCr levels,24 h urine excretion and uric acid frac⁃tional excretion rate of rats with gouty nephropathy(, n=10)
注:与空白组比较,△△P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01。
3.5 大鼠肾组织病理形态学改变 由图1 可知,空白组大鼠肾组织结构正常,未见尿酸盐结晶,炎性细胞极少;模型组大鼠部分肾小球萎缩,肾小管扩张,可见大量尿酸盐结晶沉积,并伴有炎性细胞浸润,个别区域有局灶性纤维化;猫须草水提物各剂量组大鼠均无肾脏尿酸盐结晶,肾组织炎性细胞浸润明显减轻,肾小管扩张和间质纤维化有所改善;别嘌醇组大鼠虽无肾脏尿酸盐结晶,但肾组织的炎性细胞浸润、肾小管扩张、间质纤维等症状仍为严重,与模型组比较改善较小。
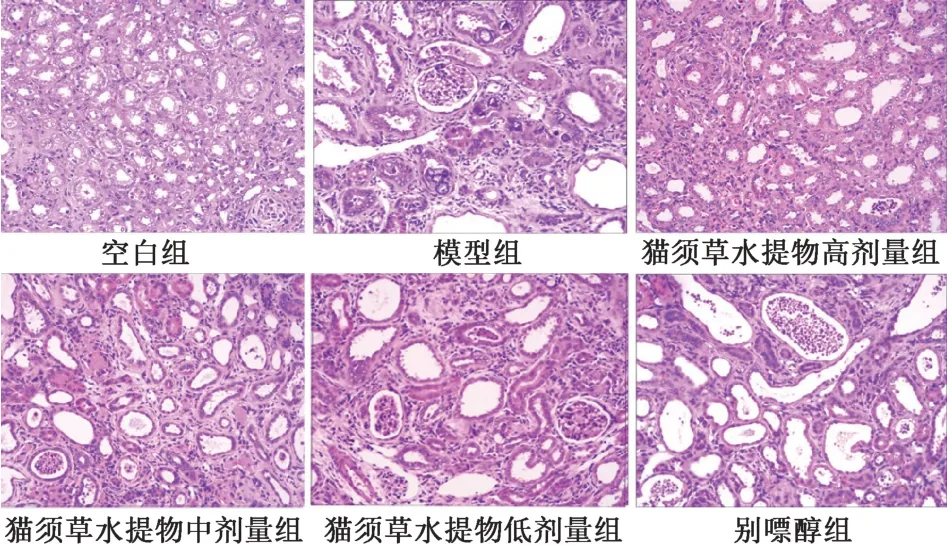
图1 各组大鼠肾组织病理形态学改变(HE,×200)Fig.1 Pathological morphology changes of renal tissues of rats in various groups(HE,×200)
3.6 大鼠肾组织URAT1、OAT1 蛋白表达 由图2、表4 可知,URAT1 蛋白表达于肾脏组织近曲小管上皮细胞刷状缘。其中,空白组大鼠可见淡棕黄色阳性表达,无病理改变;模型组大鼠棕黄色阳性表达面积增多,大部分区域甚至呈深棕色,阳性表达强烈;猫须草水提物高、中剂量组及别嘌醇组大鼠阳性表达面积明显减少,棕黄色变浅,病理改变得到改善。

图2 各组大鼠肾组织URAT1 表达(×200)Fig.2 URAT1 expressions of renal tissues of rats in various groups(×200)
表4 各组大鼠肾组织URAT1 阳性总面积、IOD 值比较(, n=10)Tab.4 Comparision of URAT1 positive total areas and IOD values in renal tissues of rats among various groups(,n=10)

表4 各组大鼠肾组织URAT1 阳性总面积、IOD 值比较(, n=10)Tab.4 Comparision of URAT1 positive total areas and IOD values in renal tissues of rats among various groups(,n=10)
注:与空白组比较,△△P<0.01;与模型组比较,▲▲P<0.01。
由图3、表5 可知,OAT1 蛋白表达在肾近曲小管上皮细胞基底侧膜。其中,空白组大鼠可见深棕黄色阳性表达,无病理改变;模型组大鼠黄色阳性表达面积减少,棕黄色变浅;猫须草水提物高、中剂量组及别嘌醇组大鼠阳性表达面积明显增加,棕黄色变深,病理改变得到改善。
表5 各组大鼠肾组织OAT1 阳性总面积、IOD 值比较(, n=10)Tab.5 Comparision of OAT1 positive total areas and IOD values in renal tissues of rats among various groups(, n =10)
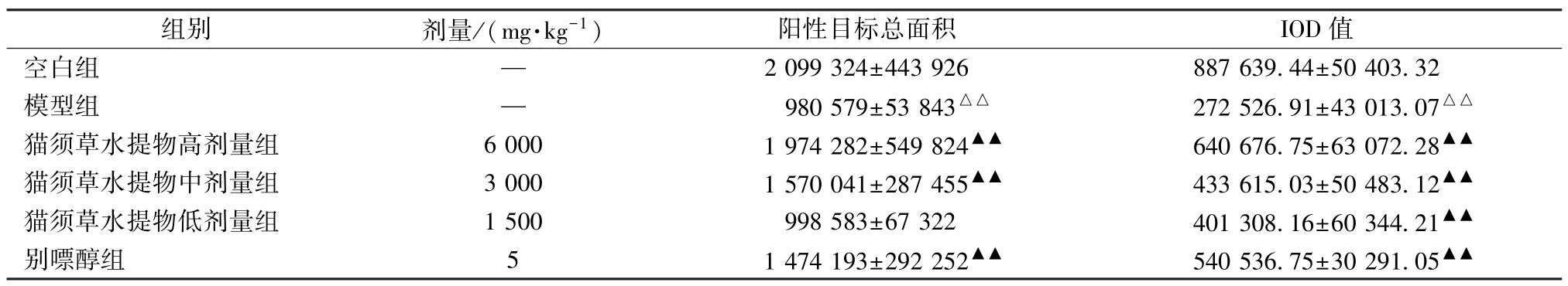
表5 各组大鼠肾组织OAT1 阳性总面积、IOD 值比较(, n=10)Tab.5 Comparision of OAT1 positive total areas and IOD values in renal tissues of rats among various groups(, n =10)
注:与空白组比较,△△P<0.01;与模型组比较,▲▲P<0.01。
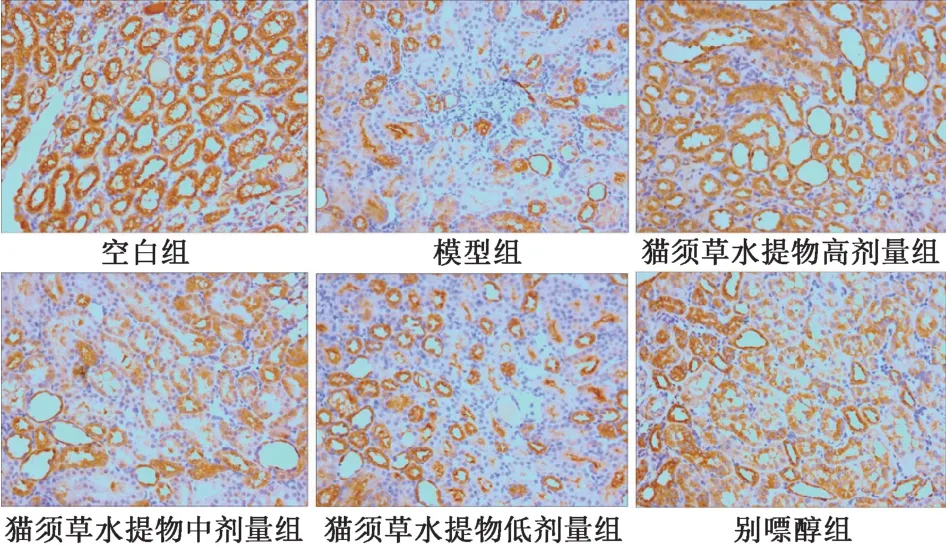
图3 各组大鼠肾组织OAT1 表达(×200)Fig.3 OAT1 expressions of renal tissues of rats in various groups(×200)
4 讨论
腺嘌呤是核酸的主要成分之一,可经黄嘌呤氧化酶的作用转变成尿酸,本实验模型选用腺嘌呤主要是通过增加腺嘌呤摄入使得体内尿酸生成增加,短期内生成尿酸结晶沉积于肾脏,从而引起痛风性肾病。酵母是通过干扰机体正常的嘌呤代谢,使黄嘌呤氧化酶活性增加进而加速尿酸的生成[10⁃11]。单独酵母法造模是接近原发性痛风性肾病的造模,联合腺嘌呤使用能引起肾功能损伤,更接近人类继发性痛风性肾病的发病机理。
肌酐(Cr)是一种小分子终末代谢物,不能与血浆蛋白结合,只有少量经肾小管离子通道排泌,绝大部分肌酐并不被肾小管重吸收,而经肾小球滤过进入原尿。肾小球损伤时,肌酐水平会发生一定变化,故临床上血肌酐常被用于肾功能的测定指标。BUN 是体内氨基酸分解代谢的终产物,可经肾小球滤过。各种肾疾患所致的肾小球病变都可见于BUN 的升高,常与血肌酐综合测定来判断肾小球的滤过功能,是检测肾功能的敏感指标[12⁃13]。本实验的猫须草水提物高、中剂量组降低SUA、SCr 及BUN 水平,特别高剂量组效果优于别嘌醇组。猫须草水提物高、中剂量组亦明显提高痛风性肾病大鼠的24 h UUA、24 h UCr 和FEUA,提示猫须草水提物的降尿酸能力可能与其促进尿酸的排泄有关。
经过腺嘌呤的灌胃,痛风性肾病大鼠的肾脏肿大严重。光镜的病理结果显示,猫须草水提物高、中、低剂量组均可减少肾组织内尿酸结晶沉积,且减轻肾脏组织的炎性细胞浸润及局部病灶纤维化程度,为猫须草水提物治疗痛风性肾病提供了病理形态学依据,特别高剂量组效果远优于别嘌醇组,足以看出猫须草水提物高剂量组对痛风性肾病大鼠的肾脏保护作用。
大约70% 尿酸经肾脏排泄,故肾脏排泄成为研究促尿酸排泄药的重要靶点,近年来尿酸转运蛋白成为了这方面的研究焦点,如URAT1 和有机阴离子转运体。URAT1 由SLC22A1 基因编码,在肾小管上皮细胞刷状缘表达,是肾脏尿酸重吸收的主要转运体[14]。OATs 家族中OAT1 和OAT3 是调节尿酸排泄的重要转运体,而OAT10 负责尿酸的重吸收[15⁃16]。本实验采用免疫组化法检测猫须草水提物对痛风性肾病大鼠的URAT1 及OAT1 的蛋白表达。免疫组化检测结果显示:猫须草水提物高、中剂量组大鼠URAT1 蛋白表达降低而OAT1 蛋白表达升高。
综上所述,猫须草水提物对腺嘌呤和酵母粉所致大鼠痛风性肾病具有良好的治疗作用,其机制可能与上调OAT1 蛋白表达促进尿酸排泄和下调URAT1 蛋白表达抑制尿酸重吸收的双重调节功能有关,具体机制本课题组将作进一步研究。

