双子表面活性剂溶液中大黄蒽醌类化合物与牛血清白蛋白的相互作用
刘凡
(乐山师范学院化学与资源环境学院,四川 乐山614004)
引言
血清白蛋白是具有运输药物分子、维生素、生理激素及电解质功能的生物大分子。血清白蛋白可与进入体内药物分子迅速、可逆地结合,并作为载体将药物运输至治疗靶点而发挥药效,同时血清白蛋白与药物结合力和结合率的差异可使得留存于血浆中的药物含量发生较大幅度的波动,从而影响到药物药效发挥以及治疗结果。因此研究血清白蛋白与药物的相互作用,可以在分子层面认识药物在生物体内的分布、代谢情况以及二者间结合药理、毒理作用机理,为设计、筛选、开发高活性、低毒性的药物分子具有重要理论和实际意义。
大黄为我国传统中医药物,主要包括蒽醌类、鞣质类、多糖类等医用活性化合物80余种,其中大黄蒽醌类化合物(RAA)包含大黄素、大黄酸、芦荟大黄素、大黄素甲醚、大黄酚、异大黄素以及虫漆酸D等[1],这类化合物具有广泛的药理作用,在临床医学上用于对多种疾病的治疗,例如抗病毒[2]、抗菌[3]、抗炎[4]、抗肿瘤[5-9]、降脂降压[10]及药物缓释作用[11-12]等。由于结合后形成的大黄蒽醌类化合物-牛血清白蛋白(RAA-BSA)超分子二元体系不易穿透毛细血管壁、血脑屏障等多种生物膜[13],将影响大黄蒽醌类化合物在生物体内的药理和药效。因此以双子表面活性剂分子聚集形成胶束或囊泡,作为模拟生物膜,研究BSA与RAA的相互作用,探讨BSA与大黄素类药物的结合力和结合率,认识大黄类药物在生物体内的运输、分布、代谢情况,这对提高大黄类药物疗效有极其重要的意义,然而研究RAA与BSA相互作用[13-14]的报道较少。本文在双子表面活性剂胶束模拟生物膜的介质中,应用荧光光谱法和紫外光谱法研究了RAA与BSA的相互作用,结果显示胶束-RAA二元配合物对BSA的内源荧光有更强的猝灭作用,并得到在水和胶束溶液中的结合常数、结合点位数,根据RAA与BSA作用的热力学参数,确定它们之间的作用力主要为静电力和氢键。
1 实验部分
1.1 仪器与试剂
荧光分光光度计(Cary Eclipse型,带恒温装置,美国安捷伦公司),紫外分光光度计(UV2200型,北京瑞利公司),酸度计(pH307型,上海仪电仪器有限责任公司)。
牛血清白蛋白(BSA,上海伯奥生物科技有限责任公司),大黄素、大黄酸、芦荟大黄素(阿拉丁公司),α,δ-丁撑-N,N-二甲基十二烷基溴化铵(C12-C4-C12)、α,ζ-己撑-N,N-二甲基十六烷基溴化铵(C16-C6-C16)(本院合成,经核磁/红外表征),三羟甲基氨基甲烷(Tris),氯化钠、盐酸、氢氧化钠为分析纯,实验用水为超纯水。
1.2 实验方法
在比色皿中依次加入1.50 mL Tris-HCl缓冲溶液,0.20 mL Gemini表面活性剂的水溶液,0.30 mL牛血清白蛋白溶液,再用水稀释至3.00 mL,置于荧光分光光度计内恒温5 min,再加入一定量的RAA的甲醇溶液(≤80μL),以285 nm为激发波长,发射狭缝和激发狭缝均为5 nm,测定该系列溶液的荧光发射光谱图,并测量荧光峰值的荧光强度。
以类似的实验方法测定溶液在波长为295 nm~495 nm范围内的紫外吸收光谱。
2 结果与讨论
2.1 RAA与BSA作用的荧光发射光谱
BSA由于色氨酸、酪氨酸及苯丙氨酸等残基而发射较强的内源荧光。根据相关研究[14-15]表明表面活性剂胶束与BSA中具有内源性荧光的氨基酸残基增溶或结合生成二元复合物,形成“珍珠项链式”结构,使得BSA的荧光强度发生衰减,再加入猝灭剂RAA,研究体系形成三元复合物,体系的荧光强度随猝灭剂浓度的增大而减弱,如图1所示。
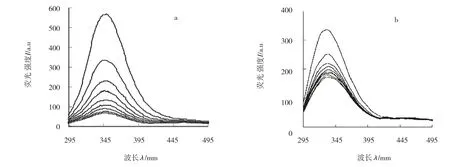
图1 298K时大黄素对BSA荧光光谱的影响(a:水溶液,b:C12-C4-C12溶液)([BSA]=2.5×10-5 mol·L-1,[Emodin]=0,0.33×10-5 mol·L-1,0.67×10-5 mol·L-1,1.00×10-5 mol·L-1,1.33×10-5 mol·L-1,1.67×10-5 mol·L-1,2.00×10-5 mol·L-1,2.33×10-5 mol·L-1,2.67×10-5 mol·L-1,[C12-C4-C12]=1.0×10-3 mol·L-1)
2.2 RAA与BSA作用机理
客体小分子对主体生物大分子荧光猝灭分为两种:其一是由于主客体分子间的碰撞而发生的动态猝灭;其二是大小分子间生成主客体复合物而产生的静态猝灭。如果客体对主体是动态猝灭,则符合Stern-Volmer方程:
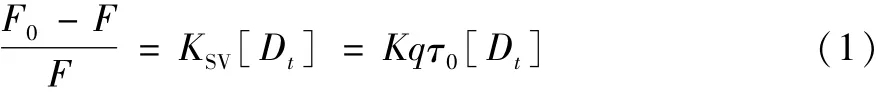
其中F0和F分别为未加入和加入客体的最大荧光强度,Ksv为动态猝灭常数,Kq为猝灭速率常数,τ0为BSA荧光分子平均寿命(×10-8s),Dt为猝灭剂浓度。以(F0-F)/F对Dt作图,得到Sterm-Volmer曲线(图2),通过线性拟合得到值Ksv及Kq值,见表1。
由表1数据表明,在水溶液及胶束溶液中RAA对BSA的碰撞猝灭速率常数(1.26×1012L·mol-1·s-1~6.98×1012L·mol-1·s-1)远大于小分子猝灭剂对生物大分子的最大扩散碰撞猝灭速率常数(2.0×1010L·mol-1·s-1);且在同一溶液中碰撞猝灭速率常数Kq,289k>Kq,310k,即Kq随温度的升高而减小,复合物的稳定性减弱,这两个因素都表明在水溶液或胶束溶液中,RAA对BSA的荧光猝灭不是由分子间碰撞所引起的动态荧光猝灭,而是RAA和BSA结合形成复合物而引起的静态荧光猝灭。SVq

表1 溶液中主客体的动态猝灭常数(K)、散射碰撞猝灭速率常数(K)、结合位点数、结合常数及热力学参数

图2 298K时胶束溶液中大黄酸与BSA作用的Sterm-Volmer曲线

图3 298K胶束溶液中大黄酸与BSA的双对数曲线
2.3 大黄蒽醌类化合物与BSA作用的结合常数、结合位点数与热力学参数A
大黄素、大黄酸、芦荟大黄素对BSA荧光猝灭是两者形成主客体复合物的静态猝灭,即遵循Lineweaver-Burk方程:
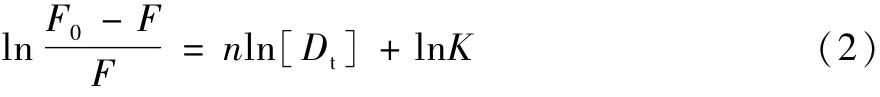
其中:n为客体和BSA的结合位点数,Ka为结合常数,以对ln[Dt]作图(图3)(r≥0.9950),即可获得n值和Ka值(表1)。大黄素、大黄酸、芦荟大黄素3个客体与BSA的结合位点数约为1,而复合物的结合常数Ka>104,其复合物结合稳定。对于同一条件下,复合物的Ka,水>Ka,胶束,这是因为BSA的氨基酸残基和客体都可以增溶于胶束的胶核内,限制了主客体之间的结合;而胶束间存在的静电排斥力,进一步使得主客体间的结合更加困难,这二者的叠加使Ka,水>Ka,胶束。C12-C4-C12和C16-C6-C16胶束溶液结构及性质基本相似,疏水链和链接基的长度对于复合物的结合常数影响较小,因此Ka值变化较小。

图4 芦荟大黄素与BSA作用的同步荧光(a、c(Δλ=60 nm),b、d(Δλ=15 nm);a、b-水溶液,c、d-C12-C4-C12)([Alone-emodin]=0,0.33 mol·L-1,0.67 mol·L-1,1.00 mol·L-1,1.33 mol·L-1,1.67 mol·L-1,2.00×10-5 mol·L-1,[BSA]=2.50×10-6 mol·L-1,pH=7.20,298 K)
依据Ross总结的小分子与生物大分子结合力的热力学规律:△H<0,△S>0为静电力;△H<0,△S<0为分子间力及氢键;△H>0,△S>0主要为疏水作用力[17]。根据所计算的主客体结合的热力学参数(见表1),△G<0,因此主客体间的结合是一个自发过程;而△S>0,△H<0,可以认为研究体系分子间主要作用为静电力,同时客体分子有多个羟基或羧基,RAA可以和BSA间存在氢键作用。
2.4 RAA与BSA作用的同步荧光
在BSA浓度固定为2.5×10-6mol·L-1时,随RAA浓度的增加,在最大发射波长处的荧光强度逐渐降低(图4)。水溶液和胶束溶液中BSA的酪氨酸残基的特征荧光谱图的峰形由平缓变得尖锐,半峰宽分别为Δλ=30 nm与Δλ=16 nm,荧光强度ΔI水溶液≤ΔI胶束溶液,说明酪氨酸残基增容于疏水性的胶核中,其亲水性降低。而色氨酸残基的最大发射波长都在约280 nm,ΔIΔλ=60nm>ΔIΔλ=15nm,说明BSA的荧光主要来源于色氨酸残基,且色氨酸的特征荧光光谱的峰形在胶束溶液中变得尖锐,半峰宽也变窄,RAA-BSA-胶束形成了三元复合物。而色氨酸残基的荧光强度降低比酪氨酸残基更显著,说明RAA与BSA的结合位点更接近于色氨酸残基。
2.5 结合距离
当荧光主客体分子之间的距离≤7 nm,且其二者的荧光发射光谱与紫外吸收光谱存在较大的重叠时,根据Förster非辐射能量转移理论,两者之间即可发生能量转移[18],其能量效率E、主客体间的能量转移距离r及E=50%时的临界距离R0如下:
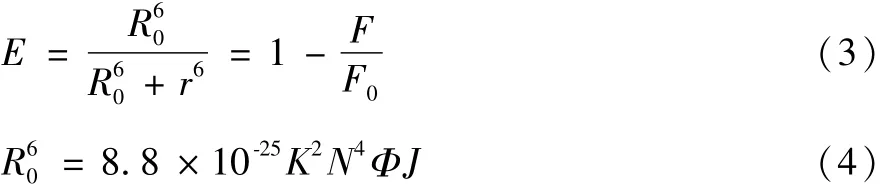
其中:K2为偶极空间取向因子,其值为2/3;N为介质折射指数,其值为1.336;Φ为BSA荧光量子产率,其值为0.118,J为主客体荧光发射光谱与吸收光谱的重叠积分,E为[BSA]∶[RAA]=1∶1时的能量效率。
不论是在水溶液中还是胶束溶液中,实验结果显示主客体之间的荧光发射光谱与吸收光谱都有较大程度的重叠,如图5~图6所示,主客体之间的重叠积分J、临界距离R0及能量转移距离r见表2,表中数据显示r均小于7 nm,符合能量转移理论,说明在该研究实验条件下主客体间由于能量转移使BSA荧光发生猝灭,而且r>R0表明客体对BSA内源荧光的猝灭以静态猝灭为主。在胶束溶液中,客体都可以通过增溶作用或笼效应存在于胶束中,形成的二元复合物的体积大于单一的客体分子的体积,其临界距离R0及能量转移距离r都有所增大,并且胶束体积越大,R0及r值越大,即R0(H2O)<
R0(C12-C4-C12)<R0(C16-C6-C16)。

表2 大黄蒽醌类化合物与BSA上氨基酸残基间的距离r
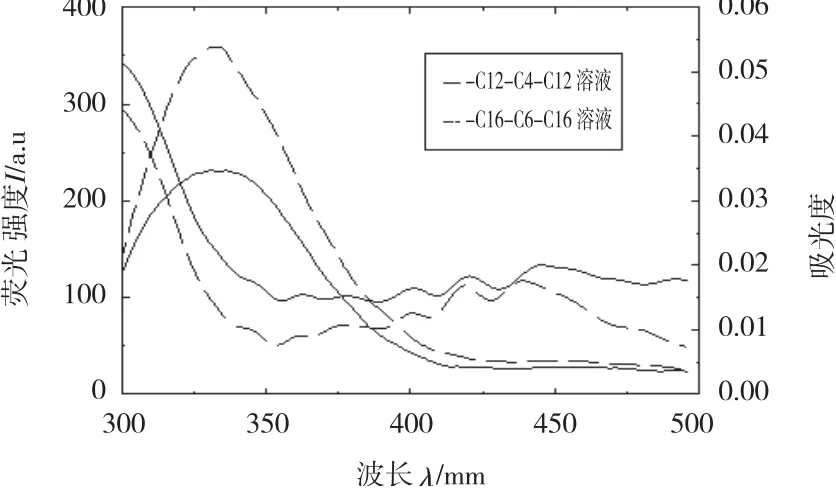
图5 BSA和大黄酸荧光发射光谱与紫外吸收光谱的重叠([BSA]=[Rhein]=2.50×10-6 mol/L)
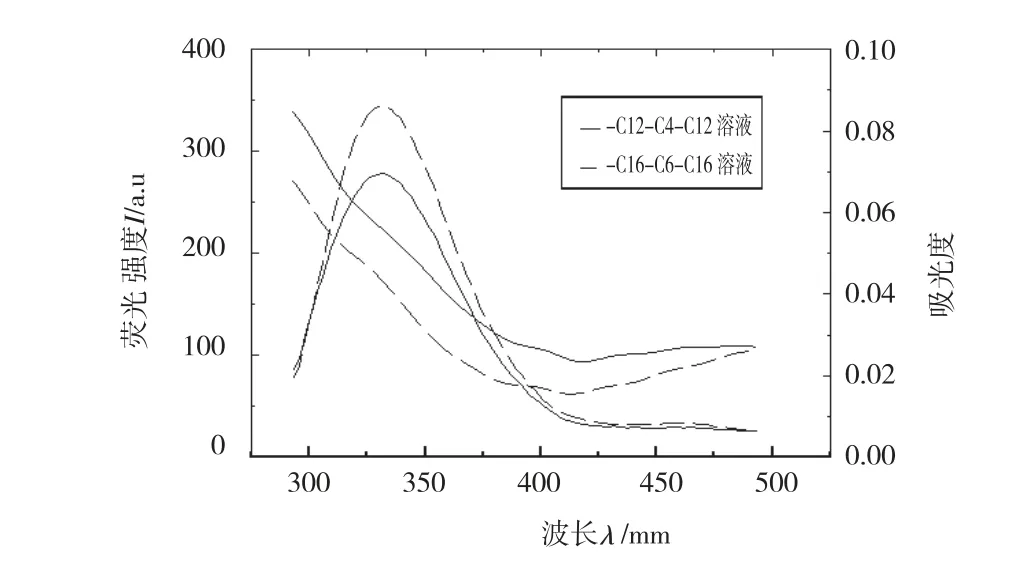
图6 BSA和芦荟大黄酸荧光发射光谱与紫外吸收光谱重叠([BSA]=[Alone-emodinin]=2.50×10-6 mol/L)
3 结论
(1)RAA、BSA及胶束形成的三元复合物使体系的荧光发生静态猝灭,且研究体系分子间的结合是一个自发过程,主要作用为静电力和氢键。
(2)在所研究实验条件下,RAA与BSA的结合位点更接近于色氨酸残基。
(3)在所研究实验条件下,主客体间由于能量转移使BS?A荧光发生猝灭,且客体对BSA内源荧光的猝灭以静态猝灭为主,胶束体积越大,R0及r值越大,即R0(H2O)<R0(C12-C4-C12)<R0(C16-C6-C16)。

