PD-L1在结直肠癌中的表达及其与肿瘤微环境关系的分析*
陈瑞媛,张森,张子涵,李文鑫,廖存
广西医科大学第一附属医院结直肠肛门外科 广西南宁530021
结直肠癌(CRC)是全球范围内常见的恶性肿瘤,死亡率位居恶性肿瘤前列[1]。有学者根据时间和人口分布进行预测认为,2030年CRC的全球负担将增加60%,新发病例将超过220万,死亡病例将达110万[2]。CRC的治疗手段包括手术、放疗、化疗等,对于确诊时无远处转移的患者,手术切除可获得良好的临床疗效,但5年中位总生存率仅为66.4%[3]。近年来,CRC肿瘤细胞与肿瘤微环境(TME)的相互作用逐渐引起国内外研究者关注,通过免疫检查点抑制剂调节免疫系统是一种新兴的治疗方法,细胞程序性死亡受体-1(PD-1)和细胞程序性死亡受体-配体1(PD-L1)是常用靶点[4],其中PD-1抑制剂帕姆单抗(pembrolizumab)已被批准用于治疗微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)的转移性CRC(mCRC)[5]。但抗PD-1/PD-L1免疫治疗仅对2.5%~5%的mCRC患者(MSIH或dMMR)有效,大部分微卫星稳定(MSS)患者对抗PD-1/PD-L1免疫治疗无明显反应[6]。
Chen等[7]的研究结果提示,根据接受PD-1抑制剂治疗患者的临床疗效和免疫表型可以将肿瘤的免疫微环境分为三种基本类型:免疫不敏感型、免疫排斥型和免疫恶化型。基于此分类,PD-1抑制剂的有效性不仅取决于肿瘤内PD-L1的表达,还取决于肿瘤微环境中是否存在足够的免疫效应细胞,其中肿瘤浸润淋巴细胞(TILs)CD4+和CD8+引起了学者们的关注[8]。此外,有研究提示促炎因子肿瘤坏死因子-α(TNF-α)、白介素6(IL-6)可诱导肿瘤细胞PD-L1的表达[9],帮助实现免疫逃逸。本研究旨在探讨CRC患者癌组织PD-L1的表达及其与肿瘤微环境的关系,现报告如下。
1 资料与方法
1.1 一般资料
选择2019年10月至2020年2月广西医科大学第一附属医院结直肠肛门外科收治的80例CRC患者为研究对象。患者平均年龄(54.4±11.6)岁,其中男性41例、女性39例,结肠癌43例、直肠癌37例,肿瘤病理分期Ⅰ期12例、Ⅱ期32例、Ⅲ期23例、Ⅳ期13例,分化程度为低分化15例、中分化44例、高分化21例。本研究经医院伦理委员会批准实施(2018-KY-国基-141),所有患者均签署知情同意书。
1.2 纳入与排除标准
纳入标准:(1)符合CSCO结直肠癌诊疗指南(2019版)Ⅰ~Ⅳ期诊断标准的患者;(2)初诊患者,并非多原发癌,接受根治性手术,术前未接受新辅助放化疗。排除标准:(1)术后无明确病理结果;(2)临床资料不完整。
1.3 方法
1.3.1 试验取材 于患者入院次日清晨抽取空腹8 h外周静脉血3~5 mL置于5 mLEDTA抗凝管中,用于实验室检测;于手术当日取患者癌组织标本1 cm3并于30 min内以10%甲醛固定,用于病理学检测。
1.3.2 实验方法 (1)免疫组化:将石蜡切片分别经脱蜡、抗原修复、内源性过氧化物酶阻断、封闭、一抗孵育(PD-L1抗体购自T英国Abcam公司,CD4+、CD8+抗体购自北京中杉金桥公司)、二抗孵育、显色、复染、晾干封片等步骤后于显微镜下观察癌组织中PD-L1、CD4+TIL、CD8+TIL表达情况,并以Image Pro Plus软件分析表达量。(2)酶联免疫吸附法:将患者抗凝外周血4 000 r离心5 min取血清,以ELISA试剂盒(购自美国SAB公司)测定外周血清TNF-α、IL-6水平。
1.3.3 临床数据收集 收集患者肿瘤病理分期、分化程度资料。
1.4 观察指标
(1)癌组织中PD-L1的表达情况。将切片分为5个视野,计算平均每个视野阳性细胞比例,按比例高低分为4个等级(自拟),其中:无表达为阴性,表达率<20%为弱阳性,表达率20%~50%为阳性,表达率>50%为强阳性。记录不同等级的占比。(2)分析不同肿瘤病理分期、分化程度结直肠癌的PDL1表达量差异。(3)分析PD-L1不同表达强度的血清TNF-α水平、IL-6水平、癌组织中CD4+TIL表达量、CD8+TIL表达量差异。
1.5 统计学分析
采用SPSS 25.0软件进行统计分析。计量资料以M(QL,QU)表示,采用非参数检验比较。以P<0.05为差异有统计学意义。
2 结果
2.1 癌组织中PD-L 1的总体表达情况
在80例癌组织标本中,PD-L1阴性表达24例(30%)、弱阳性表达27例(33.8%)、阳性表达15例(18.8%)、强阳性表达14例(17.5%)。不同表达强度的PD-L1表达情况如图1。
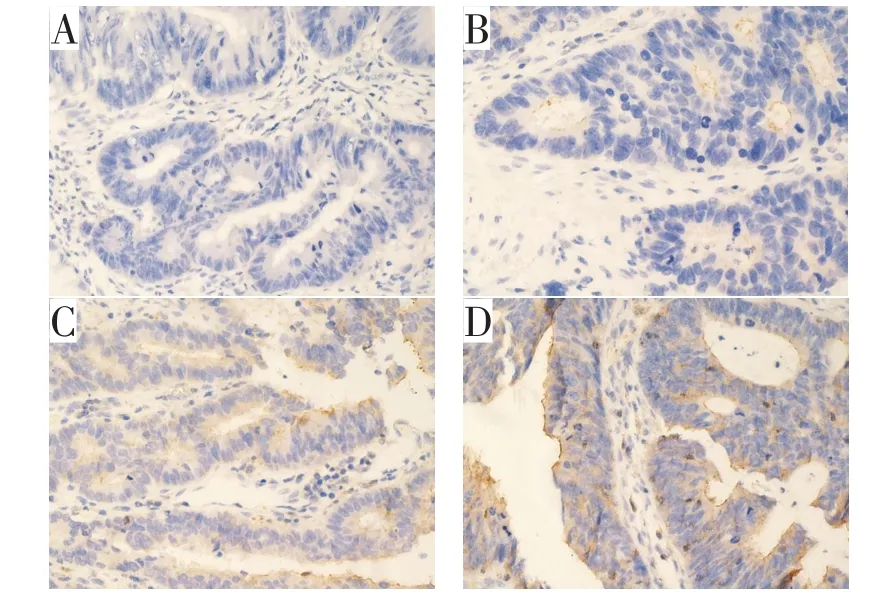
图1 PD-L 1表达强度的表达情况(×40)
2.2 不同肿瘤病理分期及分化程度结直肠癌的PDL 1表达量比较
不同肿瘤病理分期、分化程度结直肠癌的PDL1表达量比较,差异均无统计学意义(均P>0.05)。见表1。
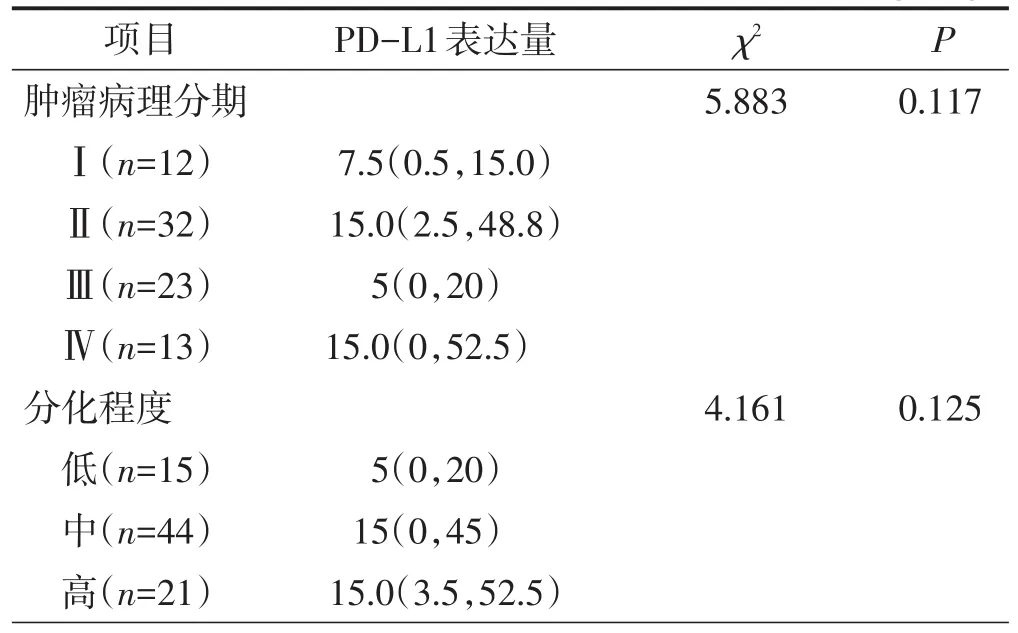
表1 不同肿瘤病理分期及分化程度结直肠癌的PD-L 1表达量比较 M(QL,QU)
2.3 PD-L 1不同表达强度的癌组织中CD 4+TIL及CD 8+TIL表达量比较
PD-L1不同表达强度的癌组织中CD4+TIL表达量比较差异无统计学意义(P>0.05)。PD-L1不同表达强度的癌组织中CD8+TIL表达量比较差异有统计学意义,PD-L1强阳性表达组癌组织中CD8+TIL表达量高于PD-L1阴性表达组、弱阳性表达组,PD-L1阳性表达组癌组织中CD8+TIL表达量高于PD-L1弱阳性表达组(均P<0.05)。见表2。
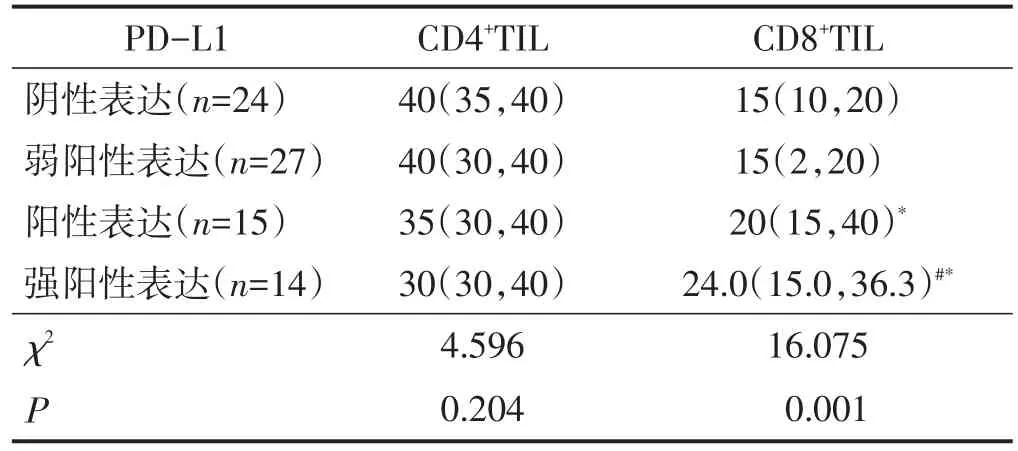
表2 PD-L 1不同表达强度的癌组织中CD 4+TIL及CD 8+TIL表达量比较 M(QL,QU)
2.4 PD-L 1不同表达强度的血清TNF- α及IL- 6水平比较
PD-L1不同表达强度的血清TNF-α及IL-6水平比较差异均有统计学意义,PD-L1强阳性表达组血清TNF-α水平高于PD-L1阴性表达组、阳性表达组,PD-L1强阳性表达组、阳性表达组血清IL-6水平均高于PD-L1阴性表达组、弱阳性表达组(均P<0.05)。见表3。
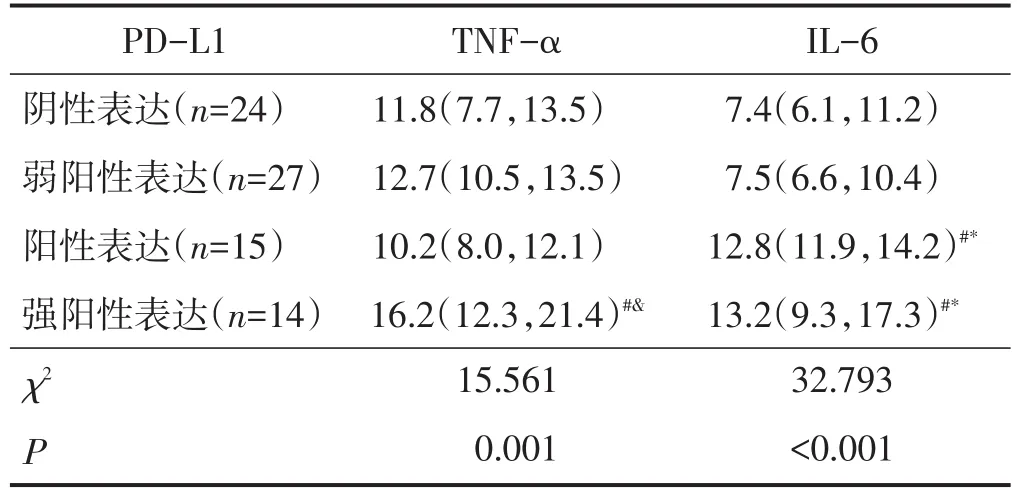
表3 PD-L 1不同表达强度的血清TNF- α及IL- 6水平比较 pg/mL,M(QL,QU)
3 讨论
PD-1是B7/CD28家族成员之一,在CD4+T细胞、CD8+T细胞、单核细胞、B细胞、自然杀伤T细胞、树突状细胞等细胞中表达,其两个配体分别为程序性死亡配体1(PD-L1,也称为B7-H1或CD274)和程序性死亡配体2(PD-L2,也称为B7-DC或CD273)。PD-L1可见表达于多种实体恶性肿瘤,比如头颈部鳞状细胞癌、肺癌、结直肠癌[10]。当PD-L1与PD-1结合时,T细胞活化的负反馈回路受到抑制,针对癌细胞而产生的细胞毒性T细胞增殖效应减弱,肿瘤借此逃避免疫监视得以进一步生长或转移[11]。Li等[12]开展的一项Meta分析纳入了2 131例CRC患者,根据这些患者的检测结果发现PD-L1的表达情况与患者年龄、肿瘤大小、TNM分期等无关,与肿瘤分化程度有关,但本研究结果未提示肿瘤病理分期、分化程度与PD-L1表达量有关,这可能与单中心来源样本有关。
有报道认为,PD-L1的表达情况可作为癌症患者预后的独立预测因子[13]。但近年来也有学者对“PD-L1高表达预示着CRC患者不良结局”这一说法提出了争议,因为有研究得出了相悖的结论[14],这些研究得出不同结论的原因可能是由于细胞免疫与免疫逃逸之间的复杂作用关系。Lin等[15]基于CD8+TIL密度及PD-1/PD-L1表达量对非小细胞肺癌患者进行分组研究,发现癌组织高CD8+TIL密度和低PD-1/PD-L1表达量的患者获得了最佳生存结局。本研究在检测癌组织PD-L1表达情况的同时检测CD4+TIL、CD8+TIL表达量,发现CD8+TIL表达量与PD-L1表达量有关,其中可观察到PD-L1强阳性表达组CD8+TIL表达量高于PD-L1阴性表达组。这些研究结果提示我们在评估CRC患者接受抗PD-1/PD-L1免疫预期获益时亦应可将TILs表达情况纳入考虑。
本研究中CRC患者血清TNF-α、IL-6水平与PD-L1表达量有关,其中可观察到PD-L1强阳性表达组血清TNF-α、IL-6水平均高于PD-L1阴性表达组。Ju等[9]研究发现肿瘤浸润巨噬细胞可释放促炎细胞因子TNF-α和IL-6,诱导癌细胞PD-L1的表达,并通过激活了NF-κB和STAT3信号通路调节PD-L1的表达。Li等[16]在对肥胖小鼠开展的研究中发现其肿瘤细胞PD-L1表达量升高,脂肪细胞可分泌TNF-α和IL-6进而上调PD-L1表达,使用抗TNF-α和抗IL-6抗体可对该过程产生负性作用。肿瘤微环境对抗PD1/PD-L1免疫治疗效果的影响作用是复杂的,我们在为患者制定治疗方案时应适当综合评估肿瘤微环境,TNF-α和IL-6水平不失为可选择的考虑因素。
综上所述,CRC患者癌组织检出PD-L1表达阳性率较高,CRC患者血清TNF-α、IL-6水平及癌组织中CD8+TIL表达量与癌组织中PD-L1表达量有关。肿瘤微环境对抗PD1/PD-L1免疫治疗效果的影响有待进一步探讨。