乳腺导管内癌微浸润的危险因素分析
罗华 杨欧欧 何俊玲 蓝天 胡祖健
随着乳腺钼靶筛查的普及,包括导管内癌在内的早期乳腺癌患者逐渐增加,导管内癌(DCIS)约占新发乳腺癌的20%[1],导管内癌伴微浸润(DCISM)发病相对少见,但随着导管内癌占新发乳腺癌比例增高,DCISM检出率也在增加。有研究[2]认为DCISM是导管内癌发展至浸润性癌的过渡阶段,其生物学行为、临床处理及预后均存在争议。关于导管内癌发生微浸润危险因素的研究较多,但不同文献报道的研究结论并不一致[3]。列线图(Nomogram)是一种基于算法的图形计算工具,可借助Logistic回归或Cox比例风险回归模型对多个变量之间函数关系进行定量分析可视化。本文分析DCIS发生微浸润的危险因素,并建立列线图预测模型,评估DCIS发生微浸润的风险,为临床医师选择合理治疗提供帮助。
1 资料与方法
1.1 临床资料 选取2008年1月至2016年12月本院DCIS及DCISM患者221例,排除新辅助化疗患者,所有患者术前行乳腺超声和乳房钼靶X线摄片检查,经手术病理证实。
1.2 方法 (1)资料收集:① 患者一般资料:年龄、绝经状况、临床是否存在可触及肿块、病灶大小;②影像学资料:乳腺钼靶、超声表现;③病理资料:导管内癌组织学核分级、ER、PR、HER-2、Ki-67。所有标本石蜡包埋,连续切片(4 µm厚),HE染色,免疫组织化学染色采用EnVision法,导管内癌组织学分级根据Van Nuys分级方法分为3组,高级别(G3),非高级别伴有坏死(G2),非高级别不伴坏死(G1)。雌激素受体(ER)及孕激素受体(PR)以1%为阳性界值;≥1%的肿瘤细胞核染色判断为阳性;在有阳性内参对照的情况下,<1%的肿瘤细胞核染色为阴性;免疫组化人表皮生长因子受体(HER-2)(0或+)为HRE-2阴性,HER-2+++为HER-2阳性;HER-2++为不确定;Ki-67以>14%作为Ki-67高表达界值。(2)治疗方法:包括手术治疗、放射治疗和内分泌治疗。其中乳房手术方式包括单纯乳房切除或保乳手术,腋窝手术方式包括前哨淋巴结活检或腋窝淋巴结清扫;保乳患者常规行放射治疗;内分泌治疗包括他莫昔芬和芳香化酶抑制剂,所有患者均未行术后辅助化疗。
1.3 统计学方法 采用SPSS 20.0统计学软件。计量资料以(±s)表示,比较采用t检验;计数资料以n(%)表示,比较采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。采用R语言3.6.0统计软件中rms包构建列线图预测模型。应用受试者工作特征曲线(ROC)下面积,评估各预测因素及列线图预测模型的预测能力。
2 结果
2.1 导管内癌伴微浸润与单纯导管内癌临床病理特征比较 见表1。
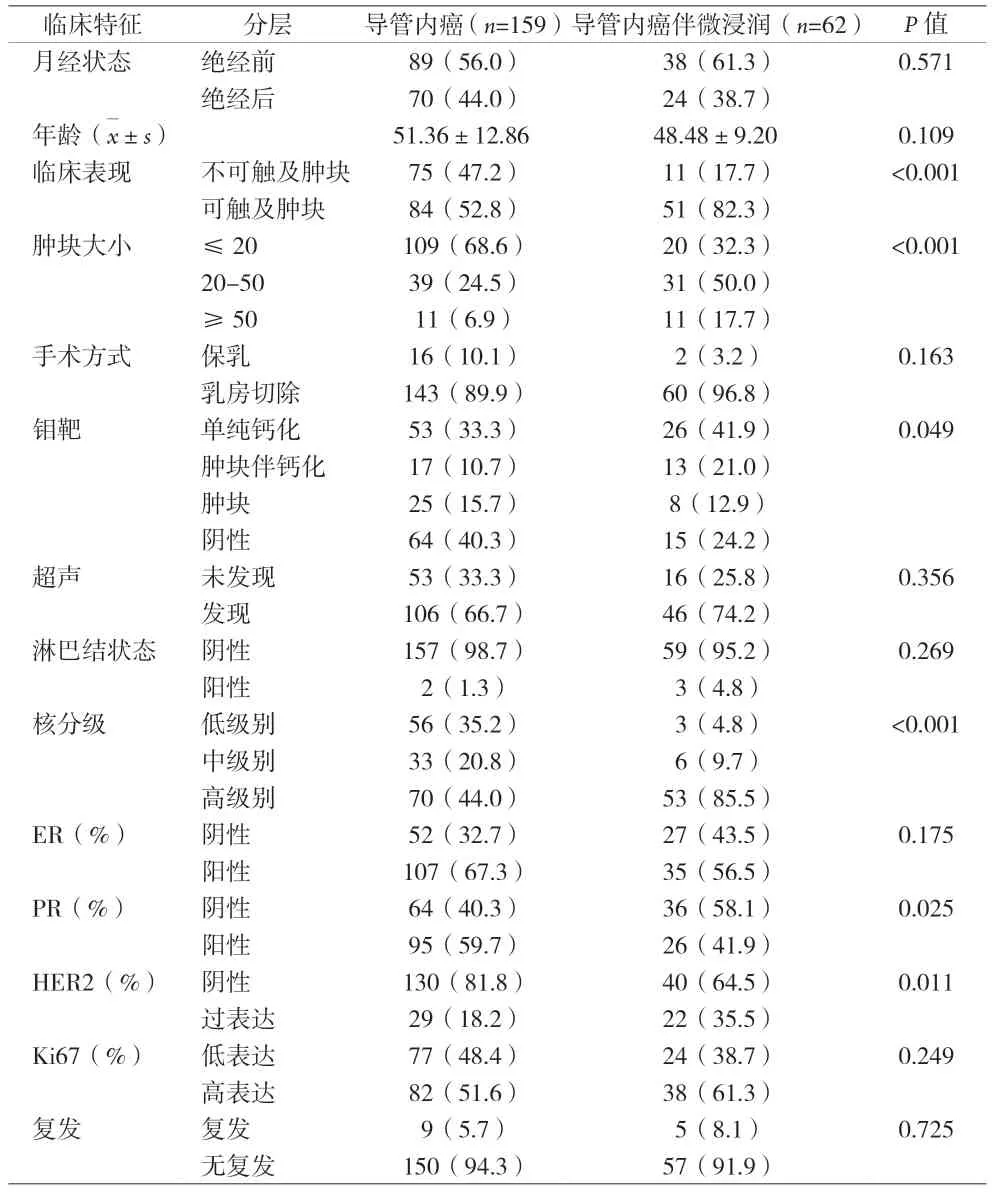
表1 导管内癌伴微浸润与单纯导管内癌临床病理特征[n(%)]
2.2 导管内癌发生微浸润的危险因素分析 见表2。
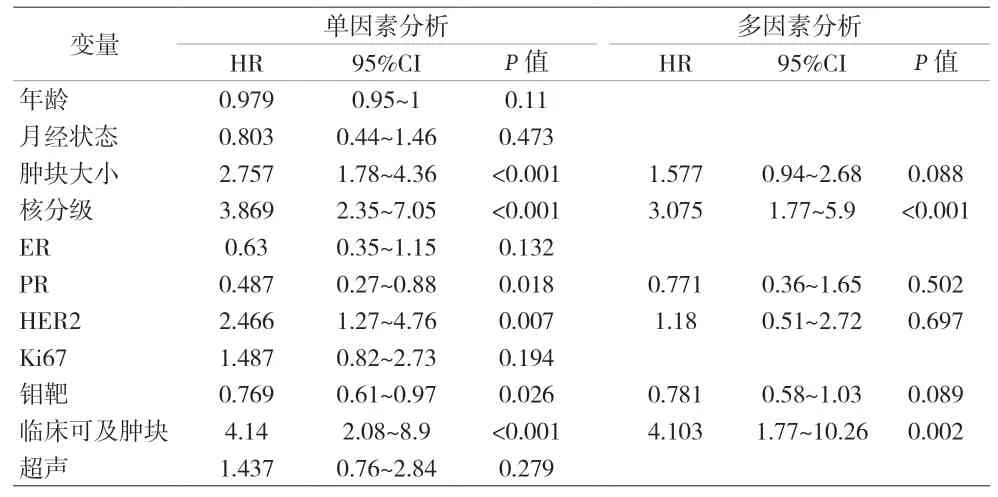
表2 导管内癌伴微浸润单因素和多因素Logistic回归分析
2.3 列线图预测模型的建立及验证 将通过Logistic回归纳入的4个风险因素构建导管内癌伴微浸润发生的列线图模型(见图1),对每一个风险因素进行赋值。核分级为高级别100分,临床存在可触及肿块58分,肿块直径≥2 cm 48分,钼靶表现为钙化或肿块伴钙化40分,通过对每个危险因素单项评分相加得到总分,总分所对应的值即为模型预测导管内癌伴微浸润发生风险。对列线图预测模型进行Bootstrap自抽样内部验证,重复抽样1000次后,C-index值为 0.816,模型具备较好的区分度。校正曲线显示列线图模型导管内癌发生微浸润发生风险与实际导管内癌发生微浸润风险平均绝对误差为0.033,具备较好的一致性(见图2)。
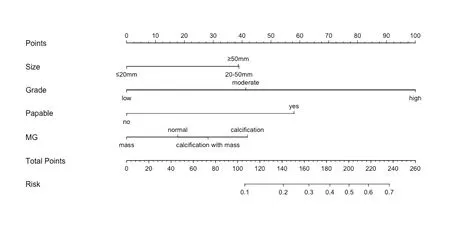
图1 导管内癌发生微浸润的列线图模型
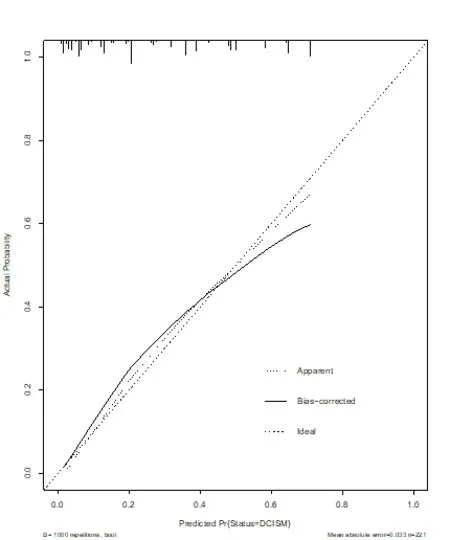
图2 列线图模型预测导管内癌伴微浸润风险内部验证的校准曲线
2.4 列线图预测模型的评价 通过绘制ROC曲线(见图3)对各项风险因素及列线图模型的预测能力进行评价,结果显示:核分级为高级别、临床存在可触及肿块、肿块直径≥2 cm、钼靶表现为钙化或肿块伴钙化预测导管内癌伴微浸润发生的AUC分别为0.719、0.647、0.686和0.589,列线图预测模型的AUC为0.811(95%CI:0.752~0.870),较其他单项危险因素具备更好的预测性能。
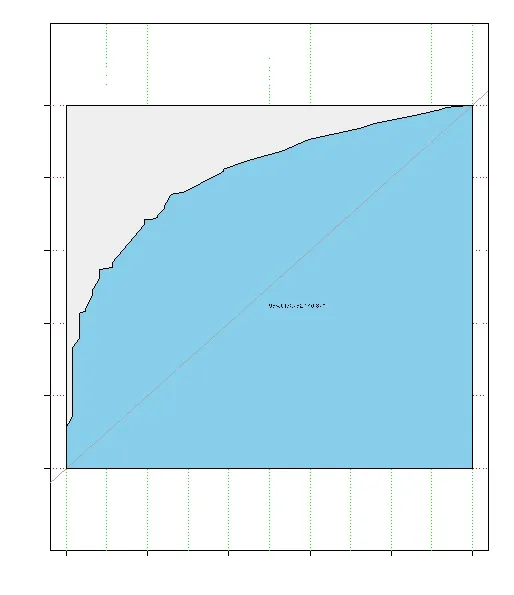
图3 列线图模型预测导管内癌伴微浸润风险的ROC曲线
3 讨论
DCISM以乳腺间质中出现单个或多个独立的镜下浸润灶且浸润灶最大径≤1 mm为特征,当存在多处微浸润灶时,只计最大病灶[4]。DCISM约占所有导管内癌的10%~20%,约占所有乳腺癌的1%[5],本资料DCISM患者占同期所有导管内癌27.7%,略高于国外文献报道。和DCIS相比,DCISM更易触及乳房肿块,研究报道[6]19%~56.1%的DCISM可触及乳房肿块,本资料中82.3%的DCISM患者可触及肿块,52.8%的DCIS可触及肿块,DCISM临床可触及乳房肿块比例更高(P<0.001)。研究发现[7]微浸润的发生与导管内癌病灶的大小相关,病灶越大伴发微浸润风险越大。SILVERSTEIN等[8]报道208例导管内癌患者,肿块<0.5 cm、0.6~1.0 cm、1.1~2.0 cm、2.1~4.9 cm、>5 cm,出现微浸润的几率分别为3%、6%、18%、17%、23%。本资料结果显示,肿块>2.0 cm时,导管内癌伴微浸润的占比为67.7%,而DCIS占比仅为31.4%(P<0.001),提示肿块越大,导管内癌伴微浸润可能越大。导管内癌钼靶表现无特异性表现,肿块伴钙化在DCISM更常见,62例DCISM中,62.9%钼靶发现钙化,其中21%为肿块伴钙化;而159例DCIS中,44%钼靶发现钙化,其中10.7%为肿块伴钙化,无论是钙化还是钙化伴肿块的占比,DCISM组均高于DCIS组,差异有统计学意义(P<0.05)。本组所有患者均行超声检查,46例(74.2%)DCISM超声发现肿块,106例(66.7%)DCIS超声发现肿块,DCISM组较DCIS组超声更易发现肿块。余科达等[9]报道DCISM或伴浸润者病灶更大,核分级更高;PADMORE等[10]报道核分级为高级别在DCISM中更常见。既往研究[6-7]发现DCISM中导管内癌成分为粉刺型的比例明显高于DCIS,认为病理类型存在粉刺样坏死是发生微浸润的危险因素。本资料显示,核分级为高级别者微浸润发生率明显高于低级别和中级别者(P<0.001),提示核分级为高级别与微浸润的发生存在相关性。研究发现[11]DCIS在腔面型乳腺癌比例高于DCISM,DCISM在三阴性型和HER-2阳性型比例高于DCIS。有研究认为[9]ER阴性肿瘤细胞在早期浸润起重要作用,与DCIS相比,DCISM的ER阳性率更低,分别为69.9%和58.4%[11]。文献报道[12]HER-2在DCISM中过表达为53.6%,高于DCIS;Ki-67指数与肿瘤增殖能力相关,DCISM中Ki-67指数也高于DCIS。
研究显示高组织学分级[3]、肿瘤直径大[13]、粉刺样坏死[14]可能是导管内癌发生微浸润的危险因素;也有研究认为临床可触及肿块与导管内癌发生微浸润相关[15];此外,分子生物学指标ER、PR、HER-2、Ki-67可能与微浸润的发生有相关性[16]。本资料结果显示,导管内癌发生微浸润的预测因素包括:核分级为高级别、临床可触及肿块、肿块直径≥2 cm、钼靶表现为钙化或肿块伴钙化,并建立基于这4项独立预测因素的导管内癌发生微浸润风险的列线图预测模型,列线图预测模型与微浸润发生相关,C-index指数为0.816,表明该列线图模型是可以对导管内癌发生微浸润风险进行有效评估的预测系统。该模型ROC曲线下面积为0.811,预测能力较强。

