西红花吸光度测定方法改进及其品质快速评价△
李庆,闫晓剑,黄永亮,彭善贵,赵小勤,周晓英,罗霄,文永盛
1.成都市食品药品检验研究院,四川 成都 610045;2.国家药品监督管理局 中药材质量监测评价重点实验室,四川 成都 610045;3.成都中医药大学,四川 成都 611137;4.成都虹微技术有限公司,四川 成都 610041
西红花为鸢尾科植物番红花CrocussativusL.的干燥柱头。《中华人民共和国药典》(以下简称《中国药典》)2005—2015年版西红花检查项下均有吸光度值测定方法[1-3]。笔者对存储于成都市食品药品检验研究院Laboratory Information Management System内近5年已发布的34份西红花检品和现有文献中西红花样品按《中国药典》方法测定吸光度值的数据合并统计[4-6],发现86%的西红花样品吸光度值超出《中国药典》2015年版规定的紫外分光光度法检测的合理范围(0.3~0.7)。同时,对本课题随机采集的107份国产及伊朗产西红花样品采用该法测试,同样发现有72%的样品吸光度值不在0.3~0.7。《西红花等级质量》[6]和《中国药典》2015年版中均指明,西红花含量测定应避光操作,而西红花吸光度值测定法未对操作条件作规定。
当前标准或文献中主要采用较为耗时的液相色谱法测定单个或数个有效成分作为西红花主要质量控制指标[3,7-10],但中药功效是复杂成分协同作用的结果。西红花吸光度值的测定波长为432 nm,该吸光度值与西红花苷类成分含量呈正比。与单个或数个有效成分相比,吸光度值更能整体反映西红花品质,同时紫外分光光度法测定速度快、成本低。因此,本研究对西红花吸光度值测定方法进行了改进研究,并对不同产地、不同等级的西红花品质进行比较和评价,为西红花质量评价和控制方法的制定提供参考。
1 材料
1.1 试药
收集伊朗及我国上海、浙江、河南、安徽产的西红花样品107份,其中伊朗70份,国产37份,见表1。样品经成都市食品药品检验研究院文永盛主任药师鉴定为鸢尾科植物番红花CrocussativusL.的干燥柱头;对照品西红花苷Ⅰ(批号:BP0406)、西红花苷Ⅱ(批号:BP0407)购自成都普非德生物技术有限公司,纯度均大于97.14%;甲醇为分析纯。
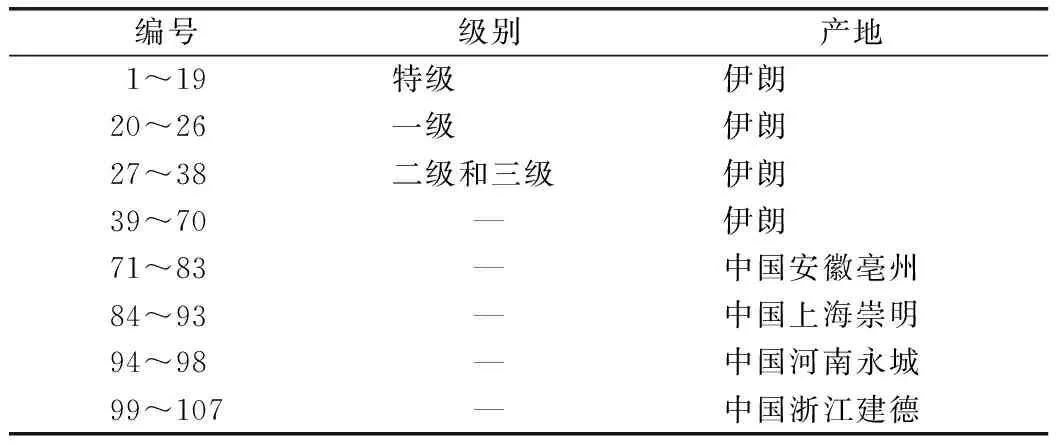
表1 西红花样品信息
1.2 仪器
UV-2450型紫外分光光度计(日本岛津公司);SK250H型超声仪(上海科导超声仪器有限公司)。
2 方法
2.1 样品制备
对所有西红花样品照《中国药典》2015年版方法进行粉碎,备用。
2.2 提取方法考察
随机选取上述粉碎好的西红花样品1份,精密称取30 mg,分别考察索氏提取、回流提取、超声提取对西红花样品吸光度值的影响。索氏提取法按照《中国药典》2015年版中方法,提取至索氏管中液体无色为终点;回流提取法选取提取时间分别为30、45、60、75、90 min;超声提取法选取提取时间分别为30、45、60、75、90 min。上述条件下所得提取液采用紫外-可见分光光度法在432 nm下测定吸光度值。
2.3 稳定性考察
以2.2项下超声提取45 min的供试品溶液作为稳定性考察溶液,在10和25 ℃、避光与不避光条件下,每隔1 h测试,观察吸光度值变化情况。
2.4 稀释倍数的确定
按上述确定好的提取方法,考察所有粉碎好的西红花样品,精密称取30 mg,置相应提取方法所需提取器中,按《中国药典》2015年版西红花吸光度值测定方法,测定所有西红花样品的吸光度值。根据吸光度值在一定范围内与溶液质量浓度呈正相关关系,计算上述样品的最适稀释倍数。选择在稀释1000、1111、1250、1429、1667、2000倍条件下,所有西红花样品吸光度值在0.3~0.7数量最多的稀释倍数。并按照计算的最适稀释倍数测定样品吸光度值。
2.5 对照品溶液配制和测定
精密称取西红花苷Ⅰ对照品5.591 mg、西红花苷Ⅱ对照品4.201 mg,分别置100 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,再精密量取3 mL,置50 mL量瓶中,加甲醇稀释至刻度,摇匀,即得质量浓度为0.003 35 mg·mL-1的西红花苷Ⅰ对照品溶液和质量浓度为0.002 52 mg·mL-1的西红花苷Ⅱ对照品溶液,分别在波长270~650 nm进行扫描,获取紫外光谱数据。
2.6 统计学方法
使用SAS软件对测定结果进行正态性检验(Shapiro-Wilk normality test)、t检验(t-test)和秩和检验(Wilcoxon rank sum test)及变异系数(标准偏差与平均值的比值)计算。
3 结果与分析
3.1 西红花样品提取方法考察
不同提取方法提取后样品的吸光度检测结果见图1。结果表明,回流提取的最佳效果不能达到索氏提取效果,而超声45~75 min即可达到索氏提取效果,继续增加超声时间,则提取效果下降,表明超声提取45 min可作为改进后的提取方法。
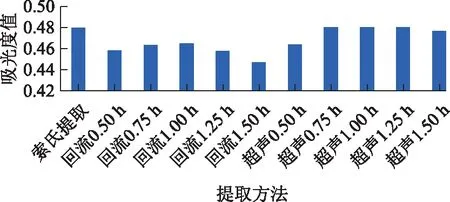
图1 索氏提取、回流提取、超声提取法提取西红花效果比较(n=2)
3.2 西红花样品稳定性考察
由表2可知,在不避光条件下,西红花样品在25 ℃时2 h内吸光度值稳定(RSD<3%),继续增加放置时间吸光度值呈逐步下降趋势;10 ℃时8 h内吸光度值稳定(RSD<3%)。在避光条件下,西红花样品在25 ℃时4 h内吸光度值稳定(RSD<3%),10 ℃ 时8 h内吸光度值稳定。结果表明,在25 ℃、不避光条件下西红花测定应尽快完成,而在25 ℃、避光条件下更加稳定。低温条件下(10 ℃)无论是避光或不避光,8 h内测试液均表现出较好的稳定性。表明西红花吸光度值应在避光条件下测定,并尽快完成测试。
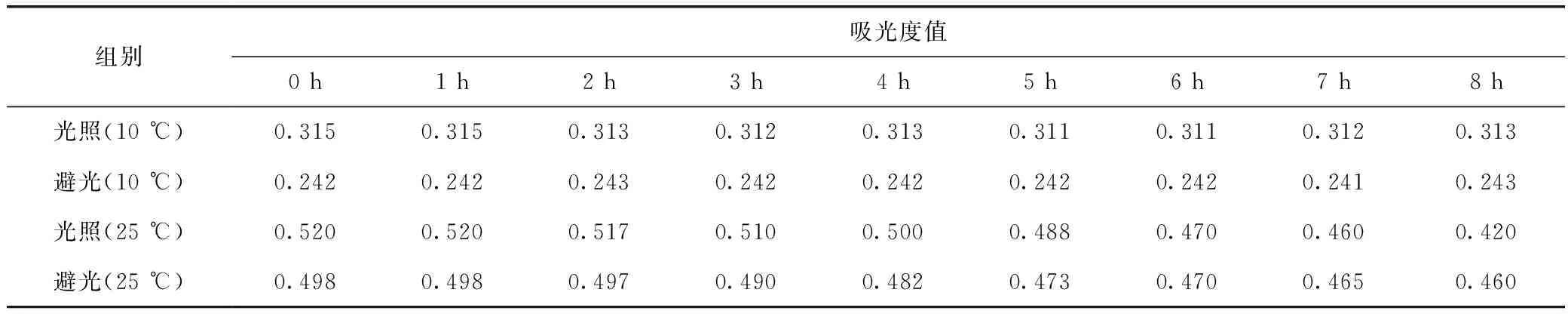
表2 不同温度、避光与否条件下西红花样品的稳定性比较(n=2)
3.3 西红花样品稀释倍数考察
按《中国药典》2015年版方法,选取稀释倍数为1000,结果表明,仅28%的西红花样品吸光度值在0.3~0.7(图2)。根据质量浓度与吸光度值呈正比,计算得出,当稀释倍数为1667时所有西红花样品吸光度值在0.3~0.7的数量最多,即稀释方法为样品用40 mL甲醇提取后,加甲醇稀释至100 mL,摇匀,再精密量取0.6 mL置于10 mL或精密量取3 mL置于50 mL量瓶中,摇匀,滤过,即得。按该稀释倍数测定所有西红花样品的吸光度值,发现88%的西红花样品吸光度值在0.3~0.7(图3)。
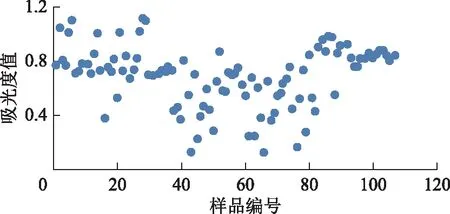
图2 稀释倍数为1000时西红花样品的吸光度值分布(n=2)
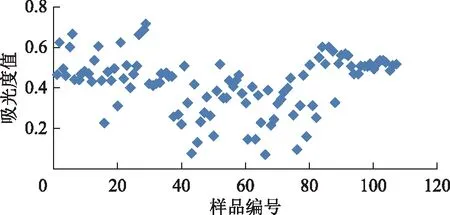
图3 稀释倍数为1667时西红花样品的吸光度值分布(n=2)
改进后的吸光度值测定方法稀释倍数发生了改变,其限度也随之变化,限度与代表性样本的均值相关[11-13],而吸光度值的大小与溶液的质量浓度在一定范围内呈线性关系,因此,按照公式(1)计算新的吸光度限度值为0.3。
限度值=原吸光度限度×原吸光度限度下稀释倍数/新吸光度限度下稀释倍数
(1)
由图3可知,107个样品中21批样品不合格,这与原吸光度限度为0.5时的判断结果一致(图2)。
3.4 样品测定结果分析
按照优化后的方法测定107批西红花样品的吸光度,对所得光谱数据进行统计分析。国产的37份西红花样品的吸光度值为0.225~0.716,其中仅1批样品不符合限度要求;伊朗产70份西红花样品的吸光度值为0.075~0.603,与国产样品比较差异有统计学意义(P<0.001),其中有20批不合格。同时,国产西红花质量更加稳定(变异系数为0.206),而伊朗产西红花等级差别大,整体质量变异较大(变异系数为0.402)。样品光谱图见图4A。结果表明,在本研究中,国产西红花样品质量优于伊朗产西红花样品,也与文献报道相符[14]。目前,国产西红花价格2~4万元/kg,甚至更高,而伊朗产西红花价格为1万元/kg左右。
不同级别西红花样品吸光度值测定图谱见图4B。20份特级西红花样品的吸光度值为0.219~0.603,有2份不合格(合格率90%);7份一级西红花样品的吸光度值为0.260~0.466,有5份合格(合格率71%);12份二级及二级以下等级的西红花样品吸光度值为0.098~0.327,仅4份合格(合格率33%)。数据表明,特级西红花合格率高于一级、二级和三级西红花(P<0.05,P<0.001),一级西红花合格率高于二级和三级西红花(P<0.01)。但笔者通过调查当前市销西红花等级划分方法发现,商家主要根据货物的状态和自身经验进行划分,划分标准比较混乱,如有的商家是根据花柱的长短、色泽进行划分,有的则根据放置年限进行划分,有的还根据杂质多少进行划分等。图4B中可以看出,特级西红花、一级西红花、二级西红花之间的光谱线存在一定程度的交叉,因此有必要制定统一的和科学合理的等级划分方法。

注:A.不同产地西红花样品;B.不同等级西红花样品;C.西红花苷Ⅰ和西红花苷Ⅱ。图4 西红花样品、西红花苷Ⅰ和西红花苷Ⅱ的紫外光谱图
由图4C可知,西红花甲醇提取液、西红花苷Ⅰ甲醇溶液和西红花苷Ⅱ甲醇溶液均在432 nm处有最大吸收峰,在457 nm处也均有1个较大吸收峰,西红花苷类成分具有相同的母核,其主要差异是取代基糖数量和种类不同[15]。由于缺乏足够的西红花苷类成分对照品,由现有的西红花苷Ⅰ和Ⅱ的吸收光谱可知,其他西红花苷类如西红花苷Ⅲ和Ⅳ等也应在432 nm处有最大紫外吸收。由于西红花苷类成分是西红花中的主要活性成分,该吸光度值的大小与单个或数个西红花苷类成分含量的多少相比较,更能整体反映西红花品质。
综上,将《中国药典》2015年版中西红花吸光度测定方法中的索氏提取方法改为超声提取45 min,同时将样品稀释倍数由1000倍增加到1667倍,并规定避光操作,其余过程按《中国药典》2015年版方法操作,新的方法更加快速,所得结果更加科学合理。利用改进后的吸光度测定方法测定西红花样品,所得吸光度值可以准确评价不同产地、不同等级的西红花质量。
4 讨论
高效液相色谱法是当前中药质量控制指标的主流测定方法,但该方法测定的指标有限,且测定过程耗时,成本较高。如对于西红花药材,《中国药典》2015年版中采用高效液相色谱法同时测定西红花苷Ⅰ和西红花苷Ⅱ的含量,两者之和的限度为西红花质量控制指标。已有文献报道,国产西红花样品中西红花苷Ⅰ和西红花苷Ⅱ含量之和占西红花总苷的80%,而进口西红花为60%[16],表明还有20%~40%的西红花苷类成分没有测定。增加中药质量控制指标数是当前中药质量控制的发展趋势,但西红花中除西红花苷Ⅰ和西红花苷Ⅱ外,其余西红花苷类成分含量很低,并不适合采用高效液相色谱法测定,这在其他中药中也较常见,如丹参中的丹参酮类成分、人参中的人参皂苷类成分、银杏叶中的黄酮类成分,均仅能用液相色谱法测定几个含量较高的成分。
紫外分光光度法测定速度快、成本低,在特定波长下,能够同时对同类的多个组分快速完成测定,该测定值的大小可整体反映某类指标量的差异,进而评价中药质量。
本研究利用紫外分光光度法所得吸光度值准确评价了不同产地、不同等级的西红花质量,表明该测定方法可用于评价中药的质量,是高效液相色谱法测定质量控制指标时的一个重要补充。另外,与常用的紫外分光光度法测定中药中某类成分总的含量不同的是,本研究直接利用紫外分光光度法测定样品溶液吸光度值即可,而不需要采用对照物质并制作标准曲线,进一步降低了测试难度和成本。改进后的西红花吸光度值测定方法更加快速,所得结果更加科学、合理及准确,为西红花药材质量评价提供参考。

