老年非小细胞肺癌患者放疗前后Treg及Foxp3 mRNA的变化
侯盼飞 祝丽晶 濮娟 潘艳★
肺癌发病率居恶性肿瘤第1 位,70%以上患者确诊时已是中晚期,放疗在肺癌的治疗中占有非常重要的地位[1]。但是放疗在激活机体抗肿瘤免疫的同时,也能引起机体的免疫抑制,出现肿瘤对射线的抵抗[2]。因此,如果放疗过程中能够解除机体的免疫抑制,即放疗联合免疫治疗,可以更有效地增强机体的抗肿瘤效应,改善患者的预后。调节性T 细胞(regulatory T cells,Treg)在机体内发挥重要的免疫抑制作用,且与放疗密切相关[3]。本研究通过流式细胞术(Flow Cytometry,FCM)及实时荧光定量逆转录聚合酶链反应技术(reverse-transcription PCR,RT-PCR)测定非小细胞肺癌(non-small cell lung cancer,NSCLC)放疗过程中Treg 以及其叉头状螺旋转录因子3(Forkhead helix family transcription factor 3,Foxp3)mRNA 在放疗过程中的变化,试图为患者放疗联合免疫治疗提供干预的靶点以提高放疗疗效。
1 资料与方法
1.1 一般资料
选取本院2019年1月-2019年12月收治的40例NSCLC 作为肺癌组,其中男23 例,女17 例;年龄平均(68.55±7.82)岁。纳入标准:①年龄≥60 岁;②病理确诊为NSCLC[4];③患者未接受其他治疗,且开始采集标本后1月内不行手术及化疗,只接受单纯放疗的患者。排除标准:①慢性阻塞性肺疾病、哮喘急性发作期;②合并自身免疫系统疾病;③合并感染;④近一月使用过糖皮质激素或免疫抑制剂。选取同期在本院查体的50 例健康体检者作为对照组,其中男27 例,女23 例;年龄平均(67.38±7.99)岁。两组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。该项目经本院伦理委员会批准且所有参与者均签署知情同意书。
1.2 主要仪器和试剂
Varian 23-Ex 直线加速器购自美国Varian 公司,Navios 流式细胞仪购自美国Beckman Coulter公司,ABI7500PCR 扩增仪购自美国ABI 公司,人Treg 检测试剂盒购自美国BD 公司,RT-PCR 试剂盒、RNA 提取试剂及各种生化试剂购自上海生工生物工程股份有限公司。Foxp3基因引物P1:5′-CTGGGCTCCTCGCCTGAC-3′,P2:5′-CTCTCT-GCCCTCAGCCTTGC-3′,由上海生工生物工程股份有限公司合成。
1.3 放疗方法
采用Varian 23-Ex 直线加速器,肺癌组患者均采用6 MV X 线IMRT 外照射,常规分割2.0 Gy/f,总剂量DT 60 Gy/30f。
1.4 血样采集
对照组清晨空腹采集静脉血5 mL,采用肝素抗凝。肺癌组分别于放疗前、放疗期间(每隔6 次放疗)采集标本,方法同对照组。
1.5 Treg 检测
取静脉血100 μL 加入已标记好的流式管,分别加入FITC Mouse Anti-Human CD4、PE Mouse Anti-Human CD25、Alexa FluorR647 Mouse anti-Hu-man CD127 各20 μL,室温避光孵育15 min;加入裂解液,震荡混匀室温避光15 min,1 200 r/min 离心5 min,弃上清后加入2 mL PBS,1 200 r/min 离心5 min;弃上清后加入500 μL PBS 震荡后,流式细胞仪检测Treg 占CD4+T 淋巴细胞百分比。
1.6 Foxp3 mRNA 检测
Trizol 法提取血浆总RNA,用随机引物逆转录成cDNA,以cDNA 作为模板,按照试剂说明书配制反应体系,采用ABI7500 PCR 仪检测Foxp3mRNA 的相对表达水平。
1.7 统计学分析
采用SPSS 22.0 软件进行统计分析,计量资料以()表示,组间比较采用t检验,多组间比较采用方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 对照组与肺癌组放疗前外周血检测指标的比较
肺癌组放疗前外周血Treg 占CD4+T 淋巴细胞百分比以及Foxp3mRNA 相对表达量均高于对照组,差异有统计学意义(P<0.05)。见表1、图1。
表1 两组外周血Treg 百分比、Foxp3 mRNA 相对表达量比较(±s)Table 1 Comparison of Treg percentage and Foxp3 mRNA relative expression between 2 groups(±s)
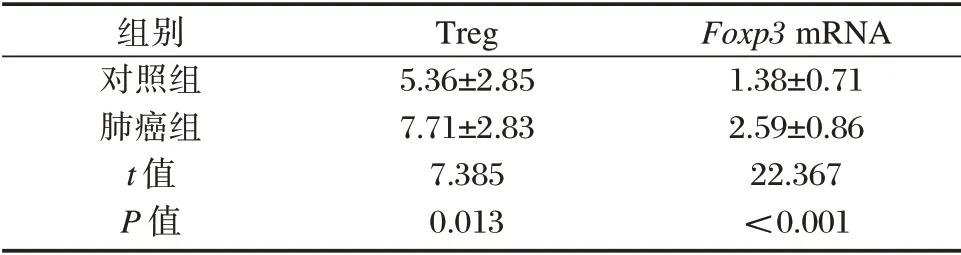
表1 两组外周血Treg 百分比、Foxp3 mRNA 相对表达量比较(±s)Table 1 Comparison of Treg percentage and Foxp3 mRNA relative expression between 2 groups(±s)
组别对照组肺癌组t 值P 值Treg 5.36±2.85 7.71±2.83 7.385 0.013 Foxp3 mRNA 1.38±0.71 2.59±0.86 22.367<0.001

图1 外周血Treg 检测流式细胞图Figure 1 Flow cytometry of Treg detection in peripheral blood
2.2 肺癌组放疗期间外周血的检测指标变化
肺癌组放疗期间各阶段外周血Treg 占CD4+T淋巴细胞百分比自放疗后开始上升,至第18 次升至最高,与放疗前比较差异有统计学意义(P<0.05),然后逐渐下降,至第30 次与放疗前比较差异无统计学意义(P>0.05)。肺癌组放疗期间各阶段外周血Foxp3mRNA 相对表达量自放疗后开始上升,至第12 次升至最高,与放疗前比较差异有统计学意义(P<0.05),然后逐渐下降,至第30 次与放疗前比较差异无统计学意义(P>0.05)。见表2。
表2 肺癌放疗各阶段Treg、Foxp3 mRNA 的变化(±s)Table 2 Changes of Treg and Foxp3 mRNA in different stages of lung cancer radiotherapy(±s)
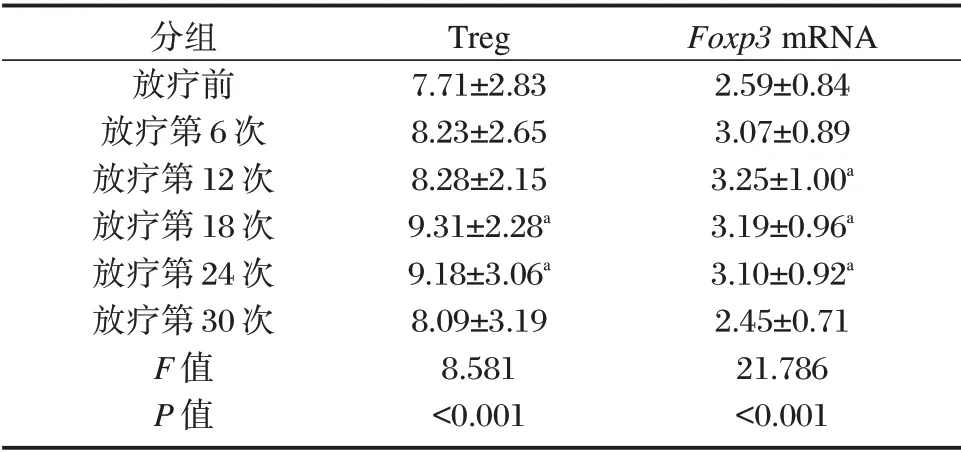
表2 肺癌放疗各阶段Treg、Foxp3 mRNA 的变化(±s)Table 2 Changes of Treg and Foxp3 mRNA in different stages of lung cancer radiotherapy(±s)
注:a与放疗前相比,P<0.05。
分组放疗前放疗第6 次放疗第12 次放疗第18 次放疗第24 次放疗第30 次F 值P 值Treg 7.71±2.83 8.23±2.65 8.28±2.15 9.31±2.28a 9.18±3.06a 8.09±3.19 8.581<0.001 Foxp3 mRNA 2.59±0.84 3.07±0.89 3.25±1.00a 3.19±0.96a 3.10±0.92a 2.45±0.71 21.786<0.001
3 讨论
我国肺癌的发病率和病死率均位居恶性肿瘤之首,并以NSCLC 最为多见[5]。由于肺癌早期诊断较为困难,确诊时只有15%的患者能够手术治疗[5]。对于无法手术的患者,放疗是主要的治疗措施。放疗可直接杀死肿瘤细胞,并通过刺激局部免疫反应形成长期抗肿瘤效果[6]。然而,放疗在激活抗肿瘤免疫的同时,也能引起机体的免疫抑制,造成肿瘤对射线的抵抗,这种现象与免疫抑制性Treg 的调控密切相关[2-3,7]。
本研究的结果表明,肺癌组放疗前外周血Treg占CD4+T 淋巴细胞百分比及Foxp3mRNA 的相对表达水平均明显升高,这种现象在其它的恶性肿瘤中也得到证实[8-9],但Treg 占CD4+T 淋巴细胞百分比以及Foxp3 mRNA 相对表达水平增多的机制并未具体阐明。有研究表明肿瘤细胞高表达环氧合酶2(Cyclooxygenase-2,COX-2),COX-2 可产生过量的诺前列酮,从而诱导Treg 的产生,同时还可促进Foxp3 mRNA 表达的上调[10]。另外,肿瘤微环境中增多的白细胞介素-10(interleukin-10,IL-10)、转化生长因子-β(transforming growth factor-β,TGF-β)以及未成熟抗原递呈细胞表达,可诱导Treg 的增殖[11]。Treg 可以通过细胞-细胞间的接触抑制、细胞因子途径两种途径抑制效应细胞的免疫反应,抑制机体的抗肿瘤免疫应答。因此,肿瘤机体内Treg 增多导致免疫耐受增强,加速肿瘤的进展[12]。
本研究结果显示,肺癌放疗过程中Treg 占CD4+T 淋巴细胞百分比以及Foxp3 mRNA 的相对表达量自放疗后开始逐渐上升,这与Zhang 等[3,13]的研究结论是一致的。放疗过程中Treg 升高的具体分子机制可能与放疗能够诱导和活化免疫抑制因子TGF-β、增加蛋白激酶B 的表达,进而促进Treg 生成、抑制Treg 凋亡有关[14]。Treg 和Foxp3 mRNA 升高至一定程度后又逐渐下降,这与Napolitano 等[15]在大肠癌中的研究一致,这种变化机制可能与microR-545 的表达有关。放疗期间Treg 及Foxp3 mRNA 变化,提示放疗进一步影响了机体的免疫耐受。
本研究探讨了机体内Treg 及Foxp3 mRNA 伴随放疗发生变化的现象及可能的机制。本研究亦存在一定的局限性:由于受严格的纳入和排除标准限制,首诊且仅行放疗的患者较少,致入组的样本量少,未按照肿瘤分期进行分组统计;另外,免疫系统的个体差异因素可能导致一定的偏倚。针对于上述问题,本课题组下一步的研究计划将纳入更多的患者,并对他们进行更长放疗时间的追踪,更精准地提炼出放疗过程中Treg 以及Foxp3mRNA 的变化规律,并对内部分子机制进行更深入的的研究。
放疗协同免疫治疗,应用前景广阔,研究肺癌放疗过程中Treg 及其Foxp3mRNA 的普遍变化规律具有重要意义。如能在放疗过程中选择适宜的时机干扰Treg 或Foxp3mRNA 的表达,将充分发挥抗肿瘤免疫效应细胞的功能,杀灭肿瘤细胞,提高肺癌放疗的疗效,改善患者的预后。

