DOE(试验设计)在原料药工艺优化中的应用
陈静
(天津生物工程职业技术学院,天津 300350)
DOE(Design of Experiment)试验设计,一种安排实验和分析实验数据的数理统计方法;试验设计主要对试验进行合理安排,以较小的试验次数、较短的试验周期和较低的试验成本,获得理想的试验结果以及得出科学的结论。
DOE的应用方向:为原料选择最合理的配方;为生产过程选择最合理的工艺参数;解决那些久经未决的“顽固”品质问题;缩短新产品开发周期;提高现有产品的产量和质量;为新或现有生产设备或检测设备选择最合理的参数等。
另一方面,试验过程通过数据表现出来的变异,实际上来源于两部分:一部分来源于试验过程本身的变异,一部分来源于测量过程中产生的变差,进行MSA测量系统分析可以知道试验过程表现出来的变异有多接近过程本身真实的变异。
1 项目简介
埃索美拉唑,即S-奥美拉唑,是由瑞典Astra公司分离合成的全球第一个单一异构体的质子泵抑制剂,开发盐类包括镁盐(口服制剂)和钠盐(注射剂),其口服制剂埃索美拉唑镁,最早于2000年12月在瑞典上市,随后于2001年在美国、加拿大、欧洲等地获准上市,商品名:NEXIUM,剂型包括肠溶胶囊(美国)、肠溶片(欧洲、加拿大)、肠溶干混悬剂。2003年9月,瑞典又率先上市了埃索美拉唑注射用粉针剂,含埃索美拉唑钠,商品名:NEXIUM。2005年美国FDA批准注射用埃索美拉唑钠上市,商品名:NEXIUM IV,适应症为:口服疗法不可行或不适用时,替代口服疗法短期治疗成年患者和1~17岁儿科患者伴有EE的GERD。2007年批准进口注射用埃索美拉唑钠(由阿斯利康制药有限公司分包装),2012年批准进口原料药埃索美拉唑钠。另外,我国分别于2004年和2009年批准在华企业阿斯利康制药有限公司生产埃索美拉唑镁肠溶片和注射用埃索美拉唑钠。目前国内市场上既有埃索美拉唑进口产品也有国产产品,商品名均为:耐信,完全由阿斯利康制药有限公司(及其母公司AstraZeneca)垄断。由于专利限制,目前国内企业无法开发埃索美拉唑镁口服制剂,而限制开发注射用埃索美拉唑钠的专利已于2014年5月26日到期[1~5]。
2 工艺描述
化合物(2)即为S-奥美拉唑,其是由化合物(1),通过下列反应制得[1,2]:
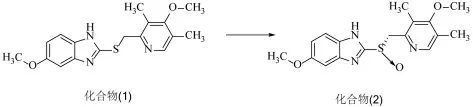
将甲苯50mL加入反应瓶中、加入化合物(1)10.0g、D-酒石酸二乙酯8.0g、水0.2g,搅拌升温至70℃,待固体全溶后,70℃搅拌2.0h,加入钛酸异丙酯4.8g,保温搅拌1h。降温至-10℃,滴加4.2gN,N-二异丙基乙胺。滴毕,控制温度不高于-5℃滴加6.2g过氧化氢异丙苯。滴加完毕,升温至20℃反应,HPLC监控原料反应2h情况。
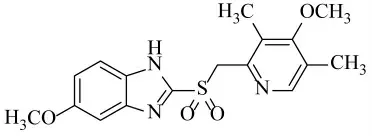
本步反应中存在的主要问题是化合物1反应不完全,以及以下氧化杂质较大,不易除去,从而严重影响产品质量。杂质的结构如下:
3 试验设计及结果分析
化合物(2)合成,采用DOE设计10组不同投料比的进行投料,分别以监控反应2h后的杂质生成量及原料剩余量为指标,HPLC结果见表1。
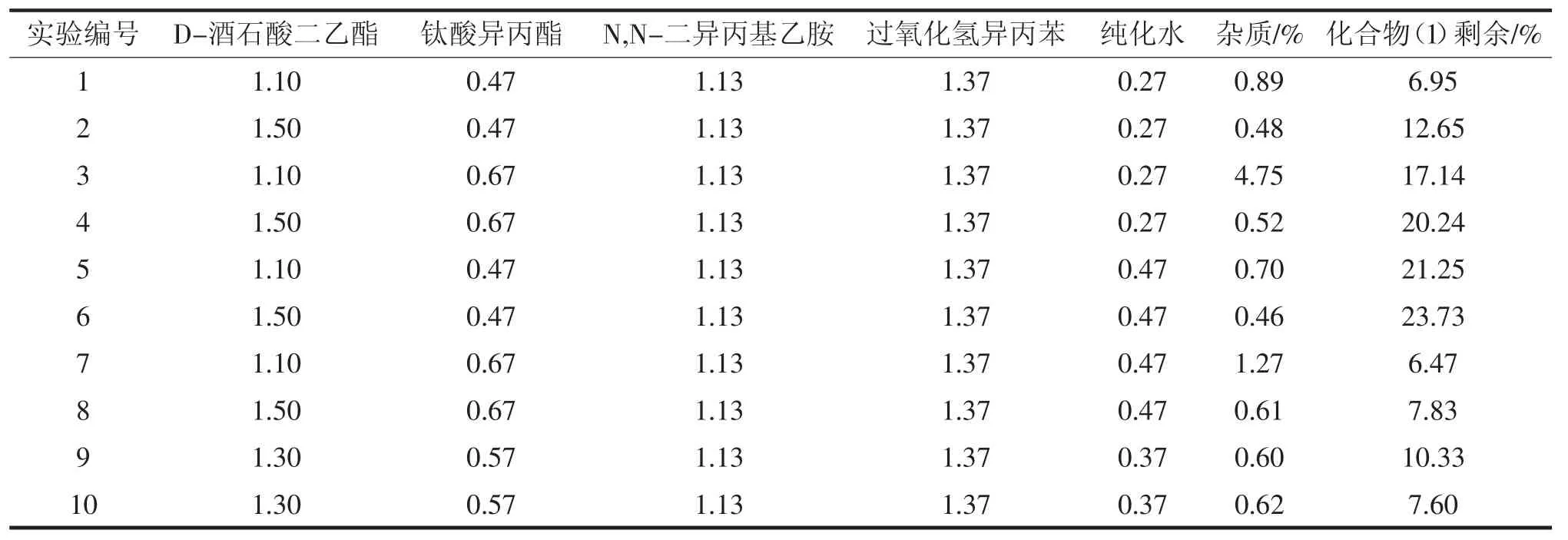
表1 铅镉离子检测灵敏度测试结果
经过DOE软件分析(等值线图)结果(见图1~6)。
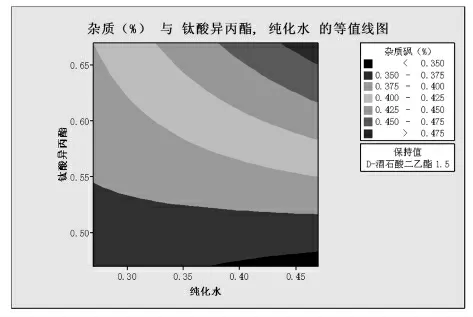
图1
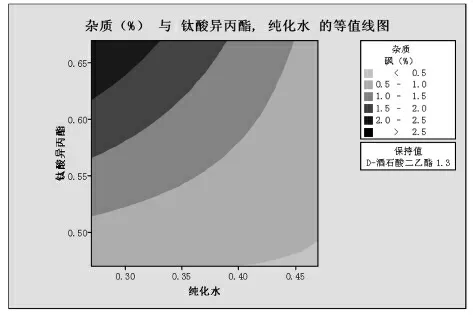
图2
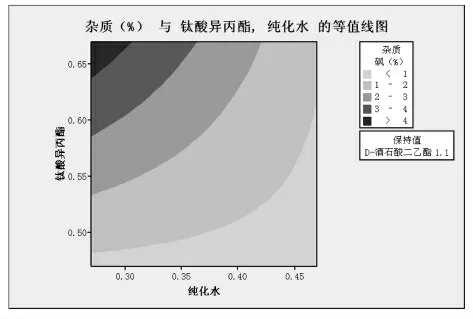
图3
由图1~3分析可知:当固定酒石酸二乙酯的量为1.5倍物质的量比时,相同水用量的条件下杂质随钛酸异丙酯的增大而增大;相同钛酸异丙酯条件下,杂质随水变化不大,略有增大;大部分杂质水平都<0.5%。当固定酒石酸二乙酯的量为1.3倍物质的量比时,相同水用量的条件下杂质随钛酸异丙酯的增大而增大;相同钛酸异丙酯条件下,杂质随水变化不大,略有减小;大部分杂质水平都<2.5%。当固定酒石酸二乙酯的量为1.1倍物质的量比时,相同水用量的条件下杂质随钛酸异丙酯的增大而增大;相同钛酸异丙酯条件下,杂质随水变化不大,略有减小;大部分杂质水平都<4%。所以酒石酸二乙酯的量是影响杂质砜产生的最主要因素,随着酒石酸二乙酯的量的增加,杂质砜小于1.0%的区域面积显著增加。
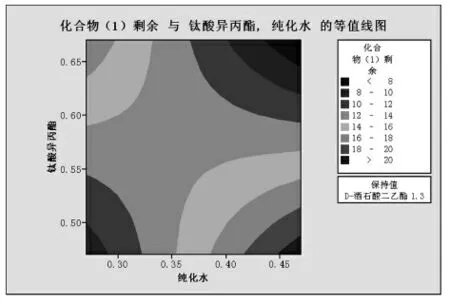
图4
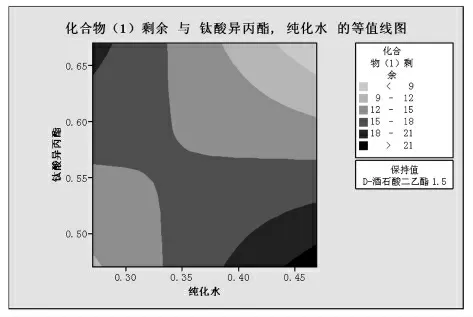
图5
由图4,5分析可知:钛酸异丙酯与水的交互作用影响化合物(1)的剩余,但是化合物(1)的剩余可以通过延长反应时间来进一步降低。在满足成本及杂质控制基础上,选定图6中的设计空间(矩形图)。
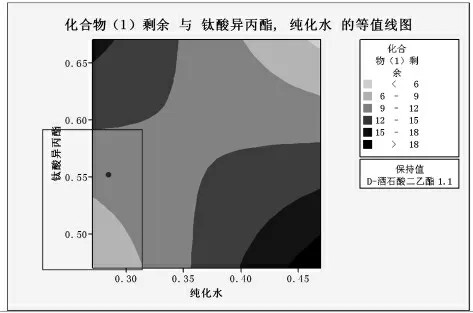
图6
结合之前的研究数据,在设计空间内选定参数:D-酒石酸二乙酯、钛酸异丙酯、水的物质的量比为1.10∶0.55∶0.33(红点)。
将得到的最优条件与原实验数据对比,实验数据见表2。
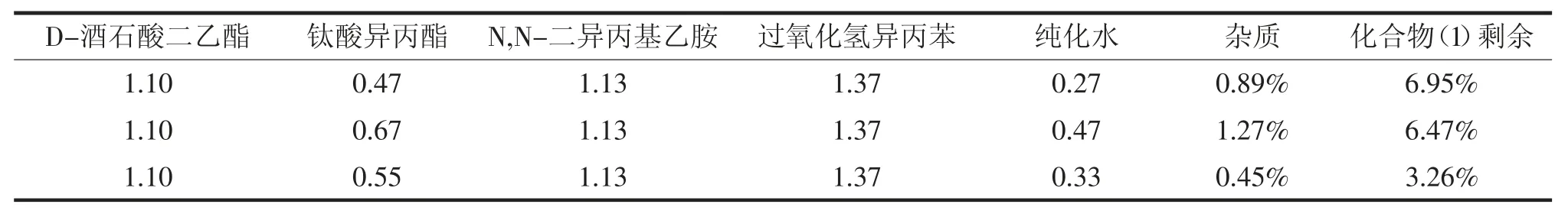
表2
上述结果表明:使用DOE优化得到的物料比进行实验,反应液的杂质生成量和原料化合物(1)的剩余都明显减小。
通过DOE实验确定的配比为化合物(1):D-酒石酸二乙酯∶钛酸异丙酯∶N,N-二异丙基乙胺∶过氧化氢异丙苯∶纯化水=1.0∶1.10∶0.55∶1.13∶1.37∶0.33。通过优化后的实验进一步验证了该投料比反应液中氧化杂质的产生明显减小,降低了反应液中氧化杂质大的风险,同时使原料反应更彻底,可以极好的降低成本,提高转化率及收率,更有利于工业化大生产。

