胰蛋白酶水解制备绿豆分离蛋白多肽的工艺
张玉霞*,梁琼,黎渊珠,邹亚男,薛梅,梁丽琴
1. 海南工商职业学院海洋学院(海口 570203);2. 海南省食品药品检验所海口分所(海口 570311);3. 海南科技职业大学化学与材料工程学院(海口 571126)4. 山西师范大学生命科学学院(临汾 041004)
胰蛋白酶是人体及动物体内普遍存在的一种蛋白水解酶[1],胰蛋白酶在pH 5.0时最稳定,可在低温下贮存数周而不丧失活性;低于此pH时酶易变性;当pH 高于5.0时,酶易自溶而失去活性[2-3]。胰蛋白酶能催化蛋白质的水解,对有碱性氨基酸(如精氨酸、赖氨酸)的羧基所组成的肽键有着高度的特异性[4]。胰蛋白酶不仅能水解肽键,而且也能水解酰氨键和酯键[5]。对其催化水解活性的敏感度为酯键>酰铵键>肽键[6]。用其来水解提取绿豆中的蛋白质,所得到的蛋白质有利于人体的吸收消化[7],并可以直接用于制作饮料、果冻、糕点等食品,且无其他副作用,可促进食品工业的发展。
试验以绿豆磨粉为原料,用胰蛋白酶进行酶解,在酶解pH、温度(T)和[酶]/[底物]([E]/[S])等单因素试验基础上,对水解条件进行正交试验,以确定胰蛋白酶提取绿豆蛋白的最佳条件。然后,对在最佳提取条件下得到的绿豆蛋白溶液进行凝胶过滤层析法纯化,最后用纯化的绿豆蛋白样品做SDS-PAGE电泳,测得其中所含的蛋白质的分子质量。此次试验结果可以为绿豆蛋白的加工和利用提供理论的依据,从而带来很好的经济效益。
1 材料与试验方法
1.1 材料与设备
1.1.1 试剂与材料
绿豆磨粉(临绿一号绿豆,九阳料理机磨粉);胰蛋白酶(USA进口、上海化学试剂站分装厂);牛血清白蛋白(Mr 6700、上海宏观生化技术有限公司);考马斯亮蓝G 250(上海绿岛科技发展有限公司生产);丙烯酰胺(C3H5HO、中国医药公司北京采购供应站);N, N’-甲叉双丙烯酰胺(C7H10N2O2、中国医药上海化学试剂公司);Sephadex G-200(上海化学试剂厂);低分子量标准蛋白(Sigma公司,电泳纯);上述试剂均为分析纯品。
1.1.2 主要仪器与设备
TGL-16G-A型高速冷冻离心机(上海安亭科学仪器厂);UV-7504C紫外分光光度计(上海欣茂仪器有限公司);LG10-2.4A型高速离心机(北京医用离心机厂);BSZ-160自动部分收集器(上海沪西分析仪器厂);HL-2恒流泵(上海嘉鹏科技有限公司);DYY-2C型电泳仪(北京市六一仪器厂);DYCZ-24D垂直电泳槽(北京市六一仪器厂);KQ50型超声波清洗器(昆山市超声仪器有限公司);XWT-S系列小型台式记录仪(上海自动化仪表股份有限公司);层析实验冷柜(北京博医康实验仪器有限公司);1×50 Z形层析柱(上海亚荣生化仪器厂);HD-2001-B-C核酸蛋白检测仪(上海嘉鹏科技有限公司)。
1.2 试验方法
1.2.1 绿豆磨粉蛋白含量及绿豆蛋白溶液多肽含量的测定
采用凯氏定氮法[8]进行测定。

1.2.2 绿豆蛋白多肽制备率的计算[9]
1.2.3 单因素法测定最佳水解条件[10-11]
1.2.3.1 最佳水解温度的测定
取10支试管,在各管加入0.5 g绿豆粉和9 mL pH 8.5的缓冲液,每两管为一平行组,分别编号为30,37,40,45和50 ℃,在每个试管中加入1 mL 0.5%胰蛋白酶液,摇匀后分别置于各温度的水浴锅中反应9h,时间到后取出置于100 ℃的水浴锅中灭酶10 min,冷却后以8 000 r/min离心10 min,取上清液定容至10 mL。用移液枪取10 μL,加990 μL蒸馏水和5 mL考马斯亮蓝溶液,2 min后在595 nm下测定吸光度。
1.2.3.2 最佳水解时间的测定[12]
取22支试管,在各管中加入0.5 g绿豆面和9 mL pH 8.5的缓冲液,每两管为一平行组,分别按2,4,6,8,10,11,12,13,14,15和16 h编号,在每个试管中加入1 mL 0.5%胰蛋白酶液,整个反应体系为10 mL,使酶/底物浓度比为1%,摇匀后置于37 ℃的水浴锅中反应。到时间后分别取两管置于100 ℃的水浴锅中灭酶10 min,冷却,以8 000 r/min离心10 min,取上清液定容至10 mL。用移液枪取10 μL,加990 μL蒸馏水和5 mL考马斯亮蓝溶液,2 min后在595 nm下测定吸光度。
1.2.3.3 最佳水解pH的测定
取14支试管,在各管加入0.5 g绿豆粉,每两管为一平行组,分别加入pH 7,7.5,8,8.5,9,9.5和10的缓冲液各9 mL,加1 mL 0.5%的酶液,置于37 ℃的水浴锅中反应9 h,时间到后分别取出置于100 ℃的水浴锅中灭酶10 min,冷却,以8 000 r/min离心10 min,取上清液定容至10 mL。用移液枪取10 μL,加990 μL蒸馏水和5 mL考马斯亮蓝溶液,2 min后在595 nm下测定吸光度。
1.2.3.4 最佳[酶]/[底物]的测定
取10支试管,在各管加入0.5 g绿豆粉和9 mL pH 8.5的缓冲液,每两管为一平行组,分别编号为0.5%,1.0%,1.5%,2.0%和2.5%,在0.5%组的试管中加入0.5 mL 0.5%胰蛋白酶液,1%的加入1 mL,1.5%的加入1.5 mL,2%的加入2 mL,2.5%的加入2.5mL,摇匀后分别置于37 ℃的水浴锅中反应9 h,时间到后取出置于100 ℃的水浴锅中灭酶10 min,冷却后以8 000 r/min离心10 min,取上清液定容至10 mL。用移液枪取10 μL,加990 μL蒸馏水和5 mL考马斯亮蓝溶液,2 min后在595 nm下测定吸光度。
1.2.4 正交试验测定最佳水解条件[13-15]
在单因素试验基础上,分别为4个因素设置3个合适的水平,因素水平如表1所示。

表1 因素水平表
1.2.5 凝胶层析法纯化绿豆蛋白多肽[16-18]
将凝胶预处理后装柱(试验所选用的柱子型号为0.9 cm×30 cm),根据预计的床体积,称取所需的Sephadex G-100干凝胶放入锥形瓶中,加入适量的蒸馏水,然后置于沸水浴中煮沸2 h。加样时要求平整的柱床平面,用滴管将清蛋白(约5 mL)缓慢而均匀地加到柱床表面,待样品渗入后,用滴管沿柱壁向柱内加入少量的洗脱液,待洗脱液距柱床表面1~2 mm时,再用滴管加入约4 cm的洗脱液,接上恒压洗脱瓶开始洗脱,并马上打开调整好的收集器开始收集,流速为5 mL/(6 min·管),收集30管。用同样的方法将球蛋白、醇溶蛋白和谷蛋白层析纯化;样品全部收集后,在280 nm波长处测定其吸光度,并绘制洗脱曲线。
1.2.6 绿豆多肽的超滤膜分离[19-20]
配制5%浓度的绿豆多肽酶解液,首先用截留分子质量为5 kDa的超滤膜进行一级超滤处理,压力0.18 MPa。其次用截留分子质量为1 kDa的超滤膜对滤过液进行二次处理,压力为0.21 MPa。
1.2.7 绿豆蛋白多肽的氨基酸组成分析[21]
在最佳工艺条件下制备绿豆蛋白多肽,采用高效液相色谱仪测定其氨基酸组成。
2 试验结果与分析
2.1 温度、时间、pH、[酶]/[底物]对绿豆蛋白提取率的影响
2.1.1 温度对提取率的影响
从图1可以看出,在37 ℃时,胰蛋白酶对绿豆蛋白多肽的制备率较高,而低于或是高于37 ℃时,提取率都很低。任何酶反应都有其最适的温度范围,低温使酶的活性基团发生钝化,随着温度的升高,酶的活性基团逐渐被释放,而当温度超过最适温度时,随着温度的升高,酶的结构发生改变,活性下降,提取率亦随之下降。胰蛋白酶在37 ℃时活性最高,这与人和动物的体温环境较为吻合,能够较好地消化食物中的蛋白质。

图1 温度对绿豆蛋白多肽制备率的影响
2.1.2 时间对提取率的影响
从图2可以看出,在15 h之前随着水解时间的延长,绿豆蛋白多肽的制备率增长趋势显著,近似正比关系;在15 h之后,水解增长趋势减缓。这主要是因为随着水解时间的延长,水解产物的浓度逐渐增大,过高的产物浓度会对水解反应产生抑制作用。
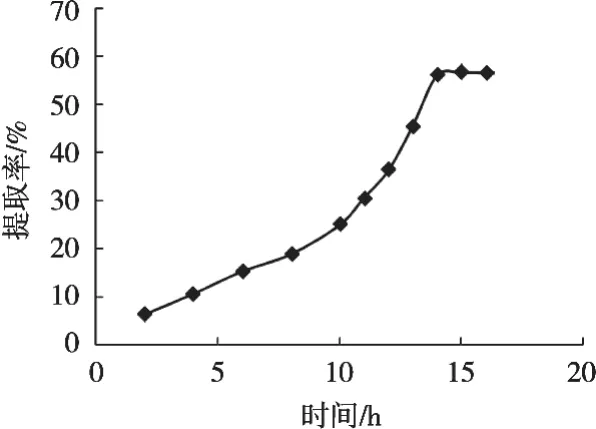
图2 时间对绿豆蛋白多肽制备率的影响
2.1.3 pH对提取率的影响
从图3可以看出,在碱性条件下,绿豆蛋白的提取率随着pH的升高而增加,在pH 8.5之前呈正比增长,pH 8.5之后增长趋势较缓慢,增长量很小。因此,在pH 8.5的条件下提取较为合适。
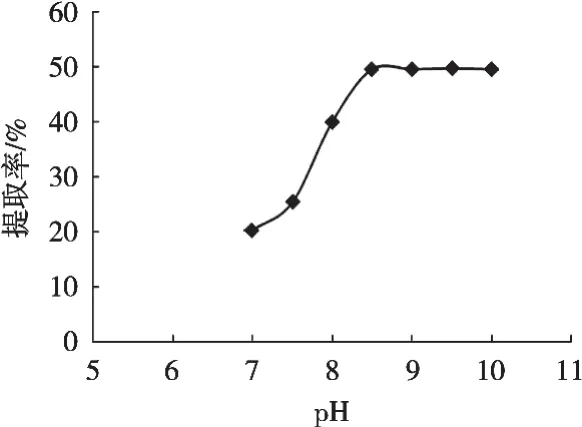
图3 pH对绿豆蛋白多肽制备率的影响
2.1.4 [酶]/[底物]对提取率的影响
从图4可以看出,随着[酶]/[底物]的增加,绿豆蛋白的提取率也在增加,在1.5%之前,提取率的增长较快,而在1.5%之后,提取率的增长较缓慢。这主要因为在底物浓度不能被酶完全饱和时,提取率随[酶]/[底物]的增加而呈正比增加,但当酶浓度逐渐增加到底物浓度不能使其饱和时,提取率不再随其呈正比增加。
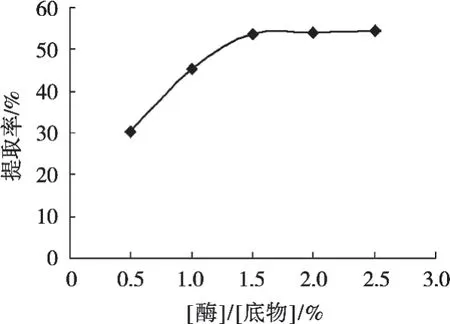
图4 [酶]/[底物]对绿豆蛋白多肽制备率的影响
2.2 正交试验确定酶解条件的最佳组合
从表2可以看出,4个因素对胰蛋白酶水解制备绿豆蛋白多肽的影响程度大小依次为A>B>D>C,其最佳组合为A3B3C3D3,即温度37 ℃,时间15 h,pH 9,酶/底物2%。此外时间越长,水解越彻底,提取率越高,但考虑到这样耗时,于生产益处不大,酶量大有利于提取率的提高,但是这样也会增加成本,且增加能耗,从表2可以看出,当酶/底物比为2%时,制备率与1.5%时相比并没有较大的提高。故适宜的酶解条件为温度37 ℃,时间15 h,pH 9,酶/底物1.5%。
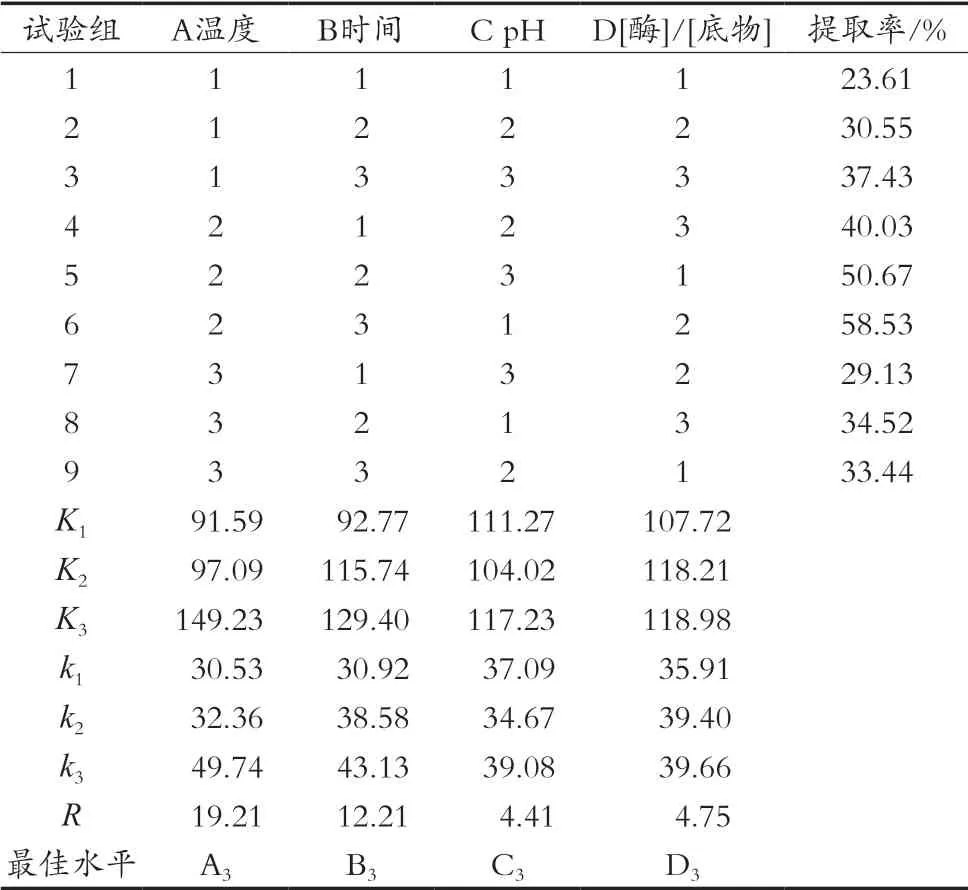
表2 正交试验结果
2.3 凝胶层析
从图5可以看出,从1~38管之间均有吸光度,即均含有蛋白质,高峰管为16~21管之间,从1~38管中选取几管用作SDS-PAGE电泳。

图5 绿豆蛋白的层析图谱
2.4 超滤膜分离绿豆蛋白多肽
绿豆蛋白水解液经超滤膜超滤分离,共得到3个分子质量组分的多肽,分别为<1 kDa,1~5 kDa以及>5 kDa。对3个组分进行比例分析,其所占比例分别为35.63%,56.24%及8.13%,这说明胰蛋白酶酶解后的绿豆蛋白多肽的分子质量大多<5 kDa,有利于人体吸收。
2.5 绿豆蛋白中氨基酸组成
绿豆蛋白在酸水解过程中,色氨酸被破坏,天冬酰胺和谷氨酰胺被水解成天冬氨酸和谷氨酸,因而表3中天冬氨酸和谷氨酸的含量都很高。与8种必需氨基酸的FAO/WHO推荐值相比,绿豆蛋白中的Val(缬氨酸)、Ile(异亮氨酸)、Leu(亮氨酸)、Phe(苯丙氨酸)及Lys(赖氨酸)含量分别都比较高,除了Cys(半胱氨酸)含量较低外,其余必需氨基酸含量均接近或达到FAO/WHO推荐值,整体氨基酸含量较均衡,因而具有蛋白质开发应用价值。
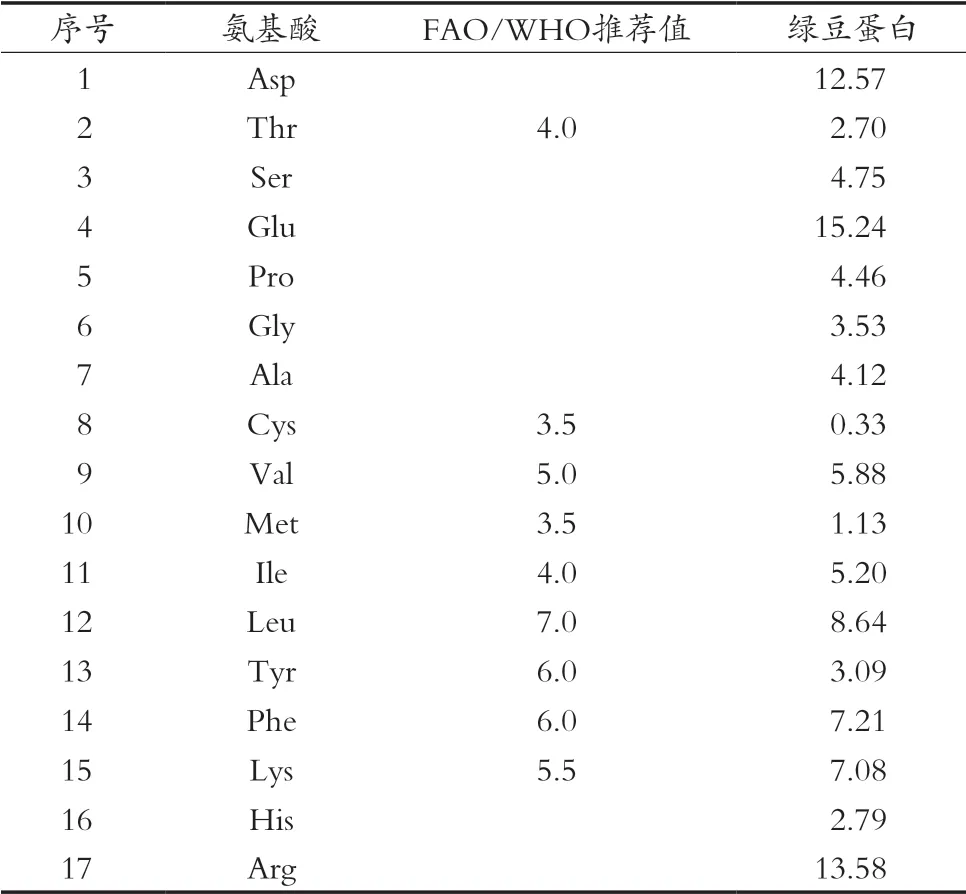
表3 绿豆蛋白的氨基酸组成及含量 单位:g/100 g蛋白
3 结论
1) 绿豆磨粉在胰蛋白酶作用下水解生成绿豆水解蛋白液,其最佳水解条件为酶解温度37 ℃,pH 9.0,时间15 h。[酶]/[底物]1.5%。在此条件下,胰蛋白酶1次制备绿豆蛋白多肽的提取率可达60.50%。
2) 利用超滤膜对绿豆多肽酶解液超滤分离,共得到3个分子质量组分的多肽,分别为<1 kDa,1~5 kDa以及>5 kDa。对3个组分进行比例分析,其所占比例分别为35.63%,56.24%及8.13%,这说明胰蛋白酶酶解后的绿豆蛋白多肽的分子质量大多<5 kDa,有利于人体吸收。
3) 高效液相色谱分析绿豆蛋白多肽的氨基酸组成,将结果与8种必需氨基酸的FAO/WHO推荐值相比,绿豆蛋白多肽中的Val(缬氨酸)、Ile(异亮氨酸)、Leu(亮氨酸)、Phe(苯丙氨酸)及Lys(赖氨酸)含量分别都比较高,除了Cys(半胱氨酸)含量较低外,其余必需氨基酸含量均接近或达到FAO/WHO推荐值,整体氨基酸含量较均衡。

