大孔树脂纯化纵条纹炭角菌中环肽Xylastriamide A工艺
任志洋,唐凡淋,袁小红*
西南科技大学生命科学与工程学院(绵阳 621000)
纵条纹炭角菌(Xylaria striataPat. 1887)为子囊菌门(Ascomycota)炭角菌科(Xylariaceae)炭角菌属(XylariaHill ex Schrank)真菌,生长范围主要在腐朽树皮和活树根上[1]。前期对纵条纹炭角菌进行多年研究,包括纵条纹炭角菌子实体的培养[1]、液体培养优化[2-3]、子实体化学成分研究[4]及抗菌活性方案[5]、抗肿瘤活性[6]等,为纵条纹炭角菌的开发利用提供基础。从炭角菌属真菌的菌丝体中分离得到多种新颖的化合物,且证明其具有良好的生物活性[7]。环肽物质因其特殊的结构和构象关系[8]而具有较好的抗肿瘤、抗癌活性[9],其在新药开发中得到了极大的重视。雷传文[10]运用多种色谱技术从纵条纹炭角菌中分离得到一种新的环肽Xylastriamide A,其作为一种新颖的环肽类物质,发现具有显著的抗肿瘤活性,并且对秀丽隐杆线虫也有一定的抗虫活性,表明该环肽有着极大的研究价值和应用前景。
该类化合物传统的分离方法[11]是通过一系列的色谱技术进行纯化,从而获得单体物质,该法步骤多且效率低,会耗费大量的溶剂和时间,且固相吸附严重。为更好地对环肽Xylastriamide A进行研究开发,有必要改良该环肽的分离纯化过程,从而为该环肽的进一步分析提供基础保障。大孔吸附树脂因其吸附效果好,操作简便,可反复使用的特性,被广泛运用于中药材的有效成分富集及分离纯化工艺中[12-13]。为很好地对环肽Xylastriamide A进行分离,试验以纵条纹炭角菌为材料,采用不同型号、性能的树脂对纵条纹炭角菌环肽进行吸附、解吸试验,筛选出最适宜分离该环肽的树脂,并对纵条纹炭角菌环肽分离纯化条件进行优化,以达到对环肽富集的效果,为纵条纹炭角菌的开发利用奠定基础。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
纵条纹炭角菌(2012年7月由贺新生教授采于西南科技大学杨树桩,鉴定为炭角菌科炭角菌属纵条纹炭角菌Xylaria striataPat. 1887)。
盐酸(分析纯);氢氧化钠(分析纯);无水乙醇(分析纯);乙腈(色谱纯);超纯水。
根据环肽Xylastriamide A的极性,故选择不同型号的大孔树脂来进行后续研究。

表1 不同型号的大孔吸附树脂参数
1.1.2 仪器与设备
XJ-2小型提取浓缩机组(天津大明制药设备厂);高效液相色谱仪(Agilent Technologies 1260Infinity);色谱柱(Agilent ZORBAX Eclipse XDB-C18,4.6 mm×250 mm,5 μm);SHB-Ⅲ 循环水式多用真空泵;Rotavapor R-210旋转蒸发仪。
1.2 方法
1.2.1 纵条纹炭角菌粗提液制备
取纵条纹炭角菌子实体,粉碎过孔径0.425 mm筛,按料液比1︰5(g/mL)加入90%乙醇在70 ℃下浸提3次,每次2 h,合并滤液,旋转蒸发浓缩至浸膏后,加入蒸馏水溶解,得到纵条纹炭角菌粗提液。
1.2.2 纵条纹炭角菌中环肽Xylastriamide A含量测定
采用HPLC法,准确称取1 mg纵条纹炭角菌环肽Xylastriamide A标准品,用乙腈将其溶解,配成一系列的质量浓度梯度溶液。按照流动相采用乙腈-水(65︰35),流速1.0 mL/min,检测波长216 nm,进样量20 μL,柱温35 ℃,等度洗脱的方式,在该条件下测定目标物峰面积,以峰面积(Y)和环肽质量浓度(X)作图,得标准回归曲线方程为Y=32.789X+2.198 6(R2=0.999 6),线性关系良好。
1.2.3 大孔树脂预处理[14]
将新购买的大孔树脂(H103、HP20、D101、AB-8)用无水乙醇浸泡过夜,使其充分溶胀,再湿法装柱,用乙醇洗至流出液不浑浊为止,用蒸馏水冲洗至无醇味。依次酸洗,用2 BV的5%盐酸溶液浸泡4 h,用蒸馏水洗至中性;碱洗,用2 BV的2%氢氧化钠溶液浸泡4 h,用蒸馏水洗至中性。备用。
1.2.4 大孔树脂筛选
分别取预处理好的不同类型的大孔树脂(AB-8、D101、HP20、H103)适量,用滤纸吸干水分后,各自称取1 g于100 mL锥形瓶中,加入20 mL的纵条纹炭角菌粗提物,置于摇床中(25 ℃,120 r/min)静态吸附24 h。各自取一定量上清液测定环肽Xylastriamide A浓度,按式(1)计算出各树脂对该环肽的吸附率。将大孔树脂取出,用滤纸吸干表面提取液,加入100%乙醇20 mL进行静态解析,解吸液经HPLC测定环肽含量并按式(2)计算各树脂对该环肽的解析率。
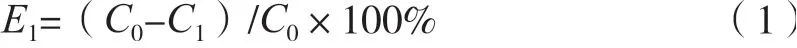
式中:E1为树脂的吸附率,%;C0为吸附液中环肽的初始质量浓度,mg/mL;C1为吸附后剩余的环肽质量浓度,mg/mL。

式中:E2为树脂解吸率,%,C0为吸附液中环肽初始质量浓度,mg/mL;C1为吸附后剩余环肽质量浓度,mg/mL;C2为解吸液中环肽质量浓度,mg/mL;V1为吸附液体积,mL;V2为解吸液体积,mL。
1.2.5 大孔树脂静态吸附研究
取处理好的D101树脂,用滤纸吸干水分,称取1 g于100 mL锥形瓶中,加入20 mL的纵条纹炭角菌提取液,置于摇床中(25 ℃,120 r/min)静态吸附24 h,并分别在1,2,3,4,6,8和12 h取样进行HPLC检测,测定环肽Xylastriamide A含量,按式(3)测量吸附量,作吸附量-时间图。
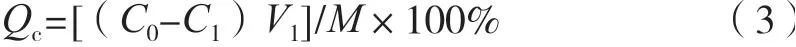
式中:Qc为树脂的吸附量,mg/g;C0为吸附液中环肽的初始质量浓度,mg/mL;C1为吸附后剩余的环肽质量浓度,mg/mL;V1为吸附液体积,mL;M为树脂质量,g。
1.2.6 大孔树脂对该环肽的动态吸附条件优化[15]
1.2.6.1 不同上样流速对大孔树脂吸附效果的影响
取100 mL质量浓度3 mg/mL的纵条纹炭角菌提取液,改变上样流速进行动态吸附,柱体积(BV)为30mL,分别以1,2,3,4和5 BV/h的流速上柱吸附,收集流出液,计算吸附率。作吸附率-流速图。
1.2.6.2 不同上样浓度对大孔树脂吸附效果的影响
取4份3 mL质量浓度100 mg/mL的纵条纹炭角菌提取液,分别加入297,97,57和39.8 mL用水制成1,3,5和7 mg/mL的混悬液,柱体积(BV)30 mL,流速2 BV/h,以不同质量浓度上柱吸附,收集流出液,计算吸附率。作吸附率-质量浓度图。
1.2.6.3 不同上样量对大孔树脂吸附效果的影响
取质量浓度3 mg/mL的纵条纹炭角菌提取液,以2 BV/h的吸附流速上柱,每处理1 BV样液(1 BV=30 mL)的流出液单独收集,测定流出液中的环肽Xylastriamide A浓度。流出液中该环肽质量浓度达到上样液质量浓度的10%时,确定树脂的吸附已达到饱和[16]。作流出液质量浓度-流出液体积图。
1.2.7 大孔树脂对该环肽的动态解吸条件优化
1.2.7.1 不同体积分数乙醇对大孔树脂解吸条件的影响
取质量浓度3 mg/mL的纵条纹炭角菌提取液7 BV(5份),分别以2 BV/h上柱吸附,收集流出液,计算吸附量,用3 BV的40%乙醇解吸,测定流出液中环肽Xylastriamide A含量,分别用60%,70%,80%,90%和100%乙醇溶液进行解吸,解吸流速为2 BV/h,收集解吸液,测定环肽Xylastriamide A浓度,计算解析率,比较不同体积分数解吸剂对大孔树脂解吸效果的影响。
1.2.7.2 洗脱剂量对大孔树脂解吸条件的影响
取质量浓度3 mg/mL的纵条纹炭角菌提取液7 BV,以2 BV/h上柱吸附,收集流出液,计算吸附量,用3 BV的40%乙醇洗去杂质,用100%乙醇溶液进行洗脱,每1 BV单独收集,测定环肽Xylastriamide A浓度。作流出液质量浓度-洗脱液量体积图。
1.2.8 纯化工艺验证
取质量浓度3 mg/mL的纵条纹炭角菌提取液7 BV,以2 BV/h上柱吸附,收集流出液,计算吸附量,用3BV的40%乙醇洗去杂质,用3 BV的100%乙醇溶液进行解吸。平行操作3次,按最佳工艺条件,通过HPLC分析大孔树脂处理前后环肽Xylastriamide A占比。
2 结果与分析
2.1 大孔树脂的筛选
由表2可以看出,4种大孔吸附树脂对纵条纹炭角菌中环肽的吸附和解吸效果不同。在这4种大孔树脂中,HP20、D101、AB-8均对纵条纹炭角菌中环肽有着较好的吸附率和解析率,但D101的吸附率最大,解析率适中,且D101更加适合工业生产使用,因此,综合考虑,选用D101作为纯化纵条纹炭角菌中环肽的最佳树脂。

表2 不同型号的大孔吸附树脂筛选
2.2 大孔树脂静态吸附动力学曲线
由图1可以看出,D101大孔树脂在0~4 h之间,吸附量随着时间延长呈现急剧增加趋势,为快速吸附阶段;在4~6 h之间,吸附量增加不明显,为慢速吸附阶段;6 h以后,吸附量的变化不大,树脂的吸附已经接近饱和。故在实际应用中,综合考虑生产周期、效率等因素,上柱液静态吸附最佳时间为6 h。
2.3 大孔树脂对该环肽的动态吸附条件优化
2.3.1 不同上样流速对大孔树脂吸附效果的影响
由图2可知,随着上样流速增加,环肽的吸附率不断降低。可能是上样流速较慢时,该环肽在柱中下降的速度较慢,有利于该环肽在树脂内的扩散,让树脂与该环肽得以更加充分的接触和吸附,上样流速变快时,上样液中的环肽成分未能充分的扩散到树脂内就被冲出柱外,使树脂对环肽的吸附率降低。对照图2,1和2 BV/h时均有较大的吸附率,综合时间考虑,选择2 BV/h为最佳上样流速。
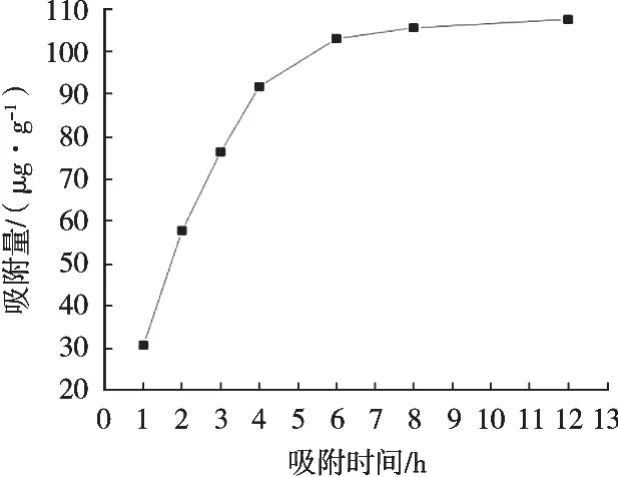
图1 大孔吸附树脂静态吸附动力学曲线

图2 上样流速对D101大孔树脂吸附效果的影响
2.3.2 不同上样质量浓度对大孔树脂吸附效果的影响
由图3可知,D101树脂吸附率随着上样液质量浓度增加而降低,1 mg/mL时对应的吸附率最大,这也符合低质量浓度有利于吸附的原则。随着上样质量浓度增加,吸附率下降程度逐渐增大,可能是上样质量浓度大时,环肽对于大孔树脂的吸附存在竞争,同时上样质量浓度过大会导致大孔树脂柱堵塞,影响使用。1和3 mg/mL的吸附率相差不大,综合时间、效率考虑,选择3 mg/mL为最佳上样质量浓度。
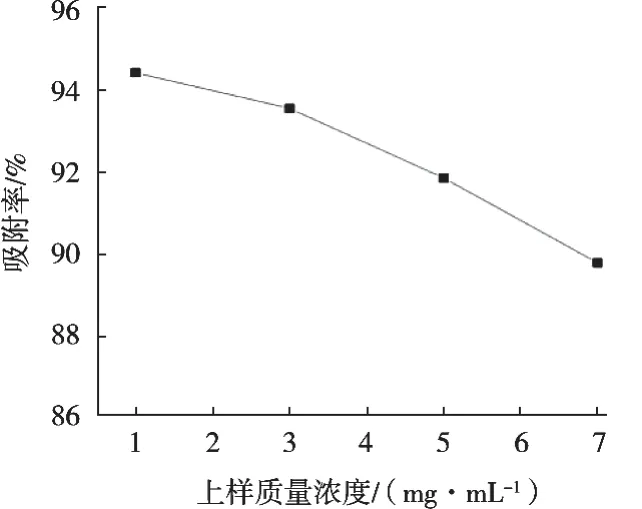
图3 上样质量浓度对大孔树脂吸附效果的影响
2.3.3 不同上样量对大孔树脂吸附效果的影响
由图4结果可以看出,随着上样量增加,流出液中环肽质量浓度不断增加,根据泄漏点的定义,上样量7 BV时,此时的流出液中环肽质量浓度达到上样液中环肽质量浓度的10%,继续增加上样量,会使流出液环肽质量浓度继续增加。因此,优选最佳上样量为7 BV。
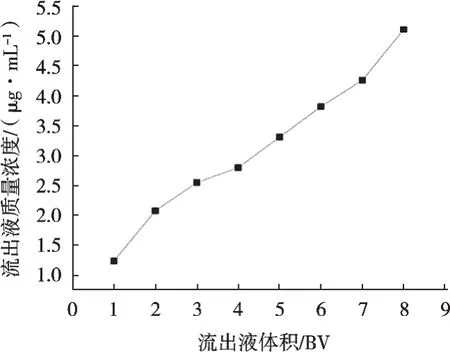
图4 上样量对大孔树脂吸附效果的影响
2.4 大孔树脂对该环肽的动态解吸条件优化
2.4.1 不同体积分数乙醇对大孔树脂解吸条件的影响
由图5可知,体积分数40%的乙醇进行洗脱时,流出液中检测不到环肽,说明40%乙醇不能使目标物洗脱,即可以用来除去杂质;乙醇体积分数60%时,环肽开始有少量泄露;随着乙醇体积分数增大,解吸率也随之提高,乙醇体积分数100%时,解吸率最高。因此,优选100%乙醇作为洗脱液。
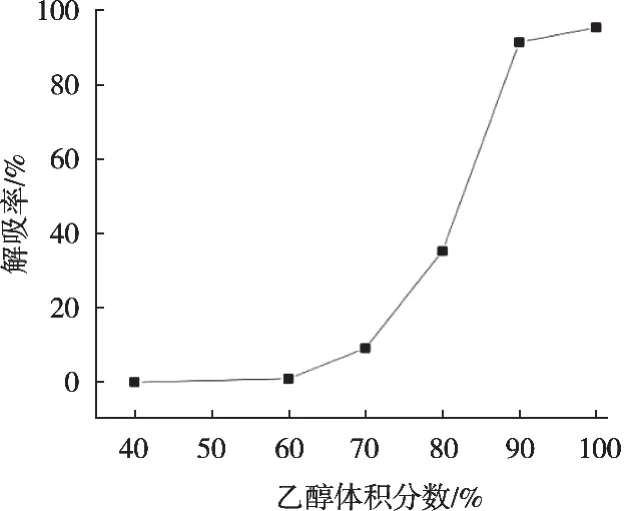
图5 乙醇体积分数对大孔树脂解吸条件的影响
2.4.2 洗脱剂量对大孔树脂解吸条件的影响
由图6可知,洗脱液中环肽含量随洗脱液增加而呈现先上升后下降趋势,洗脱量达到3 BV时,流出液中环肽含量较低,此时环肽基本被洗脱,因此最佳洗脱剂量为3 BV。
2.5 纯化工艺验证
结果见表3,可以得出,纵条纹炭角菌粗提物中Xylastriamide A纯度为4.13%,经过大孔树脂纯化后,该环肽含量平均纯度为39.63%,纯化后该环肽纯度有极大提高,说明D101对纵条纹炭角菌中的环肽Xylastriamide A纯化效果良好。
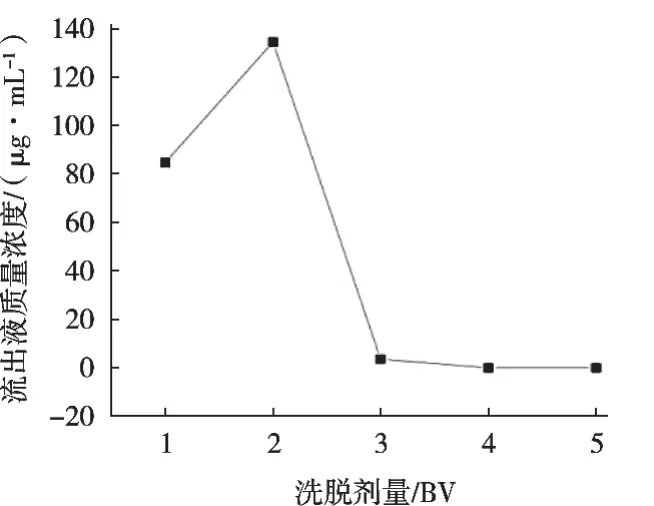
图6 洗脱剂量对大孔树脂解吸条件的影响
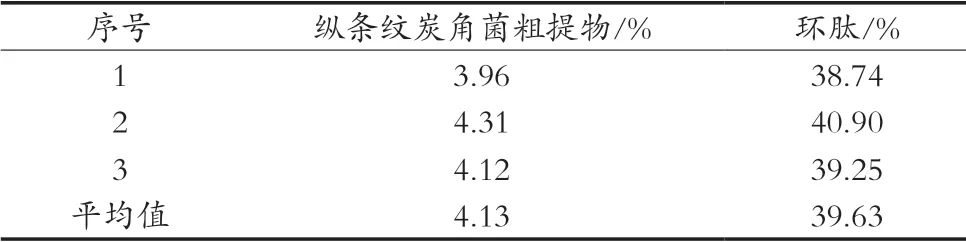
表3 Xylastriamide A在大孔树脂中纯化前后对比
3 结论与讨论
通过比较4种大孔吸附树脂(H101、HP20、D101、AB-8)对纵条纹炭角菌中环肽Xylastriamide A的吸附-解析效果影响,同时对D101大孔树脂的静态吸附及静态动力学进行研究,结果表明,D101大孔树脂对纵条纹炭角菌中环肽Xylastriamide A具有较好的吸附-解吸作用,且综合成本考虑,选用D101大孔吸附树脂来分离纯化纵条纹炭角菌中环肽。
D101大孔树脂对纵条纹炭角菌中环肽动态吸附-解吸的最佳工艺条件为上样液质量浓度3 mg/mL,上样流速2 BV/h,上样量7 BV;解吸时用40%乙醇3 BV洗去杂质,用100%乙醇3 BV解吸,解吸流速2 BV/h。
D101大孔树脂经过多次的吸附-解吸试验,其依然具有良好的吸附效果,说明D101大孔树脂具有较好的重复利用性,且树脂预处理简单,成本低廉,安全无害,适合工业生产或者大规模利用。采取该工艺分离纵条纹炭角菌中环肽Xylastriamide A可以减少环肽损失,提高环肽纯度,也为用D101树脂来分离纯化其他类型的环肽研究奠定基础,提供一定参考价值。

