实验室模拟滨海盐沼潮滩高程对互花米草生长的影响
滕康, 唐洪根, 詹泸成, 葛振鸣, 辛沛,3,*
实验室模拟滨海盐沼潮滩高程对互花米草生长的影响
滕康1, 唐洪根1, 詹泸成1, 葛振鸣2, 辛沛1,3,*
1. 河海大学水利水电学院, 南京 210098 2. 华东师范大学河口海岸学国家重点实验室, 上海 200241 3. 河海大学水文水资源与水利工程科学国家重点实验室, 南京 210098
为探究滨海盐沼湿地潮滩高程对互花米草生长的影响, 设置六组不同高度的土柱, 通过移栽互花米草进行模拟实验, 研究不同高程带来的土壤水盐差异及植株生长响应情况。结果表明: (1)土壤含水率随高程的增加呈现出明显降低趋势, 30 cm高程含水率最高, 为46.4%, 180 cm高程含水率最低, 为34.1%, 土壤孔隙水盐度随高程变化的趋势不明显, 180 cm高程孔隙水盐度最高, 为47.2 ppt, 150 cm高程孔隙水盐度最低, 为28.3 ppt; (2)不同高程下, 互花米草的株高、生物量和根冠比呈现出显著性差异(= 0.01,= 0.03,= 0.02, 均小于0.05), 株高、生物量随潮滩高程增加不断降低, 其中株高最大值较最小值多34.6%, 生物量最大值较最小值多49.5%, 植株根冠比与高程呈负相关关系, 根冠比最大值较最小值增加72.4%; (3)互花米草株高与土壤含水率呈二次抛物线关系(2= 0.79), 植株整体生物量与土壤含水率之间呈线性关系(2= 0.87), 而株高、生物量与土壤孔隙水盐度无明显的相关性。基于实验得出, 湿地高程带来淹水频率和地下水位差异, 使土壤水盐随高程产生变化, 进而造成潮滩较高处的互花米草株高、生物量高于潮滩较低处。
高程; 含水率; 盐度; 互花米草; 生长响应
0 前言
互花米草()为禾本科米草属多年生植物, 自1979年用于生态工程被陆续引入我国后, 凭借其较强的耐淹、耐盐特性和繁殖扩张能力在我国滨海淤泥质潮滩迅速扩张, 已成为优势物种之一[1-4]。互花米草在为湿地生物提供栖息地、湿地固碳和促淤造陆等方面发挥不可替代的作用, 它的入侵对湿地的生态功能和可持续发展也产生了一些负面影响, 因此研究互花米草对滨海盐沼湿地保护和修复具有重要价值[5-6]。
很多学者认为淹水频率、土壤含水率、土壤盐度、通气条件等是影响盐沼植物生长的主要环境因子[7-11], 在周期性的潮汐淹没下, 盐沼湿地中土壤含水率、盐度等土壤特征随高程呈现出明显的梯度变化趋势, 造成互花米草等潮间带植物在不同高程的生长差异, 进而影响盐沼湿地的植被群落格局。环境的改变以及植物本身对生境的适应能力, 是影响植被分布的关键, 针对滨海湿地植被生长已开展了较多研究。Pinnings等[12]通过移栽不同高程上生长的植物确定不同种类植被的分布机理, 提出潮汐、盐度和物种间竞争是影响植被分布的主要因素, 而Kirwan等[13-14]通过在野外建立不同高度生长环境来模拟潮汐作用对滨海湿地植被的影响, 发现植物生长和淹没频率相关联。陈伟霖等[15]基于室内湿地模拟系统, 比较不同盐度培养下的互花米草生长状况和生理特性, 发现互花米草对盐度的适应性较强, 但高盐度对其生长有一定的限制作用。滨海湿地由于受到潮水的周期性淹没, 使得不同湿地高程面临不同的淹没频率和地下水位, 造成含水率、盐度等环境因子的差异, 这种环境胁迫导致滨海植物生长和光合作用等生理特性发生变化[16-19], 影响滨海湿地植物生长和群落格局演化。
目前, 针对不同高程下潮间带土壤环境条件对植被生长的影响研究, 多是通过现场采样进行分析研究, 通过可控物理试验的研究较少。本研究以互花米草为实验对象, 探究潮汐作用下, 不同高程引起的土壤水盐差异对互花米草生长的影响。
1 材料与方法
1.1 实验材料
实验选用的互花米草和土壤均取自中国江苏省东台市弶港镇条子泥滩涂区域(32°46′N, 120°57′E)。2018年3月, 获取株高相近的互花米草幼苗, 带回实验室进行培养, 待成活后移栽进行实验研究。土壤取自互花米草取样地附近, 这种移栽保证了实验材料接近野外实际状况。
1.2 实验方法
1.2.1 实验设计
实验装置模拟不同高程带来的环境因子差异, 分析互花米草对不同土壤条件的生长响应。如图1所示, 装置由6组不同高度、内径为30 cm的有机玻璃培养管组成, 依据野外的潮汐变化情况, 培养管高度从低到高分别为30 cm、60 cm、90 cm、120 cm、150 cm、180 cm, 同时每组高度有4个平行样本, 共计24个培养管。培养管依高度放置在水槽内, 培养管底部开有筛孔, 可通过控制水槽内水深来模拟天然条件下的地下水埋深情况。将土壤填入培养管内, 使土壤深度与培养管高度相一致, 选取株高、长势相近的互花米草幼苗30株, 移栽至培养管内(植株密度约为424株·m-2), 培养管内植株密度与野外互花米草群落植株密度接近[20]。

图1 实验装置图
Figure 1 Diagram of experimental device
以水槽底部为基准, 控制水位保持在30 cm, 去除由于地下水位波动对实验造成的影响。根据在条子泥滨海湿地实测的海水盐度, 控制实验用水盐度为30 ppt, 并定期检测槽内水的盐度, 通过加海盐或加水等处理使地下水盐度稳定, 定期换水。根据条子泥湿地潮汐涨落特征, 实验设置15天为一个大小潮的淹没周期, 最大潮的潮振幅设置为1.5米, 角速度为30 °/h。按照实验设置的高程梯度, 大潮期可淹没土壤表面, 而小潮期无法淹没, 并且通过设置高程的差异来产生不同的淹没频率。因此, 设置半月潮的前5天为淹没期, 用30 ppt盐水按照每日涨落潮时间进行顶部浇水淹没, 60 cm至180 cm生长高程的潮汐淹没天数逐渐减少, 分别为5、4、3、2、1天, 后十天不进行淹没处理, 30 cm生长高程始终处于淹没状态。设置实验于2019年4月开始, 2019年11月结束, 历经互花米草完整生长周期。
1.2.2 数据采集和分析
数据采集分析包括互花米草生长指标和土壤条件两部分, 前者包括: 株高、地上生物量、地下生物量、根冠比; 后者包括: 土壤体积含水率、土壤孔隙水盐度。实验过程中, 每月测量互花米草株高, 由于植株生长存在分蘖株, 故选取其中最高的15株植株取平均作为各培养管的代表值。实验结束后, 测量植株生物量, 将互花米草从培养管内取出, 沿土壤表面分割出地上部分与地下部分, 用水冲洗干净, 然后放入烘干机中以80 ℃烘干24 h至恒重, 再利用1‰精度的电子称称取干重得到生物量数据, 进一步计算地下生物量与地上生物量比值得到植株根冠比。在不同高程(除30 cm高程)培养管土壤内, 埋设MP406土壤水分含量传感器, 每隔30 min测量土壤深度30 cm范围的体积含水率。同样在土壤深度30 cm内, 埋设负压式取水器, 在每个潮汐周期的最后一天抽取土壤孔隙水, 并用YSI多参数水质测量仪测定孔隙水盐度。
本实验用Excel进行数据统计和计算, 用OriginPro 2017进行画图和曲线拟合, 选用SPSS 19进行单因素ANOVA显著性分析, 对于植株部分选取样本数为= 4, 误差棒选用标准差。
2 结果与分析
2.1 不同高程下土壤水盐的变化趋势
如图2a所示, 土壤含水率在实验前期小幅增加, 随着实验的进行逐渐趋于稳定波动。不同高程影响下, 土壤含水率呈现出差异, 潮汐淹没差异使得土壤含水率与生长高程之间整体成负相关, 即生长高程越高, 土壤含水率越低(由于30 cm生长高程长期处于淹水状态, 故用实验土的孔隙度来代替土壤含水率, 为46.4%)。图2b显示, 随着实验的进行土壤孔隙水盐度逐渐呈现出增大的趋势, 实验前期、后期增加缓慢, 而7、8月份由于夏季气温高、蒸发量较大, 造成浅层土壤盐分迅速累积。另外, 不同高程下潮水淹没频率、土壤含水率的差异, 使得高处土壤盐分集结更为明显, 孔隙水盐度值较大。
将整个实验期间的土壤含水率、孔隙水盐度取平均值作为对应高程下的代表值, 结果如图2c和图2d所示: 土壤含水率随高程增加逐渐降低, 从低到高的高程对应含水率值分别为46.4%、45.1%、41.9%、39.2%、35.8%、34.1%; 土壤孔隙水盐度随高程变化趋势不明显, 从低到高的高程对应盐度值分别为30.2 ppt、31.9 ppt、41.4 ppt、39.6 ppt、28.3 ppt、47.2 ppt。
2.2 不同高程下植株生长的变化趋势
如图3所示, 不同高程下互花米草株高的季节性变化趋势相同, 均表现为4—6月份生长较快, 7—9月份生长放缓, 10—11月份基本处于生长停滞阶段。不同生长高程对应的株高存在明显差异, 高程从低到高对应的平均株高分别为115.9 cm、105.0 cm、117.5 cm、137.5 cm、141.3 cm、130.4 cm。150 cm生长高程下, 互花米草植株的季节性长势最好; 60 cm生长高程下, 植株季节性长势最差。将11月株高结果与高程进行曲线拟合, 如图4所示, 发现互花米草株高与生长高程之间存在较好的二次抛物线关系(2= 0.64), 在150 cm生长高程附近存在最佳生长高程, 与60 cm生长高程相比, 株高增加了34.6%。
图5为实验结束后(11月)测得的各高程下互花米草生物量, 高程从低到高的平均生物量分别为3.91 kg·m-2、4.04 kg·m-2、3.76 kg·m-2、4.80 kg·m-2、5.06 kg·m-2、5.62 kg·m-2。不同生长高程的互花米草生物量之间有明显差异, 180 cm高程下互花米草生物量较90 cm情况增加了49.5%, 植株总体生物量、地上生物量、地下生物量与高程之间更好地成一次函数关系(相关系数分别为2= 0.87,2= 0.96,2= 0.51), 高程越高, 互花米草生物量越高, 说明淹水频率增加及地下水位增高会导致植株生物量的减少。同时发现各高程下, 植株生物量地下部分的比重均高于地上部分, 图6显示从低到高的根冠比分别为: 2.00、1.68、1.39、1.36、1.16、1.37, 30 cm高程的根冠比结果较150 cm高程最低值增大了72.4%,植株根冠比与高程呈负相关趋势(2= 0.80)。单因素方差分析结果显示, 高程对互花米草株高、生物量、根冠比的影响均达到显著水平(= 0.01,= 0.03,= 0.02, 均小于0.05)。
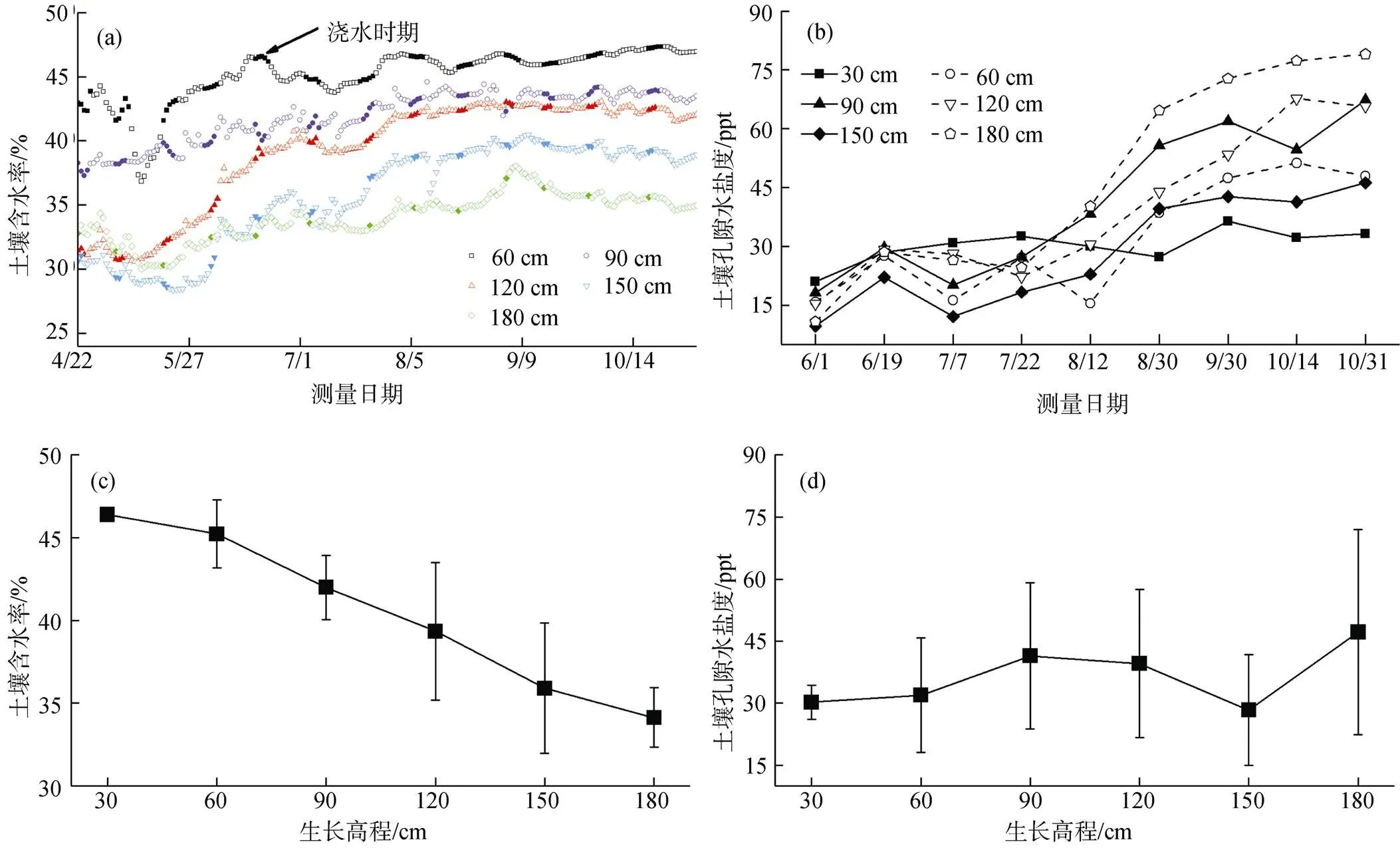
图2 不同高程土壤含水率、孔隙水盐度随时间变化趋势及平均值
Figure 2 Temporal variations and average values of soil water content and pore water salinity for different growing elevations
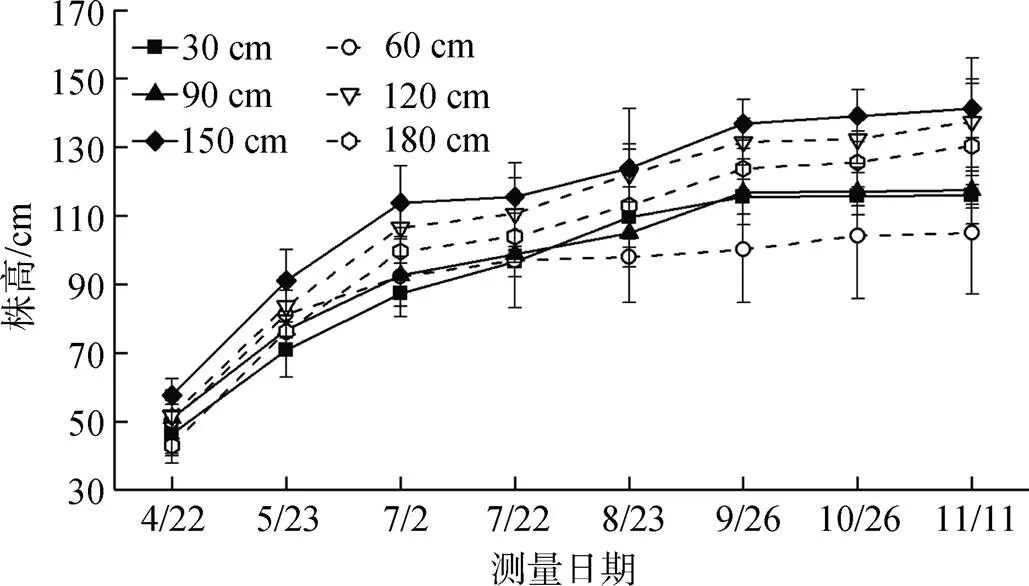
图3 不同生长高程株高随时间变化趋势
Figure 3 The temporal trend of plant height under different growing elevations
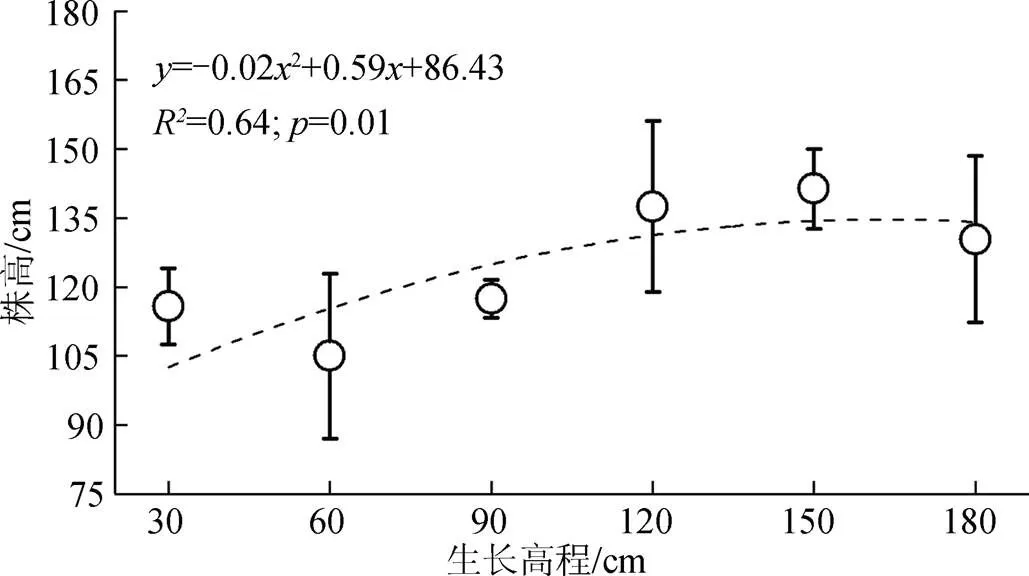
图4 株高与生长高程的关系
Figure 4 The relationship between plant height and growing elevation
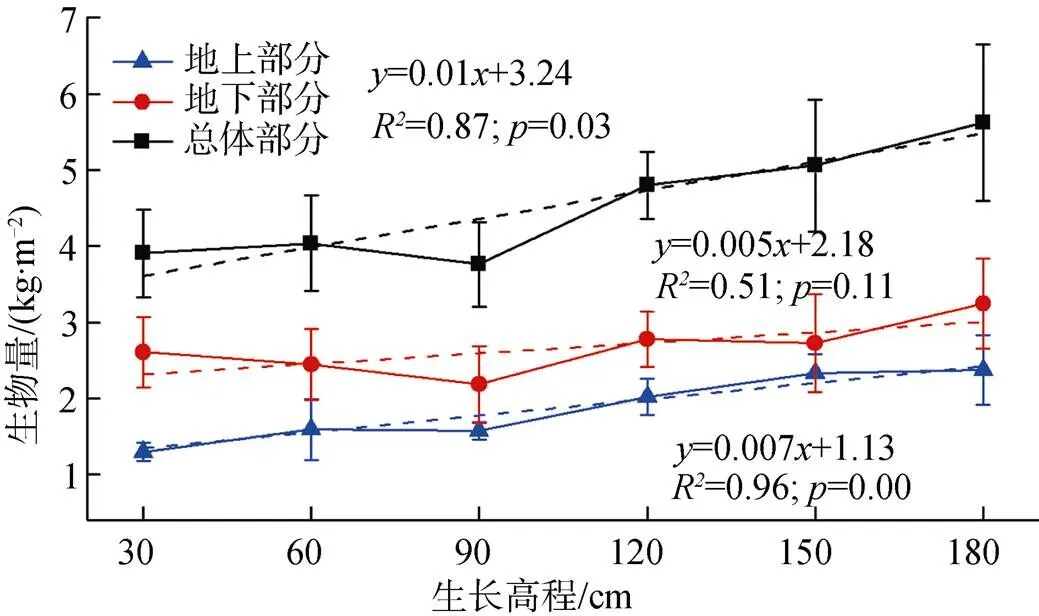
图5 生物量与生长高程的关系
Figure 5 The relationship between biomass and growing elevation
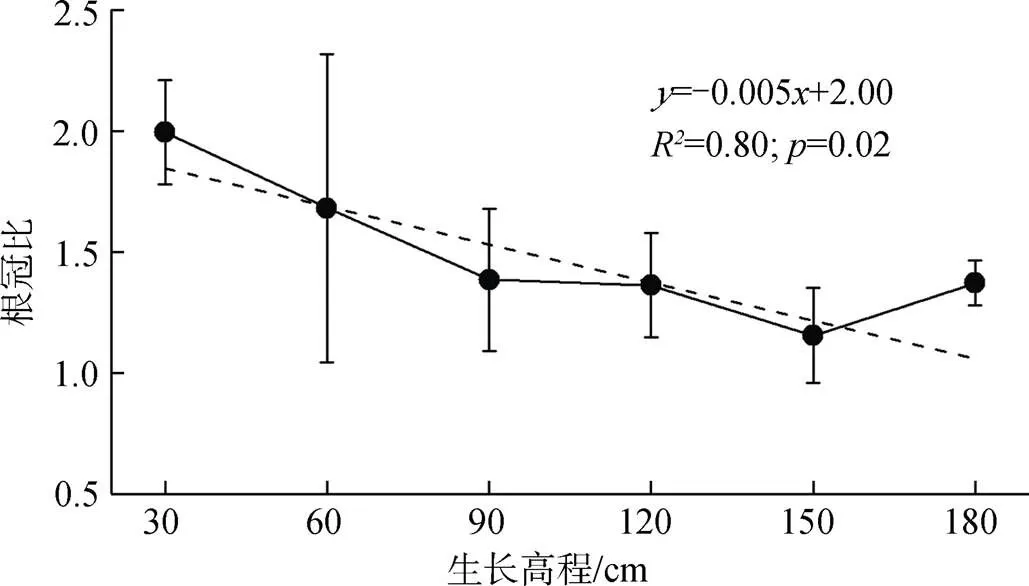
图6 不同生长高程下的根冠比
Figure 6 The rhizome ratios under different growing elevations
2.3 植物生长与土壤水盐之间关系
根据前面的结果, 不同高程下互花米草株高、生物量有着显著性差异, 这是由于不同高程所带来的潮水淹没频率和地下水埋深的差异, 影响了土壤含水率、孔隙水盐度等的变化, 进而影响着植株的生长。将所得到的互花米草株高、生物量数据与土壤含水率、土壤孔隙水盐度数据进行回归分析, 探究植物生长与不同高程土壤水盐之间的关系, 回归分析的结果如图7a—图7d所示: 株高与土壤含水率呈二次抛物线关系(2= 0.79), 最大株高对应的含水率为37.1%, 生物量与土壤含水率之间呈负相关线性关系(2= 0.87); 然而, 株高、生物量与土壤孔隙水盐度之间的相关性不强(2< 0.5), 不同盐度下的株高、生物量结果说明互花米草有着较广的盐度适应性。
3 讨论
在本实验中, 不同高程引起不同淹水频率和地下水埋深的差异, 使得不同高程土壤的含水率、孔隙水盐度有着明显的不同。前人研究结果表明, 随着潮滩高程的增加, 土壤盐度、含水率、土壤氮含量等为代表的盐沼典型环境因子呈现出明显的梯度变化[21-22]。而本实验中, 含水率、盐度指标虽整体上呈现出一定的梯度变化, 但仍有一定的复杂多变特征, 主要体现在土壤盐度上, 与典型的潮滩高程变化规律有一定的差异。如图2c和图2d所示, 含水率结果随高程呈负相关, 但是盐度结果并没有呈现出类似的相关关系。不同高程盐度变化差异较大, 在150 cm高程下出现明显降低, 这与互花米草吸盐特性、降雨冲刷、土壤下渗等因素有关。与此类似, 潘宇在崇明东滩的取样研究发现, 相对高程与土壤盐度之间并不是简单的线性相关[23]。
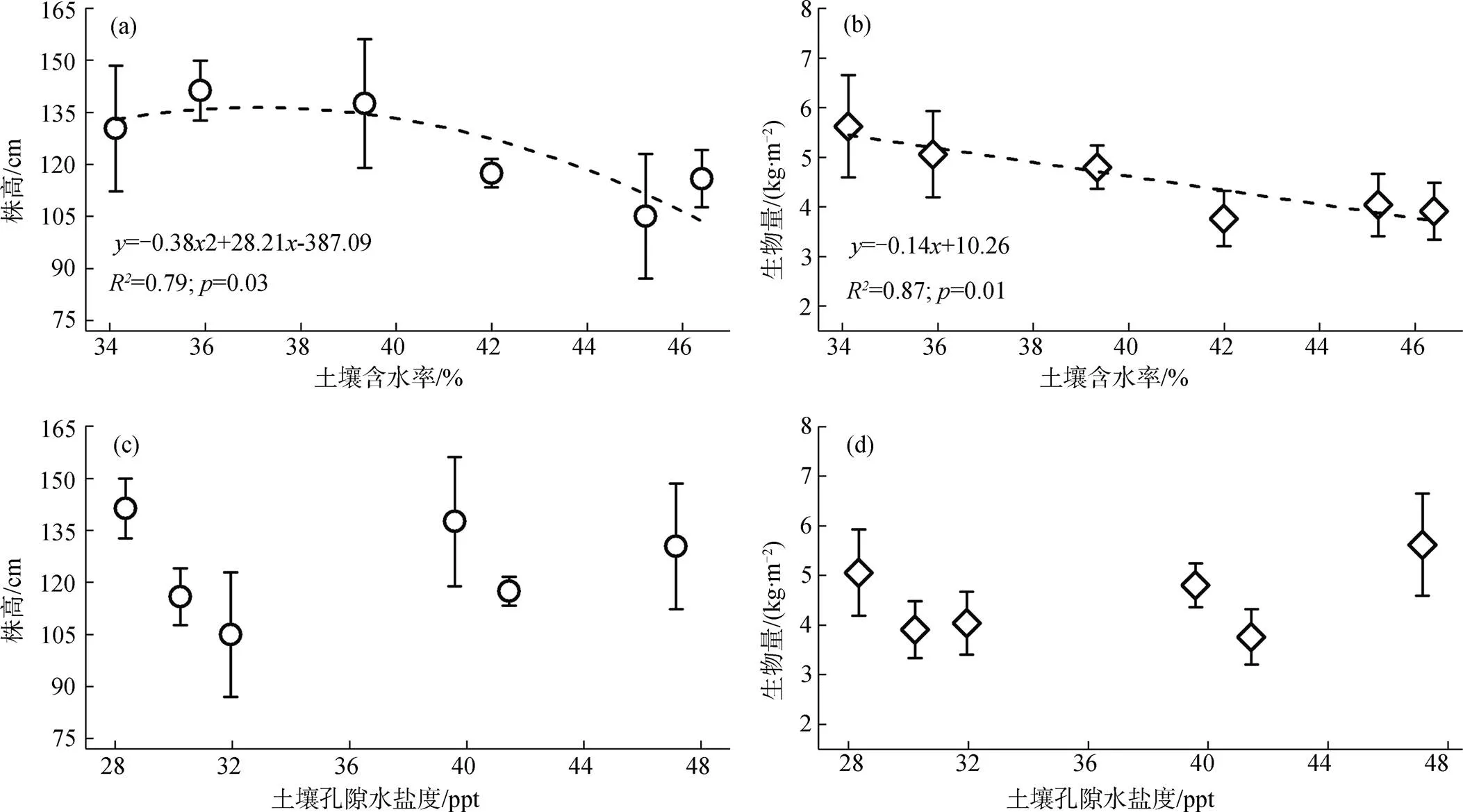
图7 各高程的土壤含水率、孔隙水盐度与株高、生物量之间的关系
Figure 7 Corresponding relationship between soil moisture content/pore water salinity and plant height /biomass at various elevations
互花米草主要分布在盐沼的中、低潮滩, 具有较广的高程分布范围[24]。本文研究结果表明, 不同生长高程条件下, 互花米草的株高、生物量表现出显著性差异(< 0.05), 30—90 cm较低高程培养管内的互花米草株高、生物量明显低于120—180 cm高度的情况(图4和图5)。虽然株高、生物量与高程之间的曲线关系分别呈二次和一次函数关系, 但在总体上随着高程的降低呈现下降趋势。生物量分配是植物对环境适应、克服环境异质性和增强入侵能力的主要对策之一[25-26], 通过根冠比结果来反映植株生物量分配的变化, 实验结果显示随着高程的降低, 总体上互花米草的根冠比呈上升趋势, 而生态因子中, 土壤水分含量对植物根冠比的影响最为显著[27-28], 实验高程设置造成淹水及地下水位差异, 使得互花米草随着高程的降低, 生物量地下部分分配逐渐增加, 地上部分逐渐减少。因此, 海平面上升态势将会对滨海湿地植被生长产生影响。
滨海盐沼系统的长期稳定性是由海平面高度、地表高度、初级生产力和沉积物补给之间的相互作用来解释的[29], 这些相互作用调节了潮滩地面的高度, 使其与平均海平面趋于平衡[30], 而Morris[31]的研究强调了滨海湿地中植物初级生产力对维持地表高度、应对海平面上升的重要意义。海平面上升最直接的影响是潮汐淹没频率和时间的增加, 改变土壤盐度和含水率, 进而对植物生长产生影响。通过对互花米草生长与土壤水盐的数据拟合发现, 互花米草的株高与土壤含水率是呈二次抛物线关系, 这与湿地演化模型采用的单峰二次生长曲线相类似[32-33]。生物量与含水率现出呈一次负线性关系, 同样Kirwan等[13]在探究狐米草的生长响应实验中也发现了相似的结果, 说明不同生长指标与含水率的拟合关系是有一定的差异性, 在选用某一生长指标作为模型条件时, 单纯的选用二次生长关系是存在偏差的。另外, 在拟合互花米草生长与盐度的关系时, 两者之间并未发现明显的相关性(2< 0.5), 同时在相关的一些盐度胁迫实验中反映出的高盐度抑制互花米草生长[15,34], 但在本实验中并没有明显的表现出来。这除了与互花米草本身的耐盐特性有关外, 还与实验本身通过设置不同高程环境来探究响应有关, 不同高程造成的含水率、盐度差异共同影响植物生长, 而不是单一考虑某一环境因素的影响, 这更加符合野外实际情况。利用本实验所得到的拟合结果, 可以根据盐沼湿地的实际含水率情况, 在一定程度上预测未来海平面上涨引起的植被生长变化情况。
互花米草根系发达, 常密布于地下30 cm深的土层内[35], 虽然本实验设计最浅土壤深度为30 cm, 但仍有部分高程下最大根长超过30 cm, 因此在今后实验中应加大土壤深度, 去除土壤深度对植物地下部分生长的影响。另外, 本文虽选取在滨海湿地占较大比重的互花米草作为研究对象, 但其他的主要滨海植被物种(海三棱藨草、芦苇等)对不同高程下土壤水盐生长响应仍需进一步研究, 从而得到较为全面的滨海植被生长响应, 为明确湿地群落演化规律, 保护和修复盐沼湿地提供科学依据。
4 结论
(1)滨海湿地不同高程引起淹水频率和地下水位的差异, 使得土壤含水率随高程呈现出负相关关系, 即生长高程越高, 土壤含水率越低; 土壤孔隙水盐度随高程变化趋势不明显, 不同高程的盐度值变化较大。
(2)不同高程下, 互花米草株高、生物量呈现出显著性差异, 总体呈现出高程越高, 株高、生物量越高的趋势, 同时高程所带来的水分环境差异影响植株的生物量分配, 植株根冠比与高程呈负相关关系。
(3)不同高程的互花米草生长与土壤水盐特征的拟合结果显示, 互花米草株高与土壤含水率呈二次抛物线关系, 生物量与含水率呈一次线性关系; 株高、生物量与土壤孔隙水盐度之间无明显的相关性。
[1] 谢宝华, 路峰, 韩广轩. 入侵植物互花米草的资源化利用研究进展[J]. 中国生态农业学报, 2019, 27(12): 1870–1879.
[2] 谢宝华, 韩广轩. 外来入侵种互花米草防治研究进展[J]. 应用生态学报, 2018, 29(10): 3464–3476.
[3] 刘明月. 中国滨海湿地互花米草入侵遥感监测及变化分析[D]. 长春: 中国科学院东北地理与农业生态研究所, 2018.
[4] 左平, 刘长安, 赵书河, 等. 米草属植物在中国海岸带的分布现状[J].海洋学报, 2009, 31(5): 101–111.
[5] 王爱军, 高抒, 贾建军, 等. 互花米草对江苏潮滩沉积和地貌演化的影响[J]. 海洋学报, 2006, 28(1): 92–99.
[6] 侯栋梁, 何东进, 洪伟, 等. 入侵种互花米草影响我国滨海湿地土壤生态系统的研究进展[J].湿地科学与管理, 2015, 11(4): 67–72.
[7] BOCKELMANN A C, BAKKER J P, NEUHAUS R, et al. The relation between vegetation zonation, elevation and inundation frequency in a Wadden Sea salt marsh[J]. Aquatic Botany, 2002, 73(3): 211–221.
[8] PENNINGS S C, CALLAWAY R M. Salt marsh plant zonation: the relative importance of competition and physical factors[J]. Ecology, 1992, 73(2): 681–690.
[9] SCHILE L M, CALLAWAY J C, SUDING K N, et al. Can community structure track sea-level rise? Stress and competitive controls in tidal wetlands[J]. Ecology and Evolution, 2017, 7(4): 1276–1285.
[10] 赵吉强, 李丽霞, 陈世华, 等. 不同盐浓度处理对互花米草生长及离子含量的影响[J]. 安徽农业科学, 2011, 39(4): 1942–1943.
[11] 袁连奇. 调控淹水胁迫对入侵物种互花米草的控制效果[D]. 上海: 华东师范大学, 2009.
[12] PENNINGS S C, GRANT M B, BERTNESS M D. Plant zonation in low-latitude salt marshes: disentangling the roles of flooding, salinity and competition [J]. Journal of Ecology, 2005, 93(1): 159–167.
[13] KIRWAN M L, GUNTENSPERGEN G R. Response of plant productivity to experimental flooding in a stable and a submerging marsh[J]. Ecosystems, 2015, 18(5): 903–913.
[14] KIRWAN M L, GUNTENSPERGEN G R. Feedbacks between inundation, root production, and shoot growth in a rapidly submerging brackish marsh[J]. Journal of Ecology, 2012, 100(3): 764–770.
[15] 陈伟霖, 梁梓娇, 缪绅裕, 等. 不同盐度下互花米草生长状况的比较研究[J]. 广东农业科学, 2017, 44(4): 67–72.
[16] SLAMA I, ABDELLY C, BOUCHEREAU A, et al. Diversity distribution and roles of overprotective compounds accumulated in halophytes under abiotic stress[J]. Annals of Botany, 2015, 115(3): 433–447.
[17] 杨娇, 厉恩华, 蔡晓斌, 等. 湿地植物对水位变化的响应研究进展[J]. 湿地科学, 2014, 12(6): 807–813.
[18] 李文, 王鑫, 潘艺雯, 等. 不同水淹深度对鄱阳湖洲滩湿地植物生长及营养繁殖的影响[J]. 生态学报, 2018, 38(9): 3014–3021.
[19] NUNES, LAÍS S C, CAMARGO A F M. Do interspecific competition and salinity explain plant zonation in a tropical estuary?[J]. Hydrobiologia, 2016, 812(1): 67–77.
[20] 赵相健, 赵彩云, 柳晓燕, 等. 不同纬度地区互花米草生长性状及适应性研究[J]. 生态科学, 2015, 34(1): 119– 128.
[21] SILVESTRI S, DEFINA A, MARANI M. Tidal regime, salinity and salt marsh plant zonation[J]. Estuarine Coastal and Shelf Science, 2005, 62(1/2): 119–130.
[22] NANCY C E, PATRICK J E, MARK D B. Competition and salt-marsh plant zonation: stress tolerators may be dominant competitors[J]. Ecology, 2001, 82(9): 2471–2485.
[23] 潘宇, 李德志, 袁月, 等. 崇明东滩湿地芦苇和互花米草种群的分布格局及其与生境的相关性[J]. 植物资源与环境学报, 2012, 21(4): 3–11.
[24] 陈中义, 李博, 陈家宽, 等. 长江口崇明东滩土壤盐度和潮间带高程对外来种互花米草生长的影响[J]. 长江大学学报:自科版, 2005, 2(2): 6–9.
[25] WEINER J. Allocation, plasticity and allometry in plants[J]. Perspectives in Plant Ecology Evolution and Systematics, 2004, 6(4): 207–215.
[26] 任丽娟, 王国祥, 仇乐, 等. 江苏潮滩湿地不同生境互花米草形态与生物量分配特征[J]. 生态与农村环境学报, 2010, 26(3): 220–226.
[27] MONY C, MERCIER E, BONIS A, et al. Reproductive strategies may explain plant tolerance to inundation: a mesocosm experiment using six marsh species[J]. Aquatic Botany, 2010, 92(2): 99–104.
[28] 邓自发, 谢晓玲, 王中生, 等. 基质及水位对入侵种互花米草生长的影响[J]. 生态学杂志, 2010, 29(2): 256–260.
[29]MCKEE K L. Biophysical controls on accretion and elevation change in Caribbean mangrove ecosystems[J]. Estuarine Coastal and Shelf Science, 2011, 91(4): 475–483.
[30] WANG G D, WANG M, LU X G, et al. Surface elevation change and susceptibility of coastal wetlands to sea level rise in Liaohe Delta, China[J]. Estuarine Coastal & Shelf ence, 2016, 180(5): 204–211.
[31] MORRIS J T, SUNDARESHWAR P V, NIETCH C T, et al. Responses of coastal wetlands to rising sea level[J]. Ecology, 2002, 83(10): 2869–2877.
[32] ZHOU Zeng, YE Qinghua, GIOVANNI C et al. A one-dimensional biomorphodynamic model of tidal flats: sediment sorting, marsh distribution, and carbon accumulation under sea level rise[J]. Advances in water resources, 2016, 93: 288–302.
[33] SIMON M M, SUSAN M H, JAMES T M. Impact of dynamic feedbacks between sedimentation, sea-level rise, and biomass production on near-surface marsh stratigraphy and carbon accumulation[J]. Estuarine, Coastal and Shelf Science, 2009, 82(3): 377–389.
[34] 李伟, 袁琳, 张利权, 等. 海三棱藨草及互花米草对模拟盐胁迫的响应及其耐盐阈值[J]. 生态学杂志, 2018, 37(9): 50–56.
[35] 王卿, 安树青, 马志军, 等. 入侵植物互花米草—生物学、生态学及管理[J]. 植物分类学报, 2006, 44(5): 559–588.
Laboratory simulation of the effects of tidal flat elevation on the growth ofin coastal salt marsh
TENG Kang1,TANG Honggen1, ZHAN Lucheng1,GE Zhenming2,XIN Pei1,3*
1. College of Water Conservancy and Hydropower Engineering, Hohai University, Nanjing 210098, China 2. State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai 200241, China 3. State Key Laboratory of Hydrology-Water Resources and Hydraulic Engineering, Hohai University, Nanjing 210098, China
In order to explore the effects of tidal flat elevation on the growth ofin coastal salt marsh wetlands, we conducted six sets of soil pillars with different heights and transplantedfor simulation experiment to study the differences in soil moisture and salinity conditions and plant growth response brought by different elevations. The experimental results showed: (1)The soil moisture content revealed a negative correlation with elevation, with the highest soil moisture content at 30 cm (46.4%) and the lowest at 180 cm (34.1%). There was no correlation between soil pore water salinity and elevation, with the highest salinity at 180 cm (47.2 ppt) and the lowest at 150 cm (28.3 ppt).(2)The plant height, biomass and root-shoot ratio showed significant differences with different elevations (= 0.01,= 0.03,= 0.02, all less than 0.05). Plant height and biomass decreased continuously with the increase of tidal flat height. The maximum plant height was 34.6% larger than the minimum, and the maximum biomass was 49.5% larger than the minimum. There was a negative correlation between plant root-shoot ratio and height, and the maximum valueincreased by 72.4% compared with the minimum. (3)The plant height displayed a quadratic parabolic relationship with soil moisture (2= 0.79), and the biomass had a linear relationship with it (2= 0.87), while the plant height, biomass and showed no obvious correlation with soil pore water salinity. Therefore, it can be concluded that wetland elevation affects soil moisture and salinity conditions by altering flooding frequency and groundwater level, which in turn causes the plant height and biomass ofin the upper part of the tidal flat to be higher than the lower part.
elevation; soil moisture; salinity;; growth response
滕康, 唐洪根, 詹泸成, 等. 实验室模拟滨海盐沼潮滩高程对互花米草生长的影响[J]. 生态科学, 2021, 40(3): 1–7.
TENG Kang,TANG Honggen, ZHAN Lucheng, et al. Laboratory simulation of the effects of tidal flat elevation on the growth ofin coastal salt marsh[J]. Ecological Science, 2021, 40(3): 1–7.
10.14108/j.cnki.1008-8873.2021.03.001
Q948.114
A
1008-8873(2021)03-001-07
2020-10-03;
2020-11-20
国家自然科学基金(U2040204)
滕康(1996—), 男, 山东青岛人, 硕士研究生, 主要从事生态水力学方面研究, E-mail: tengkang@hhu.edu.cn
辛沛, 男, 教授, 博士生导师, 主要从事滨海湿地水动力及生态地貌等方面研究, E-mail: pei.xin@outlook.com

