不同添加物对未漂洗大黄鱼鱼糜品质的影响
熊泽语,谢晨,陈百科,李慧,金素莱曼,包海蓉,2,3*
1(上海海洋大学 食品学院, 上海,201306)2(上海水产品加工及贮藏工程技术研究中心,上海,201306) 3(农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海,201306)
鱼糜制品营养丰富,味道鲜美,可长期保存,深受各年龄段消费者喜爱。消费者常见的鱼糜制品是通过将生鱼采肉,斩拌,加盐、加水、加热擂溃等步骤后形成常见的鱼糜凝胶,经不同处理可加工为种类繁多的商品,生活中常见的有如鱼肉香肠、模拟蟹肉、模拟虾肉、模拟贝柱、鱼糕、竹轮等[1]。大黄鱼作为硬骨鱼纲,鲈形目,石首鱼科,黄鱼属鱼类;体延长,侧扁,在国人口中有常被称作“大黄鱼”,主要栖息于沿岸及近海砂泥底质水域,大多栖息于中底层水域[2]。其以肉质鲜嫩味美,富含蛋白质、二十碳五烯酸、二十二碳六烯酸等不饱和脂肪酸以及多种微量元素等营养物质,被人们当作鲜食佳品,食用大黄鱼具有补充体内所需蛋白,提高免疫力,并且清除人体代谢产生的自由基,延缓人体衰老等功效。
在传统鱼糜生产工艺中,漂洗是不可缺少的工序之一。将碎鱼肉与特定比例的漂洗液混合、搅拌、脱水并反复操作得到鱼糜。漂洗可以除去鱼肉中的水溶性蛋白质、色素、气味、脂肪等,以提高鱼糜制品的凝胶强度和白度,但同时会使蛋白、脂肪等营养物质大量流失,造成产品得率的下降和资源的极大浪费,漂洗后排放的废水也会引起环境的污染。因此,未漂洗鱼糜的生产,正是解决了当前常规制备方法中存在的上述问题。制作未漂洗鱼糜,对原料鱼进行采肉后,不需要漂洗工序,从而减少废水对环境的污染,同时减少鱼糜营养成分损失,提髙鱼糜得率。
当前,已研究出部分方法以提高未漂洗鱼糜的品质特性,例如:添加糖类、盐溶液、动植物蛋白,改变加热方式、高压技术处理等[3]。其中,加入外源添加物是提高鱼糜品质特性最常见的方法,常见的添加物如淀粉、大豆蛋白、碱性盐等。王冬妮等[4]研究表明,添加6%(质量分数)红薯淀粉(sweet potato starch,SPS)、玉米淀粉、木薯淀粉和马铃薯淀粉均可有效提高鱿鱼鱼糜的凝胶特性和持水性,其中SPS的效果最好。研究表明,添加6%(质量分数)木薯变性淀粉可显著提高提高未漂洗革胡子鱼糜的凝胶特性和持水性。LAEMMLI等[5]则认为添加10%大豆分离蛋白时,鲢鱼鱼糜的断裂力和质量特征得到最大程度提高。然而关于各种添加物对大黄鱼鱼糜品质特性的具体影响尚未明确报道。
本文以大黄鱼鱼糜为对象,通过一种未漂洗鱼糜制备工艺,研究了加入不同种类保水剂与淀粉、大豆分离蛋白相搭配来提高鱼糜凝胶的品质特性,并与漂洗鱼糜、常规未漂洗鱼糜就凝胶特性、色泽、持水性、动态流变学和水分迁移等变化规律等做出比较,从而为提高未漂洗鱼糜的品质特性提供数据支持。
1 材料与方法
1.1 材料与仪器
冰鲜大黄鱼:通框养殖,规格1 kg/尾,宁德蔡氏水产有限公司;氯化钠、碳酸氢钠、焦磷酸钠(分析纯),上海阿拉丁生化科技股份有限公司;山梨醇、蔗糖、淀粉(均为食品级),京东慧采补充;大豆分离蛋白(食品级),河南万邦实业有限公司。
GL-20B 高速冷冻离心机,上海安亭科学仪器厂;MCR301流变仪,奥地利安东帕公司;D-130电动匀浆机,Wiggens有限公司;FA2004型电子分析天平,南京东迈科技仪器有限公司;SG2pH计、AL104-IC型分析天平,梅特勒-托利多国际贸易(上海) 有限公司;TA.XT Plus质构仪,英国SMS公司;CR-400型色彩色差计,日本柯尼卡美能达(中国)仪器有限公司;切碎机QSJ-B02R1,小熊电器有限公司;MesoMR23-060H-1型低场核磁共振仪,上海纽迈电子科技有限公司。
1.2 实验方法
1.2.1 鱼糜样品的制备
未漂洗鱼糜制备:冰鲜大黄鱼去头、去尾、去皮、去鳞、去内脏,清洗,取肉于吸水纸上沥干表面水分,取300 g碎鱼肉于绞肉机中搅碎,加入抗冻剂(4%山梨醇+4%蔗糖,均为质量分数)斩拌3 min制成鱼糜,-60 ℃冰箱内快速冷冻2.5 h后转入-18 ℃冰箱冷冻保藏,30 d内完成实验。
漂洗鱼糜制备:冰鲜大黄鱼去头、去尾、去皮、去鳞、去内脏,清洗,沥干后取肉切成碎块,放入搅拌机搅成碎肉后用3倍体积的冰水漂洗3次,每次5 min(最后一次冰水中放入0.3%(体积分数) 氯化钠溶液),倒掉废液,脱水,取300 g碎肉放入搅拌机内加入4% 蔗糖、4% 山梨醇搅拌3 min制成鱼糜后同上步骤冷冻。
1.2.2 实验设计方案
实验组分为6组,漂洗组(px)与空白对照组(ck)只加入2.5%(质量分数) 食盐斩拌后加入冰水调节水分含量至80%。其余4组在ck组基础上分别加入(S1)0.5% 碳酸氢钠+6% 玉米淀粉;(S2)0.5% 碳酸氢钠+6%大豆分离蛋白(soybean protein isolate,SPI);(S3)0.5% 焦磷酸钠+6% 玉米淀粉;(S4)0.5% 焦磷酸钠+6% 大豆分离蛋白作为S1~S4组,均为质量分数。
1.2.3 鱼糜凝胶的制备
将-18 ℃冷冻鱼糜取出放入3 ℃低温培养箱中放置到中心温度为-5 ℃左右的半解冻状态,切成小块,放入搅碎机中空搅2 min,后加入2.5% 食盐混匀搅拌3 min,再根据不同实验组方案分别加入碳酸氢钠/焦磷酸按搅拌1 min,淀粉/大豆分离蛋白搅拌3 min,最后加冰水调节水分含量至80% 后,将肉浆注入小型灌肠模具中,灌入直径3.5 cm的塑料肠衣中封口,采用二段式加热(40 ℃加热60 min,90 ℃加热30 min),后将鱼肠放入碎冰中冷却30 min,放入4 ℃冰箱中保藏,4 d内完成余下指标测定(搅拌机放入碎冰中,全程保持搅拌温度低于10 ℃)。
1.2.4 凝胶强度测定
凝胶强度采用 TA.XT Plus质构仪测定,参考BENJAKUL等[6]的方法并进行适当修改。先将样品从培养箱中取出放置30 min,而后将制备好的鱼糜凝胶样品切成2.5 cm长的圆柱体,每组样品3个平行。测试条件:选用P/5 s球形探头穿刺样品。测试参数:测前、测中和测后速度均为1 mm/s,压缩比50%,触发力5.0 g。并记录破断强度BF(g)和破断距离BD(cm),凝胶强度(gel strength,GS)的计算如公式(1)所示:
GS/(g·cm)=BF×BD
(1)
1.2.5 质地剖面分析参数的测定
采用1.2.4相同的处理方式;测试条件:探头为P/50,测试模式采用质地剖面分析(texture profile analysis,TPA)。测前、测中、测后速度均为1 mm/s;压缩比为50%;触发力为15 g。选取硬度、弹性、咀嚼性为TPA参数,每组3个平行。
1.2.6 持水性测定
持水性(water holding capacity,WHC)测定[7]:将制备好的鱼糜凝胶切成0.5 cm左右的薄片,称重(m1)后用双层滤纸包裹,离心机离心(4 ℃,3 000×g,10 min),随后滤纸中取出样品称重(m2),持水性计算如公式(2)所示:
(2)
1.2.7 蒸煮损失
参考DBUSCA等[8]方法稍作修改,将鱼糜凝胶切成15 mm×15 mm×20 mm的长方体,准确称重(M1)后放入小型蒸煮袋后用自动封口机封口,放入90 ℃的水浴锅中水浴20 min,快速取出开袋,用吸水纸沥干表面水分称重(M2),每组3个平行。蒸煮损失计算如公式(3)所示:
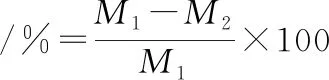
(3)
1.2.8 白度的测定
将鱼糜凝胶切成0.5 cm左右的薄片,采用 CR-400 色差计测定鱼糜制品凝胶的L*(亮度),a*(红色/绿色)和b*(黄色/蓝色),白度值计算[7]如公式(4)所示:

(4)
1.2.9 pH的测定
pH测定参考 GB 5009.237—2016 《食品安全国家标准 食品pH值的测定》[9]的测定方法稍作修改,取5 g鱼糜凝胶样品剁碎后加入50 mL蒸馏水,均质机均值1 min后静置30 min,而后过滤纸滤上清液,用pH计测定pH值,每组3个平行。
1.2.10 低场核磁共振测定水分迁移情况
参数参照PAN等[10]的方法稍作修改,使用核磁共振成像仪测定。取15 g样品切成大小相近的圆柱体,用保鲜膜包好放入核磁管中,采用自旋回讯磁振脉中序列测定。测定参数:质子共振频率21 MHz,射频延时0.002 ms,模拟增益20.0 dB,90°脉宽19 μs,重复采样时间3 500 ms,累加次数8,180°脉宽38.0 μs,延时1.000 ms,回波个数1 000,每组3个平行。
1.2.11 流变特性测定
参考 MORENO 等[11]的方法作适当修改,采用MCR301流变仪测定,取一定量鱼糜,放置在流变仪平台上;用圆形平形板(直径为40 mm)压平,狭缝为1 mm;用液体硅油密封样品,防止水分蒸发干扰测定结果。对复合蛋白进行温度扫描,测定的主要参数是:剪切频率为0.1 Hz,剪切应变2%,扫描温度范围为20~80 ℃,升温速率为 1.5 ℃/min,以此测定储能模量G′的变化曲线。
1.3 数据处理
所有实验组均设3组平行,数据样本采用Microsoft Excel 2011软件作图,采用IBM SPSS Statistics 25.0 进行显著性分析及组间相关性分析,多组数据差异性分析采用单因素ANOVA两两比较的Duncan模型,显著水平为P<0.05,不同小写字母表示具有显著性差异。
2 结果与分析
2.1 不同种类添加物对大黄鱼未漂洗鱼糜凝胶强度的影响
凝胶强度表示凝胶破断力和凹陷深度的乘积,其可以反映凝胶内部结构是否牢固;凝胶破断力和凹陷深度越大,鱼糜制品的凝胶特性就越好[12]。由图1可知,漂洗组凝胶强度明显高于未漂洗各组(P<0.05),这是由于漂洗鱼糜去除了大量脂肪色素以及水溶性蛋白质,浓缩了肌原纤维蛋白,更有益于优质凝胶的形成。而加入不同种类保水剂与外缘添加物均可显著增加凝胶强度(P<0.05),S1~S4组凝胶强度相对于对照组分别提高了68.12%、54.81%、72.76%、52.98%。S1、S3组与S2、S4组在加入了不同碱性盐(碳酸氢钠、焦磷酸钠)的基础上又分别加入了土豆淀粉SPI,其凝胶强度差异并不显著(P>0.05),这说明加入相同量的淀粉、大豆蛋白改善大黄鱼凝胶强度的能力相当,且说明玉米淀粉与SPI相比于不同种类碱性盐,更占改善凝胶强度的主导地位。其原因是擂溃过程中添加一定量的淀粉可以在鱼糜中形成淀粉、蛋白、水相互嵌合的复合网状结构[13],使得加热后形成的凝胶富有更多的弹性;而SPI的加入使其与鱼糜中的水分子作用,SPI内部极性基团解离为离子状态,在加热凝胶化过程中,这些极性基团与肌原纤维蛋白中的极性基团相结合,有助于肌原纤维蛋白形成更加致密、复杂的网状结构,从而提升鱼糜凝胶强度。因此加入玉米淀粉和SPI均可有效地改善大黄鱼未漂洗鱼糜的凝胶强度。
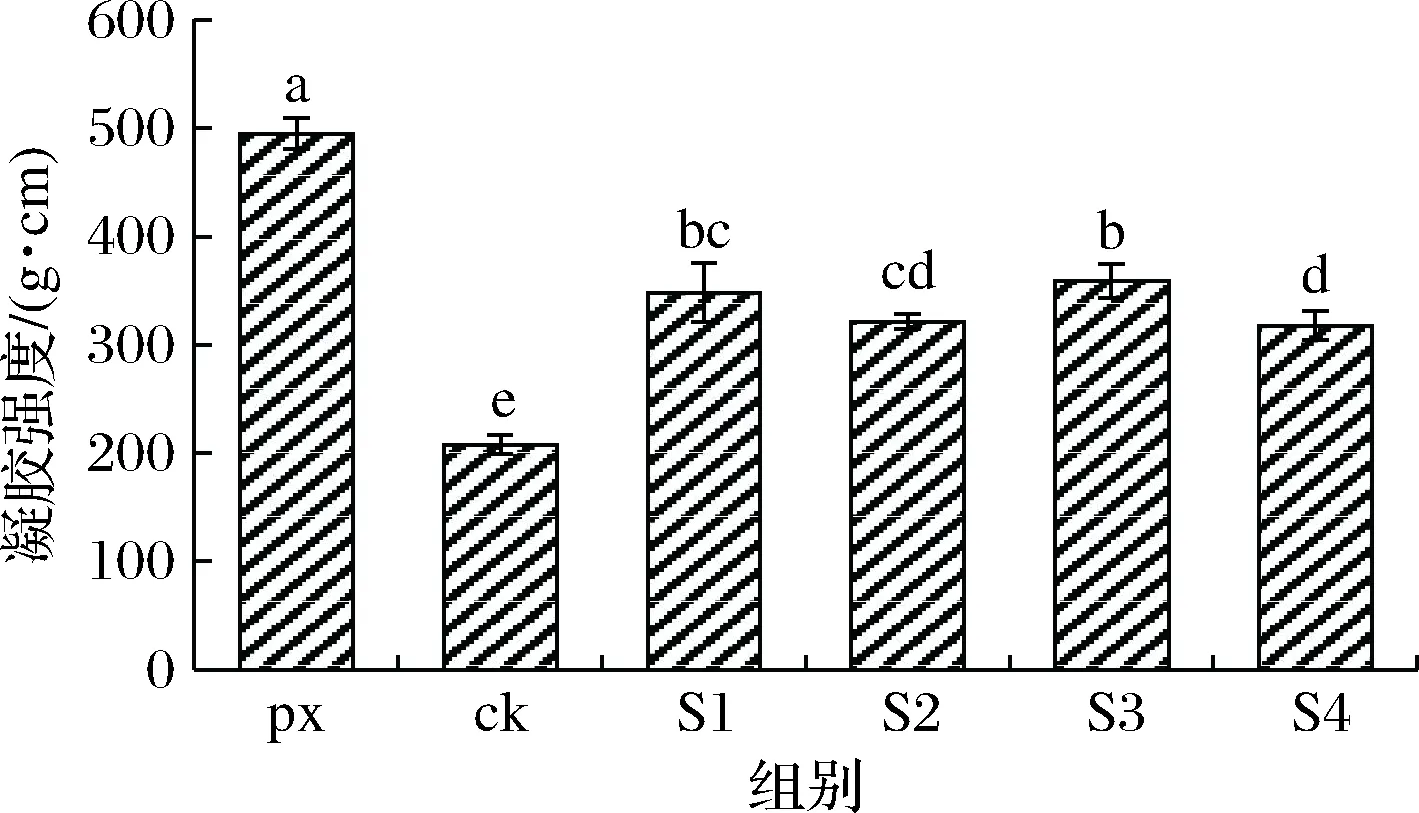
图1 不同种类保水剂与外源添加物对未漂洗大黄鱼鱼糜凝胶强度的影响Fig.1 Effects of different kinds of water-retaining agents and exogenous additives on the strength of fish intestine gel注:不同小写字母表示差异性显著(P<0.05)(下同)
2.2 不同种类添加物对大黄鱼未漂洗鱼糜质构特性的影响
由表1可知,漂洗组的硬度、弹性、咀嚼度均明显高于其他各组(P<0.05)。加入不同种类保水剂与外缘添加物较对照组均可显著增加硬度,相较于对照组分别提高了33.61%、21.58%、24.17%、4.84%,S1组(碳酸氢钠+淀粉)显著高于其他3组(P<0.05)。加入不同添加物的各组弹性均高于对照组(P<0.05),并在S1、S3组基本达到最大值0.93;而加热成凝胶后的S1组的咀嚼度为1 234.43 g·mm,都显著高于对照组与其他组(P<0.05),相较对照组提升了28.68%,而S2~S3组相对于对照组则没有显著差异(P>0.05)。加入的碱性盐在鱼糜在擂溃过程中可提高其pH,使其偏向碱性,跳过蛋白质的等电点,从而提高鱼糜凝胶的品质[14],而淀粉与SPI的加入同样使得蛋白质与其和水形成更加致密的网络结构,从而提高凝胶特性。由数据可以看出,加入了碳酸氢钠和淀粉的未漂洗鱼糜,其凝胶硬度、弹性、咀嚼度的提升效果最好,与凝胶强度的研究结果相一致;通过加入淀粉、碳酸氢钠形成较为稳定复杂的网络结构,大幅提高鱼糜凝胶强度,进而提高硬度、弹性、咀嚼度。

表1 不同种类保水剂与外源添加物对未漂洗大黄鱼鱼糜凝胶质构特性的影响Table 1 Effects of different kinds of water-retaining agents and exogenous additives on the texture characteristics of fish intestines
2.3 不同种类添加物对大黄鱼未漂洗鱼糜持水性与蒸煮损失的影响
持水性是评价鱼糜制品质量的重要指标,其大小反映了鱼糜制品中蛋白质分子结合水能力的好坏,形成的凝胶与水结合能力越强,凝胶内部的结构也就越致密、均匀,持水能力也越强[15]。由图2-A可知,加入不同添加物后,各组持水性相比于漂洗与对照组均得到显著提升(P<0.05),相比于对照组分别提高了3.78%、3.09%、3.40%、3.22%,而px组由于清洗掉多余的脂质以及水溶性蛋白,其凝胶结合水分的能力得到提高,其持水能力也明显优于ck组。加入碳酸氢钠后的鱼糜在擂溃过程中pH增大,蛋白质偏离其等电点,产生更多的电荷,增大分子间作用力,随之增加距离,因网络结构可以包裹住更多水分,从而提高保水性。而磷酸盐除了上述功能之外,磷酸根离子还可作为良好的螯合剂,使蛋白质与其他大分子和金属离子螯合形成复合物、增加离子强度,有效地改善鱼糜制品的保水能力[16]。而相对于焦磷酸钠中磷酸盐的作用,2种碱性盐通过增加pH而改变蛋白质等电点从而提升凝胶保水性的作用更为显著;因此添加碳酸氢钠与焦磷酸钠的实验组均可以显著提高凝胶的保水性,进而大幅提升凝胶强度与质构特性。
蒸煮损失表示鱼糜制品在煮制过程中水分、淀粉等物质流失而造成质量的减少[17]。由图2-B可知,S1~S4组蒸煮损失均明显低于漂洗鱼糜与对照组,相比于对照组分别减少了43.79%、53.66%、33.87%、32.62%,且可看出在未漂洗大黄鱼鱼糜中加入等量的碳酸氢钠-SPI(S2组)相比于碳酸氢钠-淀粉(S1组)及磷酸盐组(S3、S4组)更能降低鱼糜的蒸煮损失,这可能是因为SPI相比与碳酸氢钠与水分的结合能力较低,使得SPI锁住较少的水分,而剩下的水分在擂溃中或蒸煮中产生流失。但鉴于SPI独特的吸水性可使凝胶内部结构更加紧密,其与蛋白、糖类等相互作用产生的网络结构将更多的水分子锁住[18],也可以有效地降低蒸煮损失。

A-持水性;B-蒸煮损失图2 不同种类保水剂与外源添加物对未漂洗大黄鱼鱼糜凝胶的影响Fig.2 The influence of different kinds of water-retaining agents and exogenous additives of fish intestines
2.4 不同种类添加物对大黄鱼未漂洗鱼糜白度的影响
白度是评价鱼糜制品品质的重要指标。通常情况下,鱼糜加工后形成的凝胶结构紧密,就会赋予凝胶良好的白度,而凝胶结构松散无序,则会降低鱼糜凝胶的光学特性[19-20]。由图3可知,S1~S4组与px组、ck组相比均会在不同程度上降低鱼糜白度,S1组相比于其他3组效果最好,与ck组没有显著性差异(P>0.05),这可能与未漂洗鱼糜本身含有未经漂洗去除的脂肪、色素、血水等物质降低自身白度有关,且这与沈晓蕾等[21]、鲍佳彤等[22]研究得出添加淀粉与SPI会降低鱼糜凝胶白度的结果相对应,淀粉会吸水溶胀,使得凝胶透光性减弱,而SPI颜色微黄,加入过量也会影响色泽,因此2种添加物均会在不同程度上降低鱼糜凝胶白度。
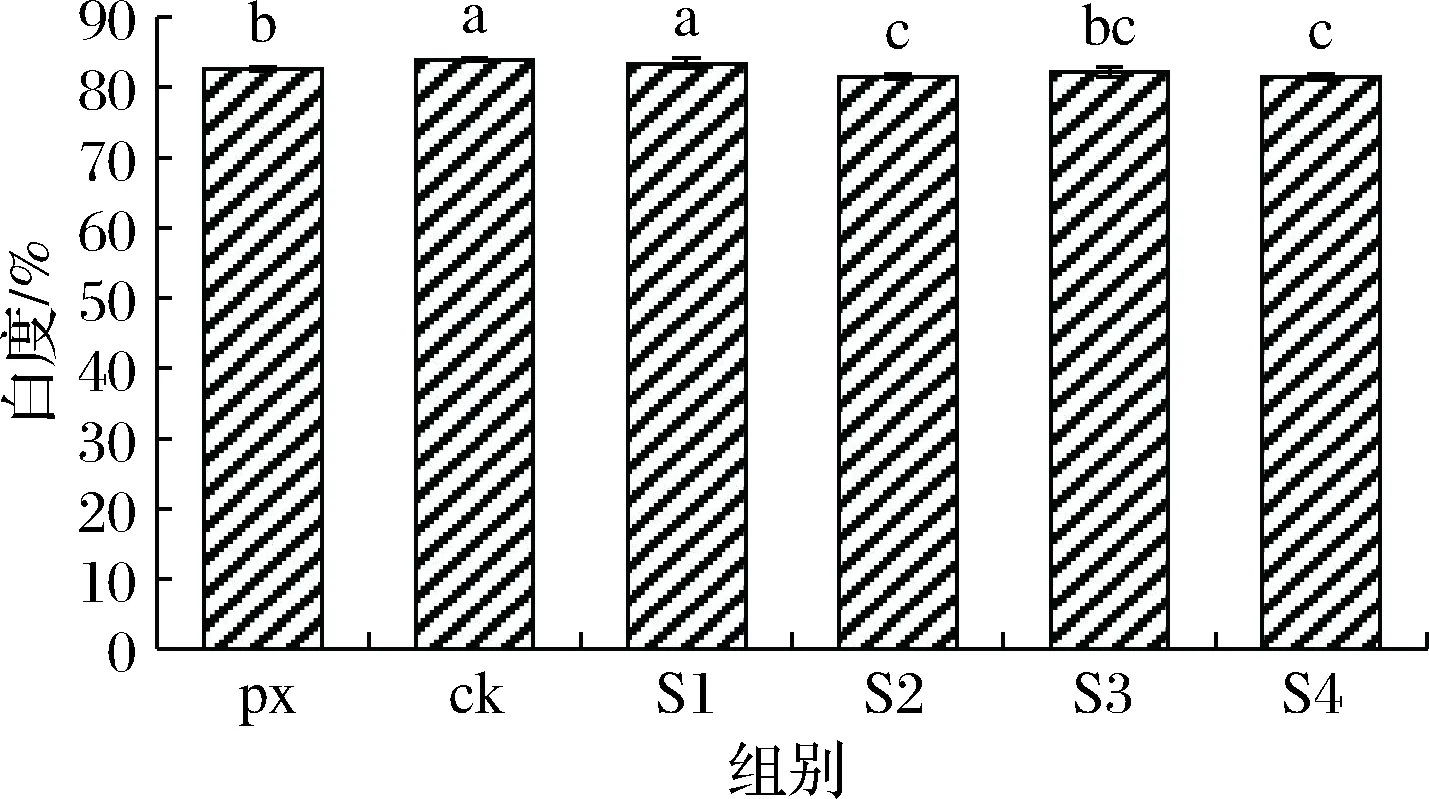
图3 不同种类保水剂与外源添加物对未漂洗大黄鱼鱼糜凝胶白度的影响Fig.3 Effects of different kinds of water-retaining agents and external additives on the whiteness of fish intestines
2.5 不同种类添加物对大黄鱼未漂洗鱼糜pH的影响
pH作为评价食品品质鲜度的指标可反应凝胶的品质。韩敏义等[23]研究表明,pH可以影响凝胶的保水性与微观结构,肌原纤维蛋白的等电点(pI)在5.2左右,当蛋白质pH偏离其等电点后,其增加的电荷与水分子上的氢键结合,使更多的水分子保留在凝胶中,从而提高保水性,形成更加复杂的网状结构。如图4所示,ck组pH最小,这也与其保水性、凝胶强度较差的结果相吻合;加入碳酸氢钠与焦磷酸钠后都可以显著提高凝胶pH(P<0.05),加入碳酸氢钠(S1、S2组)后pH增加最大,均大于7,而加入焦磷酸钠(S3、S4组)后的pH也有所增加并且更接近7,这是由于磷酸盐的缓冲性质使pH更加接近中性。由于pH接近7的凝胶的网状结构更加有序,因此,加入碳酸氢钠对凝胶pH的影响最大,加入焦磷酸钠有助于形成更加有序的网络结构。

图4 不同种类保水剂与外源添加物对未漂洗大黄鱼鱼糜凝胶pH的影响Fig.4 Effects of different kinds of water retention agents and external additives on the pH of non-rinsed large yellow croaker surimi gel
2.6 不同种类添加物对大黄鱼未漂洗鱼糜水分迁移的影响
利用低场核磁共振测定样品中水分子横向弛豫时间T2可以说明凝胶内部水分分布状态与迁移情况,进而用于研究肉与肉制品的加工特性。如图5所示,反演后得到横向弛豫时间T2图谱中存在3个峰,分别代表大黄鱼凝胶中不同状态的水。即T21(0~10 ms)代表与大分子紧密结合的水;T22(10~150 ms)代表位于蛋白质组织内部的水即不易流动水;T23(150~1 000 ms)代表蛋白组织外部的水,即自由水[24],而3个峰所占积分总面积的百分比分别用P21、P22、P23表示,代表上述3种不同状态水的相对含量。

图5 不同种类保水剂与外源添加物对未漂洗大黄鱼鱼糜凝胶的横向弛豫时间T2波谱图的影响Fig.5 Effects of different kinds of water-retaining agents and external additives on the T2 spectrogram of non-rinsed large yellow croaker surimi gel
由表2、表3可知,各组T21之间没有明显差异,P21之间差异不大,说明有无添加物对大黄鱼未漂洗鱼糜凝胶结合水含量影响不大。

表2 不同种类保水剂与外源添加物对未漂洗大黄鱼鱼糜凝胶横向弛豫时间T2的影响 单位:ms

表3 不同种类保水剂与外源添加物对未漂洗大黄鱼鱼糜凝胶水分迁移谱图波峰面积百分比P2的影响 单位:%
随着不同添加物的加入,各组T22相对于ck组都有所下降,说明加入的淀粉或大豆蛋白均可填充到蛋白网络结构中,从而形成更加稳固的网络结构[25-26],而碳酸氢钠与焦磷酸钠均可减少水分的流动性。其中S1组最为显著,相比于ck组减少了10.58%,说明淀粉在加热形成凝胶的过程中填充于凝胶网络结构中,吸收住更多的水分于凝胶网络中,增强了凝胶的保水性与凝胶强度。加入不同添加物的4组P22均有所增加,P23均有所减少,这说明加入添加物后,4组鱼糜凝胶中的自由流动水在不同程度上发生了迁移,变为不易流动水。这使得鱼糜凝胶网络结构中的水分增多,持水性增强,鱼糜凝胶特性得到提高。且S1与S3组最为显著,为91.94%和91.41%。综合来看,加入淀粉的2组能更好地锁住鱼糜中的水分,提高未漂洗大黄鱼鱼糜的凝胶特性。
2.7 不同种类添加物对大黄鱼未漂洗鱼糜流变特性的影响
流变学特性是指在外力的作用下,鱼浆黏弹性变化,G′通常用作凝胶形成的指标,表示鱼浆在受到外力作用下产生形变所储存的能量,反映物体受到外力后回复初始状态的能力,通常G′越大,表明鱼糜及其制品的弹性越强。
含有不同添加物鱼糜的G′随温度变化如图6所示,其中S1、S2组与px、ck组走势一致,而S3、S4组初始G′远低于前4组,这有可能是焦磷酸钠虽然可以提高凝胶弹性,但是其也有反絮凝作用,对于油脂含量较高的未漂洗鱼糜,焦磷酸钠可以使油脂乳化,进一步降低表面张力与界面张力,从而降低初始弹性。
伴随着温度升高,各组的G′通常都伴随着先升高后降低再升高的过程,而S1~S4组均表现出比ck组更高的G′,这是因为淀粉与SPI均具有一定的黏弹性。px、ck、S1、S2与S3、S4组的G′分别在20~39 ℃与20~29 ℃有小幅度升高,此阶段中,胞内谷氨酰胺转氨酶转氨酶受热加快催化S1蛋白亚片段变性,造成肌球蛋白之间相互连接,形成简单的蛋白质聚集体[27]。这是可能是因为在较低温度下,蛋白质分子通过氢键交联形成较为简单的凝胶网络[28];紧接着,前4组与后2组G′分别在39~47 ℃与29~6 ℃出现下降趋势。此阶段中,内源性蛋白水解酶随着温度升高,活性变强,造成肌原纤维蛋白降解,凝胶网络结构遭到破坏[29];最后,从最低点加热直到80 ℃,各组G′大幅增加,为凝胶强化阶段,此阶段肌球蛋白与肌动蛋白因为高温变性,形成不可逆的凝胶网络结构[30]。
由图6可知,虽然S3、S4组初始G′要低于其余4组,但随着凝胶加热,其G′依然大幅度升高。而S1~S4组相较于ck组在凝胶弱化阶段G′下降明显减缓,这可能是因为淀粉与大豆蛋白颗粒作用于凝胶网状结构中,抑制了肌动蛋白的降解,因此减弱了凝胶的劣化[31]。而S1~S4组凝胶的G′虽然都明显高于ck组,但相互之间的G′的最大值并没有显著差异,与之前的结果并不一致,这可能是由于流变特性主要从添加物填充至蛋白网络结构中反应G′的增强,而凝胶特性则从添加物直接参与网络结构的反应而表现出凝胶特性增强[32]。这也进一步说明了淀粉与SPI可以有效地填充在凝胶网络的空隙之中,提高鱼糜的G′。

图6 不同种类保水剂与外源添加物对未漂洗大黄鱼鱼糜凝胶G′的影响Fig.6 Effects of different kinds of water-retaining agents and external additives on non-rinsing large yellow croaker surimi gel G′
4 结论
本实验发现加入不同种类的添加物可以影响大黄鱼未漂洗鱼糜的凝胶特性、硬度、咀嚼度、保水能、白度、横向弛豫时间T2和G′。在相同的添加量下S1、S2、S3、S4组均可以增加凝胶的破断力从而增强凝胶强度,并且淀粉与SPI颗粒吸水膨胀后,形成位于凝胶网络空隙中的填充物,使得凝胶的横向弛豫时间T22缩短,从而增加未漂洗鱼糜的持水性与蒸煮损失,而碳酸氢钠与焦磷酸钠的加入则通过改变鱼糜内部pH,使得蛋白质偏离等电点,水分子与分子间氢键结合,显著增强其保水性能,也在一定程度增加了凝胶强度与硬度。而吸水膨胀后的淀粉、SPI还能进一步压缩未漂洗鱼糜的凝胶基质,进一步增加凝胶的G′以及凝胶网络结构的复杂性。添加组相对于ck组虽然显著提高了凝胶特性、保水能力与G′,但加入淀粉与SPI会在一定程度上降低凝胶白度;而相比于px组在凝胶强度上还有一定差距,这是由于淀粉与SPI可以通过增加破断力的方式增大凝胶强度,但是破断距离相对于不添加组却显著减小,加上各种添加物还无法完全弥补未漂洗鱼糜脂肪、水溶性蛋白残留所造成的凝胶品质的劣化。
综合来看,几种添加物均可在不同程度上增强未漂洗大黄鱼鱼糜的凝胶特性、保水性、黏弹性以及pH。而加入淀粉对鱼糜各品质的提高最为显著,能显著提高鱼糜的凝胶特性,吸收鱼糜内部的水分,形成更为致密的网络结构。而加入两种碱性保水剂在改善鱼糜凝胶特性上的效果相当,碳酸氢钠在改善凝胶强度和流变特性上微弱于焦磷酸钠,但其作为无磷保水剂,与其他添加物复配使用,在未来依然具有很好的应用前景。此研究结果可作为后续实验基础,为提高未漂洗鱼糜的品质特性提供数据支持。

