IFCC参考方法评价两个常规系统血清肌酸激酶测定结果的正确度
王 珊 李文娟 梁海港 黄婷婷 吴泽东
安徽伊普诺康生物技术股份有限公司,安徽合肥 230000
肌酸激酶(creatine kinase,CK)是一个与细胞内能量运转、肌肉收缩、ATP再生等有直接关系的重要激酶[1-2],其血清水平在诊断心肌损伤及骨关节炎等方面具有重要的临床意义[3-7]。目前检测CK方法主要有国际临床化学和实验室医学联盟(International Federation of Clinical Chemistry and Laboratory Medicine,IFCC)参考方法和常规生化方法,其中常规生化方法操作简便,成本低,故临床应用广泛[8-11]。由于CK检测结果易受浓度、pH值、温度等多种因素的影响,导致结果差异大。本文采用A、B两种测量系统同时测定有证标准物质、新鲜血清以及IFCC国际参考实验室能力验证(IFCC-RELA)样本,将结果与IFCC参考方法测定结果进行比对,最终按美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)EP09-A3文件对正确度进行评价。
1 材料与方法
1.1 仪器
日本日立公司HITACHI 7180 全自动生化分析仪、日本岛津UV 2700型紫外可见分光光度计、美国FLUKE 1523型点温度计、瑞士梅特勒XSE205DU型分析天平、瑞士梅特勒型S220型pH计、美国Hamilton公司Microlab 600稀释配液仪、德国Eppendorf移液器、日本ASONE容量瓶。
1.2 试剂
参考方法试剂:氯化钠、氢氧化钠、甘油、醋酸镁、D-葡萄糖、β-D-葡萄糖-6-磷酸钠盐和二水乙二胺四乙酸二钠盐均购自美国Sigma公司;咪唑、醋酸和N-乙酰-L-半胱氨酸均购自德国Merck公司;六水5"-单磷酸腺苷、三水三磷酸腺苷二钠、二磷酸腺苷单钾盐和β-烟酰胺腺嘌呤二核苷酸磷酸二钠盐均购自瑞士Sorachim公司;P1,P5-二腺苷-5"五磷酸五锂盐、己糖激酶(HK)和葡萄糖-6-磷酸脱氢酶(G-6-PDH)均购自瑞士Roche公司;四水磷酸肌酸二钠盐购自日本OYC公司;常规方法试剂:A公司、B公司生产的CK试剂盒。
1.3 标准物质、质控品和血清样品
标准物质:有证标准物质ERM-AD455k购自欧盟委员会(European commission),认定值为(314.00±6.00)U/L;2018年CK国际参考实验室室间比对样本RELA A和RELA B由IFCC提供,德国临床化学与检验医学学会(German Society of Clinical Chemistry and Laboratory Medicin,DGKL)认 定 值 为(357.12±6.24)U/L和(326.88±5.70)U/L。质控品:英国朗道(货号:HN1530-1285UN和HE1532-983UE)。
血清样品:40例不同浓度新鲜单人份血清,CK催化活性浓度范围为10~1000 U/L。
1.4 实验方法
1.4.1 参考方法检测方案 按照IFCC参考方法准备实验条件,用2018年RELA样品确认参考方法测量结果的精密度,要求样品每天测定5次,连续测定2 d,10次测定结果变异系数(CV)≤1%。用有证标准物质ERM-AD455k确认参考方法的正确度,3次测量结果在“认定值±不确定度”范围内。在参考方法精密度和正确度达到要求后进行40份血清样品测定。测定顺序为质控→样品→质控,每个样品重复测定2次,每10份血清加测一个质控。
1.4.2 常规方法测量方案 A、B两个测量系统分别由 A、B厂家校准品、质控品及试剂盒、日立7180全自动生化仪组成,亦称为A法、B法;两种测量系统在同一台仪器的不同测量通道上同时进行。仪器进行相应校准后,对40份新鲜血清样品和RELA样本进行测定,测量顺序为:质控→样品→质控,每个样品重复测量2次,其均值作为评价数据。
1.5 数据处理
根据CLSI EP09-A3文件,将两个测量系统的测定结果分别与IFCC测定结果进行比较,从而评价两种常规检测系统测量结果的正确度,并用Excel绘制的直线回归图和Origin 8绘制改良Bland-Altman图形共同进行分析验证。
2 结果
2.1 测定数据有效性检验
本实验全部数据经检验无离群值。
2.2 IFCC参考方法正确度和精密度的确认
采用2018年RELA样本对精密度进行确认,其CV<1%,参考方法对有证标准物质ERMAD455k测定结果的确认,3次测定结果均在“认定值±不确定度”范围内。故符合性能要求,见表1。

表1 IFCC参考方法正确度和精密度的确认
2.3 质控样本的测定结果
分别采用IFCC参考方法、A和B两种测量系统检测质控样本(朗道公司HN1530-1285UN和HE1532-983UE),见表2。结果表明,B法测量两个质控样本和IFCC参考方法测定值均在结果要求(等效限±5.25%)范围内,其偏倚结果较为一致。而A法测量两个质控样本测定值均在结果要求(等效限±5.25%)范围外,且均明显偏低。
2.4 A、B测量系统测定结果的比较
采用A、B测量系统在日立7180全自动生化仪上分别对40例不同浓度新鲜单人份样本血清进行同时测定,见表3。
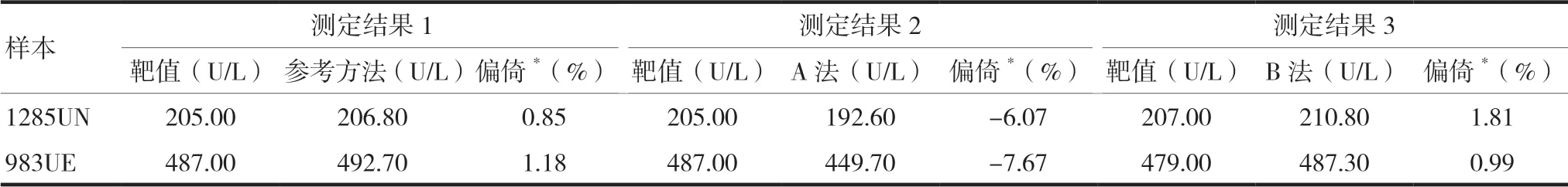
表2 质控样本测定结果

表3 A、B法与IFCC方法测定结果
以B法测定结果为X轴,A法测定结果为Y轴作直线回归图,可见A、B两法存在明显差异,A法的测定结果均偏低于B法,见图1。

图1 A、B两测量系统测定结果比较
2.5 A、B测量系统分别与IFCC参考方法的比较
采用A、B两测量系统在日立7180全自动生化仪上分别对40例不同浓度新鲜单人份样本血清进行同时测定,见表3。以IFCC参考方法作为参比方法,A、B法作待评价方法,利用直线回归图和改良Bland-Altman图形分析法进行评价,分别以A、B法为Y轴,与X轴的参考方法作直线回归图(图2、3)和Bland-Altman图(图4),发现B法与IFCC参考方法结果较为一致,其平均偏倚范围在1.53%,在IFCC参考方法允许范围内,而A法与IFCC参考方法结果存在明显偏差,其平均偏倚范围为-6.25%,超出IFCC参考方法允许范围(±5.25%)。

图2 A测量系统与IFCC法测定结果直线回归图
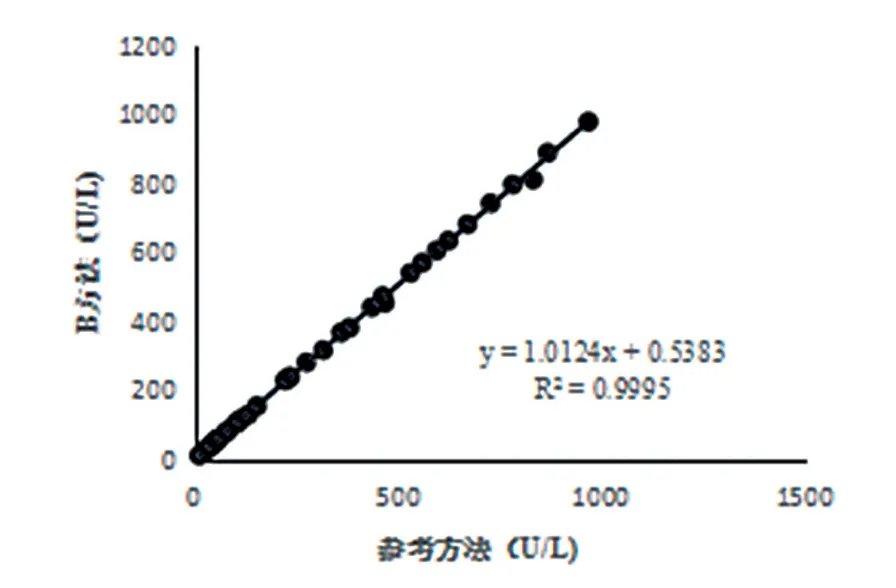
图3 B测量系统与IFCC法测定结果直线回归图

图4 A、B测量系统与IFCC参考方法测定结果的Bland-Altman图注:A法平均偏倚为-6.25%;B法平均偏倚为1.53%
2.6 A、B两测量系统校准品基质效应的评价
分别用IFCC参考方法和A、B测量系统在日立7180全自动生化仪上对20例不同浓度新鲜单人份样本血清进行测定。根据CLSI EP14-A2文件对基质效应的评价,将20例不同浓度新鲜单人份样本血清和A、B校准品用进行A、B两测量系统重复性测试的均值为Y轴,用IFCC参考方法的均值为X轴作散点图,采用Origin 8作图软件评价A、B两校准品的基质效应。
A、B两校准品均位于IFCC参考方法分别与A、B两测量系统的直线回归方程95%置信区间外,说明均存在基质效应,其中A校准品的基质效应较明显。见图5、6。
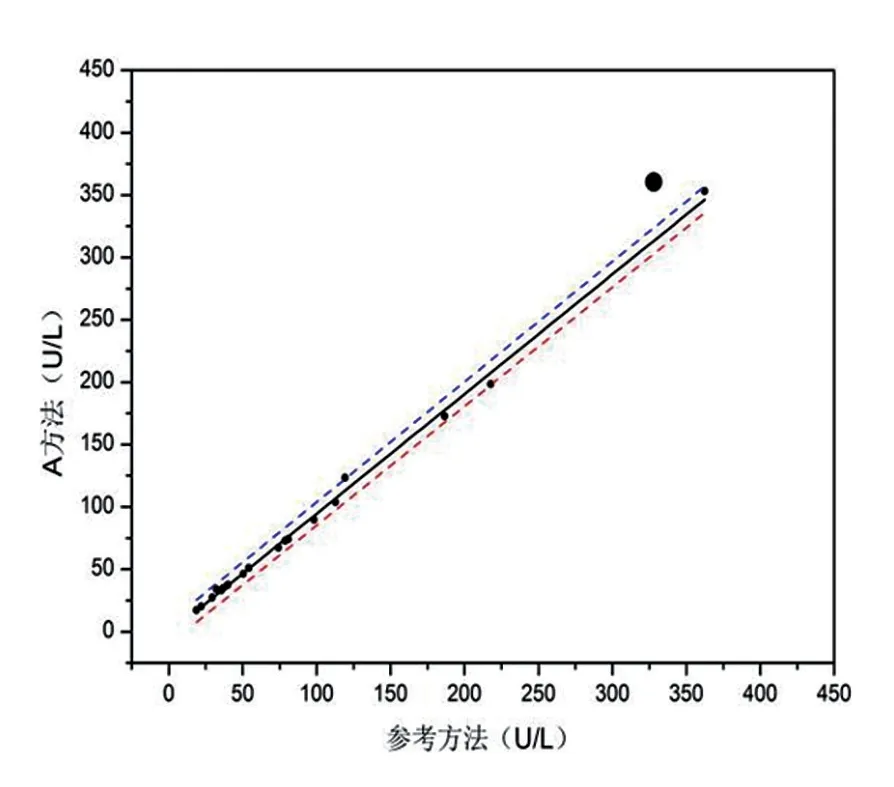
图5 A校准品基质效应

图6 B校准品基质效应
3 讨论
本研究通过检测2018年RELA确认参考方法的精密度、检测ERM-AD455k确认参考方法的正确度,以IFCC-RELA对CK的等效限(± 5.25%)作为合格指标,根据EP09-A3文件评价常规测量系统测定结果的正确度,采用IFCC参考方法和A、B两测量系统在同一全自动生化仪不同通道上分别对40例不同浓度新鲜单人份样本血清进行测定,结果显示A、B两个常规测量系统的测定值具有显著差异。
为了验证A、B两种方法与IFCC参考方法的一致性,本研究利用Excel绘制的直线回归方程和Origin 8制作的改良Bland-Altman图形进行分析。其中A法与IFCC参考方法的直线回归方程为YA= 0.9814X-4.0506,R2= 0.9986,B法 与IFCC参考方法的直线回归方程为YB= 1.0124X+ 0.5383,R2= 0.9995,A法与B法的直线回归方程为Y= 0.9791X-5.0766,R2= 0.9977。分析结果可见,A、B两法均与IFCC参考方法有良好的相关性,且A、B两法的相关性也符合R2>0.95要求。但通过改良Bland-Altman图形分析,B法测定结果的大部分散点位于“0”点之上,与参考方法的测定结果存在一定程度的正向偏倚,B法平均偏倚为1.53%;A法测定结果的散点均位于“0”点之下,与参考方法的测定结果存在着一定程度的负向偏倚,A法平均偏倚为-6.25%。根据回归方程与改良Bland-Altman图形分析,B法与IFCC参考方法测定结果较为一致,在 IFCC参考方法允许偏倚范围内,提示B法测定结果正确;而A法与IFCC参考方法测定结果正确度性能不一致,整体偏低,且结果已超出IFCC参考方法的允许偏倚范围,提示A法测定结果不正确。
为了保证常规检测系统的准确性和可比性,血清酶学参考系统是实现酶学检测结果溯源性的基础[12]。常规检测系统只有溯源至参考方法或参考物质,才能够有效的减小临床检测结果与靶值的偏倚,研究发现[13-15]校准品是否具有互换性是影响常规方法检测结果的重要因素,故本文对A、B两校准品进行互换性评价。依据EP14-A2文件,提示A、B校准品的测定值均位于回归方程95%置信区间外,说明都存在基质效应,但A校准品的基质效应较明显,推测可能是导致测定结果不正确的主要原因,B校准品虽存在基质效应,但对检测系统测定结果的正确度未产生太大的影响。
综上所述,A、B两个常规测量系统测定同一样本在同一仪器上的测定结果存在着显著的差异,这种现象说明常规测量系统缺乏溯源性,只有在特异性与参考方法相同或相近的常规方法才能通过不间断的溯源链更好的实现溯源,故建议有关研发、生产单位有必要对常规测量系统的正确度以及校准品的互换性进行评价。

