一种便捷的β-氨基膦酸酯的合成方法研究
罗建萍,叶汤艳,魏可可,杨丽娟,钏永明
(云南民族大学 化学与环境学院,云南昆明650500)
有机膦化合物是生化研究中的重要基质[1-4],是一类被广泛使用具有生物活性的化合物.氨基膦酸及其衍生物作为有机膦化合物的代表更是一类极具吸引力的化合物,因为它们作为α-和β-氨基酸的非蛋白原性类似物具有强大的生物活性[5-8].天然存在的氨基酸在生命化学中的关键作用以及作为肽、蛋白质和酶的结构单元,已经引起人们对合成类似物的化学及其生物活性的浓厚兴趣[9-12].氨基膦酸可作为氨基酸电子等排体或作为天然产物的生物等效类似物.在这一领域,β-氨基膦酸作为β-氨基酸的电子等排体占据有重要位置,因为它具有一些有趣的生物和生化特性,在抗菌剂[13]、酶抑制剂[14-15]、催化抗体[16]和抗HIV药物[17]中有广泛的运用.
2-氨基乙基膦酸是结构最简单的β-氨基膦酸,它分离自纤毛虫原生动物[18].构建C―P键的生物合成反应已被用于从生物来源合成2-氨基乙基膦酸盐[19]. 已报道的合成β-氨基膦酸衍生物的方法有金属基催化、有机催化和仿生合成.例如:奎宁催化的亚磷酸二苯酯与硝基烯烃对映选择性Michael加成反应合成氨基膦酸盐的前体[20];采用胍催化对映选择性合成氨基膦酸酯[21-22]等.相转移催化的Mannich反应已经成功用于β-氨基膦酸及其衍生物的合成中[23-25],使用结构合适的膦酸酯与α-氨基砜在相转移催化剂的作用下,可以实现β-氨基膦酸酯衍生物的合成.寻找结构合适的有机膦酸酯成为实现选择性合成β-氨基膦酸及其衍生物的关键.在前期的研究中,我们报道了一种通过相转移催化的(1-重氮基-2-氧代丙基)膦酸二甲酯(Ohira-Bestmann试剂)与α-氨基砜的Mannich反应制备β-氨基膦酸衍生物的方法[25].该方法可以高收率地获得β-氨基膦酸酯衍生物,但具有一定的局限性,如需要在-40℃低温下操作反应,且Ohira-Bestmann试剂价格昂贵,不易保存.鉴于此,我们尝试采用合成Ohira-Bestmann试剂的前体化合物(2-氧代丙基)膦酸酯作为膦酸酯亲核试剂与α-氨基砜反应,通过条件的筛选,拟开发出一条相对成本更低廉、操作更简便快捷的制备β-氨基膦酸衍生物的方法(图1).
1 实验部分
1.1 试剂与仪器Bruker Amazon SLKF0203G003离子阱质谱(MS)仪,Bruker Avance 400 MHz核磁共振仪,TMS内标,瑞士布鲁克公司;X-5显微熔点测定仪,北京泰克仪器有限公司;GA354薄层硅胶板和0.0 54~0.0 77 mm柱层析硅胶,青岛海洋化工厂.
苯甲醛、对甲基苯甲醛、邻甲基苯甲醛、对叔丁基苯甲醛、对甲氧基苯甲醛、邻甲氧基苯甲醛、对氟苯甲醛、邻氟苯甲醛、对氯苯甲醛、对溴苯甲醛、对硝基苯甲醛、1-萘甲醛、2-噻吩甲醛、呋喃甲醛、正丁醛、正戊醛、羰基二叔丁酯、对甲基苯磺酸钠、TBAB购于Acros、Fluka、Aldrich、阿拉丁等试剂公司,未纯化;氨水、四氢呋喃、甲酸、甲醇、甲苯、乙酸乙酯、氢氧化钠、氯化钠、无水硫酸钠均为市售分析纯试剂;实验中需要用的无水溶剂均按标准方法干燥;氨基甲酸叔丁酯为自制.
1.2 实验方法
1.2.1β-氨基膦酸酯合成 二异丙基(2-氧代丙基)膦酸酯与α-氨基砜的合成均按照参考文献报道方法[25,26]制备.二异丙基(2-氧代丙基)膦酸酯与α-氨基砜通过Mannich反应合成β-氨基膦酸酯系列衍生物.路线见图1.
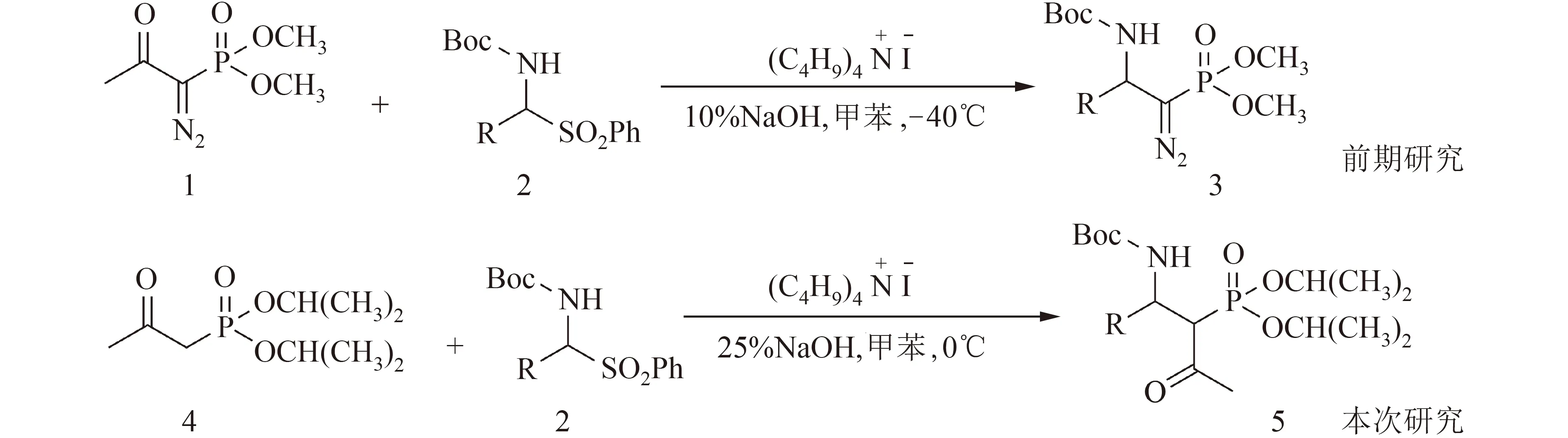
图1 β-氨基膦酸衍生物合成方法的比较Fig.1 Comparison of β-aminophosphonate synthesis methods
在0℃条件下,称取α-氨基砜2(58.72 mg,0.1 5 mmol),和二异丙基(2-氧代丙基)膦酸酯4(22.2 2 mg,0.1 mmol)溶于甲苯(1.5 mL)中,加入TBAB(6.4 4 mg,0.0 2 mmol)为催化剂,再加入质量分数为25%的氢氧化钠水溶液0.2 5 mL,搅拌反应,TLC监测反应进程至膦酸酯消耗完全.反应完成后加入20 mL乙酸乙酯稀释,用水和饱和NaCl溶液洗涤,收集有机相,无水硫酸钠干燥,浓缩后采用柱层析纯化,得化合物5a~5p.
1.2.2 化合物5a~5p结构的表征 化合物5a.无色液体,收率80%.1H NMR(400 MHz,CDCl3)δ:7.30~7.22(m,5H),5.24(m,1H),4.86~4.63(m,2H),3.77~3.51(m,1H),2.03(s,3H),1.45~1.21(m,21H).13C NMR(100 MHz,CDCl3)δ:204.93,154.76,141.04,128.49,127.27,125.94,79.10,60.34,33.15,28.34,24.14,23.71.LC-MS:[M+Na]+,m/z=450.20(计算),450.25(实测).
化合物5b.白色固体,收率85%,m.p.60~62℃.1H NMR(400 MHz,CDCl3)δ:7.20~7.05(m,4H),5.20(m,1H),4.81~4.65(m,2H),3.72~3.50(m,1H),2.29(s,3H),2.03(s,3H),1.49~1.16(m,21H).13C NMR(100 MHz,CDCl3)δ:205.04,154.57,136.8 6,129.1 8,126.7 0,125.8 4,79.1 2,72.0 6,58.8 3,33.1 9,28.3 6,28.2 7,23.7 5,20.9 7.LC-MS:[M+Na]+,m/z=464.2 2(计算),464.2 8(实测).
化合物5c.白色固体,收率84%,m.p.55~57℃.1H NMR(400 MHz,CDCl3)δ:7.22~7.03(m,4H),5.49(s,1H),4.87~4.60(m,2H),2.45(s,3H),1.9 9(d,J=16.6 Hz,3H),1.4 7~1.2 4(m,21H).13C NMR(100 MHz,CDCl3)δ:200.3 ,154.0 ,130.0 ,126.6 ,125.5 ,125.2 ,78.3 ,71.3 ,58.4 ,32.7 ,27.7 ,23.1 ,18.4 .LC-MS:[M+Na]+,m/z=464.2 2(计算),464.2 6(实测).
化合物5d.白色固体,收率81%,m.p.95~98℃1H NMR(400 MHz,CDCl3)δ:7.32~7.25(m,2H),7.1 8(dd,J1=16.9 ,J2=8.3 Hz,2H),5.2 8(d,J=9.9 Hz,1H),4.8 8~4.5 0(m,2H),2.1 0(s,3H),1.4 6~1.3 0(m,21H),1.2 8(s,9H).13C NMR(100 MHz,CDCl3)δ:204.0 ,154.1 ,148.9 ,125.6 ,124.8 ,124.6 ,78.2 ,71.1 ,57.9 ,33.5 ,31.9 ,30.2 ,27.6 ,22.9 .LC-MS:[M+Na]+,m/z=506.2 6(计算),506.2 8(实测).
化合物5e.白色固体,收率88%,m.p.65~67℃.1H NMR(400 MHz,CDCl3)δ:7.20~7.25(m,2H),7.12~7.03(m,2H),5.24(m,1H),4.81~4.65(m,2H),3.72~3.50(m,1H),2.29(s,3H),2.03(d,J=16 Hz,3H),1.49~1.16(m,21H).13C NMR(100 MHz,CDCl3)δ:205.0,158.7,154.5,133.2,128.0,127.1 ,113.8 ,79.1 ,72.0 ,71.9 ,55.1 ,33.1 ,28.2 ,23.7 .LC-MS:[M+Na]+,m/z=480.2 1(计算),480.2 5(实测).
化合物5f.粘稠液体,收率82%.1H NMR(400 MHz,CDCl3)δ:7.27~7.16(m,2H),6.92~6.79(m,2H),5.50(m,1H),4.85~4.47(m,2H),4.05~3.90(m,1H),3.86(d,J=10.5 Hz,3H),2.09(s,3H),1.4 0(s,9H),1.3 8~1.1 8(m,12H).13C NMR(100 MHz,CDCl3)δ:203.9 ,166.9 ,153.6 ,131.3 ,129.9 ,127.3 0,119.6 ,109.6 ,78.4 ,70.9 ,54.6 ,31.6 ,30.7 ,27.6 ,23.0 .LC-MS:[M+Na]+,m/z=480.2 1(计算),480.2 4(实测).
化合物5g. 淡黄色固体,收率79%,m.p.82~85℃.1H NMR(400 MHz,CDCl3)δ:7.23(dd,J1=12.7 Hz,J2=7.3 Hz,2H),7.0 5~6.9 2(m,2H),5.1 9(m,1H),4.8 2~4.6 3(m,2H),3.7 3~3.4 4(m,1H),2.0 4(s,3H),1.4 7~1.2 1(m,21H).13C NMR(100 MHz,CDCl3)δ:204.7 ,163.2 ,154.7 ,137.0 ,127.8 ,127.7 ,115.5 ,115.2 ,79.4 ,58.9 ,33.1 ,28.2 ,23.8 .LCMS:[M+Na]+,m/z=468.1 9(计算),468.2 2(实测).
化合物5h.粘稠液体,收率80%.1H NMR(400 MHz,CDCl3)δ:7.33(m,1H),7.25~7.16(m,1H),7.1 3~7.0 5(m,1H),7.0 0(m,1H),5.6 0~5.2 6(m,1H),4.9 0~4.5 3(m,2H),2.1 3(s,2H),1.5 6~1.1 1(m,21H).13C NMR(100 MHz,CDCl3)δ:203.5 ,159.3 ,131.2 ,129.6 ,127.9 ,123.3 ,78.3 ,70.9 ,31.6 ,27.2 ,22.6 ,18.0 .LC-MS:[M+Na]+,m/z=468.1 9(计算),468.2 4(实测).
化合物5i.白色固体,收率78%,m.p.89~91℃,1H NMR(400 MHz,CDCl3)δ:7.25(m,4H),5.3 3~4.9 6(m,1H),4.7 5(m,2H),3.7 3~3.4 6(m,1H),2.0 7(s,3H),1.5 3~1.1 1(m,21H).13C NMR(100 MHz,CDCl3)δ:203.2 ,166.3 ,132.2 ,129.9 ,127.3 ,126.3 ,77.9 ,70.9 ,64.3 ,32.0 ,27.3 ,22.7 ,18.1 .LC-MS:[M+Na]+,m/z=484.1 6(计算),484.2 0(实测).
化合物5j.白色固体,收率80%,m.p.45~47℃.1H NMR(400 MHz,CDCl3)δ:7.47~7.32(m,2H),7.47~7.32(m,2H),5.19(m,1H),4.82~4.64(m,2H),3.78~3.47(m,1H),2.08((s,3H),1.50~1.2 5(m,21H).13C NMR(100 MHz,CDCl3)δ:204.4 ,171.1 ,154.7 ,130.5 ,124.8 ,122.6 ,79.5 ,72.1 ,72.1 ,60.3 ,33.0 ,28.3 ,24.1 ,23.7 ,23.7 ,21.0 .LC-MS:[M+Na]+,m/z=528.1 1(计算),528.1 4(实测).
化合物5k.淡黄色液体,收率78%.1H NMR(400 MHz,CDCl3)δ:8.16(dd,J1=8.8Hz,J2=2.2 Hz,2H),7.47(dd,J1=14.7 Hz,J2=8.7 Hz,2H),5.35(m,1H),4.94~4.64(m,2H),3.80~3.46(m,1H),2.08(s,3H),1.51~1.21(m,21H).13C NMR(100 MHz,CDCl3)δ:204.4,155.9,149.8,128.1,127.2,123.8,79.9 ,72.4 ,58.6 ,32.9 ,28.3 ,24.1 ,23.7 .LC-MS:[M+Na]+,m/z=495.1 9(计算),495.2 4(实测).
化合物5l.淡黄色液体,收率66%.1H NMR(400 MHz,CDCl3)δ:8.15~7.95(m,2H),7.61~7.0 8(m,5H),5.3 6(m,1H),4.7 9~4.6 3(m,2H),3.9 4~3.7 3(m,1H),2.2 4(s,3H),1.5 4~1.2 2(m,21H).13C NMR(100 MHz,CDCl3)δ:204.4 ,171.1 ,150.9 ,141.6 ,110.5 ,106.5 ,79.4 ,71.9 ,60.3 ,32.2 ,28.3 ,24.1 ,23.7 .LC-MS:[M+Na]+,m/z=500.2 2(计算),500.2 6(实测).
化合物5m.淡黄色液体,收率81%.1H NMR(400 MHz,CDCl3)δ:7.14(dd,J1=11.7 Hz,J2=4.7 Hz,1H),6.96~6.82(m,2H),5.53(m,1H),4.70(dd,J1=11.8 Hz,J2=5.3 Hz,2H),3.88~3.59(m,1H),2.2 0(s,3H),1.5 0~1.2 2(m,21H).13C NMR(100 MHz,CDCl3)δ:204.7 ,171.1 ,154.7 ,145.7 ,126.8 ,124.2 ,79.4 ,72.2 ,60.3 ,33.0 ,28.3 ,24.1 ,23.7 .LC-MS:[M+Na]+,m/z=456.1 6(计算),456.1 9(实测).
化合物5n.淡黄色液体,收率79%.1H NMR(400 MHz,CDCl3)δ:8.06(d,J=8.3 Hz,1H),7.46~7.3 8(m,2H),6.1 3(m,1H),4.9 1~4.6 8(m,2H),3.8 9(m,1H),1.8 4(s,3H),1.2 9~1.6 2(m,21H).13C NMR(100 MHz,CDCl3)δ:205.6 ,168.5 ,154.8 ,134.0 ,126.7 ,122.1 ,79.3 ,72.3 ,60.6 ,49.2 ,33.9 ,28.1 ,24.1 .LC-MS:[M+Na]+,m/z=440.1 8(计算),440.2 5(实测).
化合物5o.白色固体,收率81%,m.p.76~78℃.1H NMR(400 MHz,CDCl3)δ:4.82~4.58(m,2H),4.14(m,1H),3.37(m,1H),2.31(s,3H),1.65~1.4 9(m,2H),1.4 9~1.2 0(m,23H),0.9 6~0.7 5(m,3H).13C NMR(100 MHz,CDCl3)δ:203.8 ,154.0 ,77.8 ,70.7 ,57.4 ,48.4 ,35.5 ,30.4 ,27.4 ,22.8 ,18.4 . LCMS:[M+Na]+,m/z=416.2 2(计算),416.2 5(实测).
化合物5p.白色固体,收率79%,m.p.68~72℃.1H NMR(400 MHz,CDCl3)δ:4.81~4.49(m,2H),4.06(m,1H),3.43~3.15(m,1H),2.24(s,3H),1.5 3(m,2H),1.3 5(s,9H),1.3 1~1.1 4(m,16H),0.8 1(t,J=6.5 Hz,3H).13C NMR(100 MHz,CDCl3)δ:202.5 ,154.1 4,77.9 ,70.3 ,57.3 ,48.3 ,33.0 ,30.7 ,27.4 ,22.9 ,21.2 ,12.8 .LC-MS:[M+Na]+,m/z=430.2 3(计算),430.2 6(实测).
2 结果与讨论
2.1 合成β-氨基膦酸酯的反应条件优化在β-氨基膦酸酯衍生物的合成中,以二异丙基(2-氧代丙基)膦酸酯和茴香醛衍生的α-氨基砜的反应作为模板反应,对反应条件进行初步优化.首先,选用两种常见的相转移催化剂TBAB和十八冠六醚(18-Crown-6)作为相转移催化剂.TBAB作为相转移催化剂时,收率优于十八冠六醚.再以TBAB作为催化剂,对模板反应进行初步优化,当以相同质量分数的氢氧化钠、氢氧化钾溶液分别作碱时,氢氧化钠溶液表现较优.后续对氢氧化钠溶液的质量分数和用量进行了筛选,当氢氧化钠溶液的质量分数为25%时,产率较优.对溶剂的量和反应温度进行初步筛选,得出温度为0℃,溶剂的用量为1.5 mL时产物收率最高.从表1的优化结果可得知,该反应当以TBAB(x=20%)作为催化剂、25%的氢氧化钠溶液做碱、1.5 mL甲苯作溶剂在0℃下反应,催化产物的收率较高.
2.2 反应底物的扩展在上述优化反应条件下对反应底物进行扩展,发现该反应具有良好的底物适应性.芳香醛和脂肪醛衍生的α-氨基砜均能与二异丙基(2-氧代丙基)膦酸酯发生反应并且获得较好的收率(表2,序号1~16).当α-氨基砜的苯环上没有取代基或者连有给电子基团(如CH3―,CH3O―)时,反应速率较快,收率高(表2,序号1~6),且取代基的位置(2-位,4-位)对反应速率没有明显影响.当α-氨基砜的苯环上连有吸电子基团(如F―,Cl―,Br―)时,反应速率和收率也不受取代基的影响(表2,序号7~10),甚至当苯环上连有强吸电子的基团硝基时,也能获得78%的收率(表2,序号11).当α-氨基砜的苯环部分变成萘环时,由于空间位阻原因,收率较低(表2,序号12);当α-氨基砜的芳香环换为五元杂环(呋喃、噻吩)时,反应速率略有提高,β-氨基膦酸酯衍生物收率也能达到80%(表2,序号13~14). 由脂肪醛衍生的α-氨基砜也能顺利的和二异丙基(2-氧代丙基)膦酸酯发生反应,获得较好的收率(表2,e序号15~16).
3 结论
综上所述,本文研究了TBAB催化的(2-氧代丙基)膦酸二异丙酯与α-氨基砜的Mannich反应.通过条件筛选,确定了0℃下,以TBAB为催化剂,甲苯为反应溶剂和25% NaOH水溶液为碱的最佳反应条件.(2-氧代丙基)膦酸二异丙酯与芳香醛和脂肪醛衍生的α-氨基砜均能顺利发生Mannich反应,β-氨基膦酸酯的收率最高可达88%.(2-氧代丙基)膦酸二异丙酯与Ohira-Bestmann试剂相比较,具有合成简便,价格低廉的优点.该β-氨基膦酸酯合成方法反应条件温和,操作简便,底物适应性广泛.通过(2-氧代丙基)膦酸二异丙酯与α-氨基砜的Mannich反应,提供了一条便捷的制备β-氨基膦酸酯衍生物的途径.
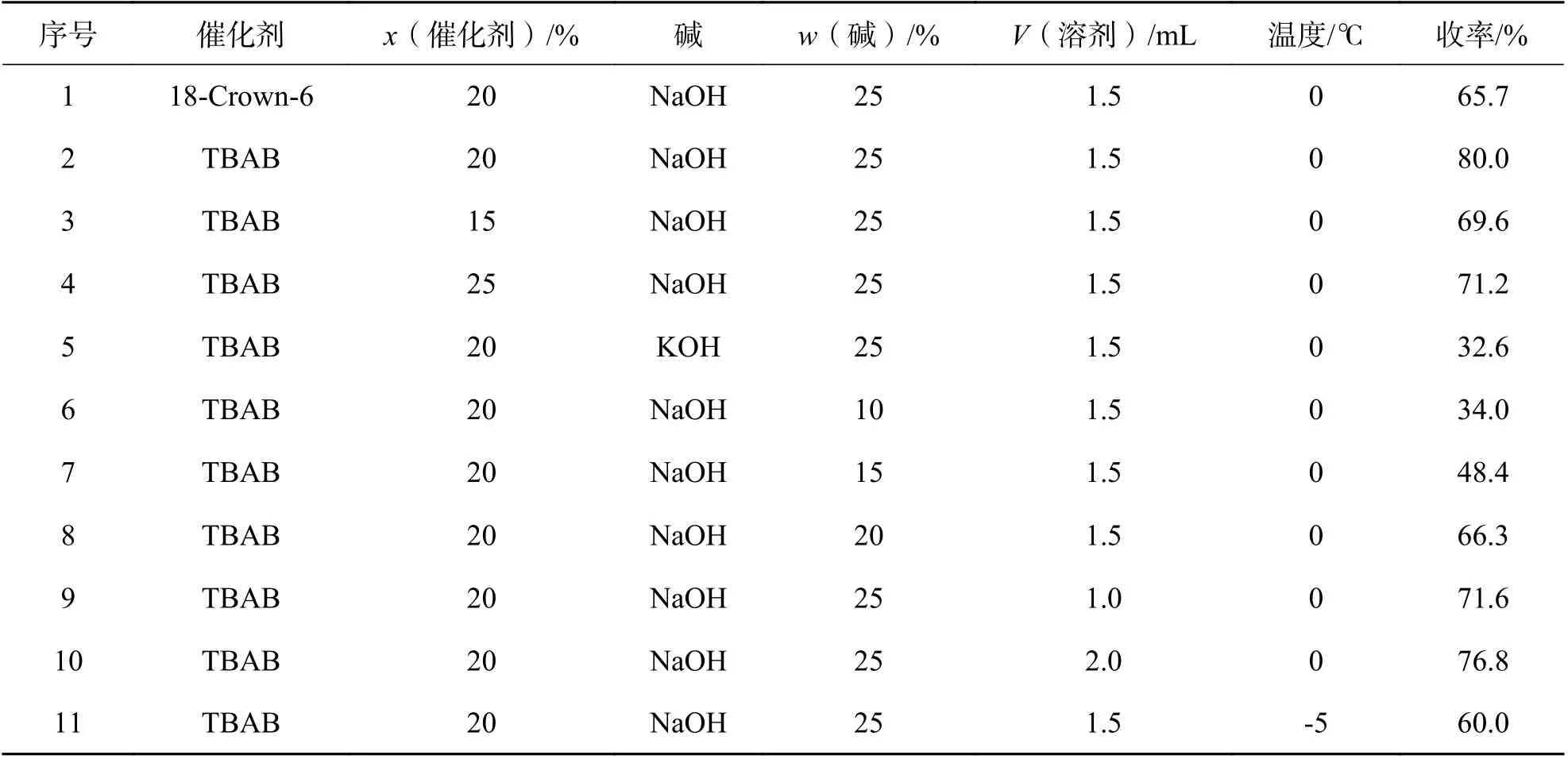
表1 合成β-氨基膦酸酯反应条件的优化Tab.1 Optimization of reaction conditions for β-aminophosphonate synthesis

表2 反应底物的扩展aTab.2 Reaction substrate expansiona

