加拿大紫荆种子硬实性解除及其吸水特性研究
张 琪,钱 滕,王 欢,朱铭玮,李淑娴*
(1. 南京林业大学林学院,南方现代林业协同创新中心,江苏 南京 210037;2. 安徽林业职业技术学院,安徽 合肥 230031)
加拿大紫荆(Cerciscanadensis)为苏木科紫荆属小乔木,原产加拿大南部、美国东部和墨西哥北部[1],其花色多样、颜色艳丽,叶片色彩随季节多变,是集观花、观叶于一体的园林造景树种,具有良好的观赏价值[2]。加拿大紫荆以种子繁育为主,然而由于种皮致密坚硬,导致成熟种子很难吸水萌发,这给种子质量检测、田间播种繁殖等工作带来很多不便。因此,有必要对解除种皮硬实性的条件以及种子吸水特性开展研究。关于种子硬实性的解除方法通常有化学处理、物理处理、生物处理3种[3],热水处理最为常用[4-5]。在种子吸水特性方面,针对豆目植物种子的研究较多,并认为种脊(lens)、种脐(hilum)、种孔(micropyle)均可能成为种子的初始吸水位点。密封法和染色法是研究种子吸水途径的常用方法[6-8]。已有学者对加拿大紫荆播种繁育技术进行了研究[2,9-10],但关于种皮结构、吸水对破除种子休眠的影响鲜见报道。本研究以一定温度梯度的热水处理加拿大紫荆种子,探究解除种子硬实性的最适条件,采用苯胺蓝染色法确定种子的吸水点位和吸水后水分在种子内部的迁移情况,结合凡士林密封法,定量分析种子不同部位吸水量的差异。同时通过种皮结构的显微观察,分析种皮结构对吸水的影响,以期了解种子生物学特性,并用于指导加拿大紫荆的育苗生产。
1 材料与方法
1.1 实验材料
加拿大紫荆种子于2016年10月下旬采集于美国密苏里州Elsberry市。2017年2月在南京林业大学种子中心采用水选法除去空粒、瘪粒、虫害粒,阴干后置于4 ℃冰箱保存备用。
1.2 种子硬实性确定
为探究种皮的透水性,分别取加拿大紫荆完整种子和切除子叶末端(机械损伤)的种子各50粒,重复3次,用1/1 000天平称取其质量(g),然后将种子分别放入装有热水的烧杯中,20 ℃室温下吸水。分别在浸种6、12、18、24、36、48、60 h时取出种子,擦干种子表面水分后再次称量,按公式:吸水率=(浸种后的质量-浸种前的质量)/浸种前的质量×100%计算吸水率并绘制吸水曲线,比较完整种子、机械损伤种子吸水率的差异。
1.3 种皮硬实性的解除试验
取若干加拿大紫荆种子,设3个处理组,分别以温度为70、80、90 ℃的热水处理5 min,置于25 ℃恒温箱中使其自然冷却,浸种24 h后统计各处理种子的吸胀率。对照用清水处理相同时间,每组设3次重复,每重复100粒。随机取以上各处理的种子,参照林木种子检验规程(GB 2772—1999)[11],用四唑染色法测定各处理种子的生活力。未吸胀的种子,染色前需用单面刀片切除子叶末端以使其吸水。
1.4 种皮结构扫描电镜观察
选取饱满的加拿大紫荆种子,分为对照组和处理组,对照组未经任何处理,处理组采用种皮硬实性解除试验中的最佳条件解除种子的硬实性。借助扫描电镜(SEM),分别对两组种子的种皮表面、纵切面的细胞结构进行微观形态观察。样品均按照SEM生物样品制备中临界点干燥方法[12]进行处理。
1.5 种皮不同部位吸水率差异测定
取加拿大紫荆种子若干,采用种皮硬实性解除试验中的最佳条件解除其硬实性后,以凡士林密封法测定种子不同部位的吸水情况。参照Rodrigues-Junior等[13]的方法将种子划分为3等份:种脐端(包括种脐、种孔等)、中间部位和子叶末端。用凡士林分别对种子作5个处理(标记为处理Ⅰ、Ⅱ、Ⅲ、Ⅳ、CK):Ⅰ,种脐端未用凡士林密封;Ⅱ,子叶末端未密封;Ⅲ,种子的中间部位未密封;Ⅳ,用凡士林密封整粒种子;CK则不用凡士林密封种子。每个处理设50粒×3重复。按上述方法密封种子后分别置于装有热水的烧杯中,浸种3、6、9、12、15、18、21、24、36、48、60、72、84、96、108、120 h后取出种子,用吸水纸擦除种子表面的凡士林及其水分后称量。用凡士林再次密封种子第1次密封的部位、浸种、称量,直至对照组种子达到吸水平衡。计算各处理的吸水率,绘制吸水曲线,比较种子各部位吸水率的差异。
1.6 种子初始吸水位点及吸水后水分移动路径的观察
随机取若干粒加拿大紫荆种子,采用前期试验中最佳条件解除其硬实性后,将种子浸泡在质量分数为1%的苯胺蓝溶液中,置于35 ℃黑暗培养箱,分别在浸种1、2、3、4、5、6、9、12、24、36 h后随机取出若干种子,用单面刀片将种子从中间部位纵切,置于OLYMPUS SZX16体视显微镜下观察种子的染色情况。
1.7 数据分析
用Excel 2007进行数据整理和制图,SPSS 17.0对各测定指标进行数据处理和方差分析。
2 结果与分析
2.1 加拿大紫荆种皮的透水性
加拿大紫荆完整种子和机械损伤种子的吸水曲线见图1。

图1 加拿大紫荆种子的吸水曲线Fig.1 The curves of water absorption of Cercis canadensis seeds
由图1可知,机械损伤种子的吸水率远远高于完整种子。吸水至24 h时,完整种子的吸水率为3.1%;继续浸种,种子吸水率上升仍比较缓慢,至60 h时,完整种子吸水率仅为10.4%。而机械损伤种子24 h时的吸水率已达到99.5%,随后种子的吸水速率趋于平缓。其中,处理组和完整种子吸水率的差异,说明透水性差是造成加拿大紫荆种子休眠的一个重要原因。
2.2 种子硬实性的解除方法
加拿大紫荆种子具有很强的硬实性,经不同温度的热水处理后,种子的吸胀率和生活力结果见表1。由表1可知,浸种24 h后,对照组的吸胀率只有4.3%,随着处理热水温度的上升,吸胀率也随之提高,采用90 ℃的热水处理5 min时,吸胀率达98.7%;采用温度为80 ℃的热水处理相同时间,吸胀率达到97.3%,二者差异不显著。表1中,对照组种子的生活力非常高,可达100%,各处理组中,只有温度为90 ℃处理的种子生活力显著下降,而其他处理的种子生活力与对照组均无显著差异。综合考虑种子吸胀率和生活力2个指标,80 ℃热水处理5 min对解除加拿大紫荆种子硬实性的效果最好,种子吸胀率高,并且生活力也能维持较高的水平。

表1 不同温度的热水处理后加拿大紫荆种子的吸胀率和生活力
2.3 加拿大紫荆种子的种皮结构
1) 种皮表面微观结构。加拿大紫荆种皮表面光滑,呈扁椭圆形(图2A),种脐处有两条明显的窄裂缝(图2B)。种子的裂缝中覆盖有大量胶状物(图2C),热水处理后胶状物质消失,裂缝也更为明显(图2D)。子叶末端区域在热水处理后,种皮表面的裂缝稍有增多(图2E、2F),其他并无明显变化。

A.种皮表面seed coat surface(20×);B.种脐端hilar region(50×);C. 对照组种脐端hilar region in the control seed(150×);D.处理组种脐端hilar region of seed treated by hot water(150×);E. 对照组子叶末端bottom of cotyledon in the control seed(500×);F.处理组子叶末端bottom of cotyledon of seed treated by hot water(500×)。图2 加拿大紫荆种子种皮表面形态结构Fig.2 The surface micro-morphological characters of Cercis canadensis seeds
2) 种皮纵切面超微结构。对加拿大紫荆种子纵切面的种脐区域(the hilar region)、种脐的对面(away from the hilar region)、中间部位、子叶末端部位种皮的超微结构观察发现(图3):大多数部位的种皮由3层结构组成,最外侧为致密并覆有蜡质的角质层(cutile layer),与角质层紧挨着的是由单层长柱状大石细胞紧密排列而成的栅栏层(palisade layer)(图3A、3B)。栅栏层内侧为厚壁细胞层(sclerenchyma layer),该层细胞形状不规则,种脐区域组织疏松,种脐的对面组织排列较紧密(图3B)。种脐区域的种皮,除了这3层结构,在栅栏层外侧与角质层之间有一条平行于种皮表面的连续的线,称为明线(light line)(图3B),明线与角质层之间有一层反栅栏层(counter-palisade layer)(图3C)。种脐区域还有一层特殊的螺纹状维管束(vascular bundle),维管束将厚壁细胞层分成两部分(图3C、3D),始自种脐区域,并沿种皮向子叶末端延伸。
热水处理前后加拿大紫荆种子种脐区域细胞结构变化明显。处理前,种脐部位的种皮紧密贴合(图3A);处理后,种脐处裂缝开口增大,近种孔处种皮的栅栏层与厚壁细胞层分离,形成一个凸起(bulge)(图3E)。热水处理前,种脐与厚壁细胞和维管束的相接处有大量胶状物质存在(图3C);处理后,这些胶状物质也随之溶解(图3F)。
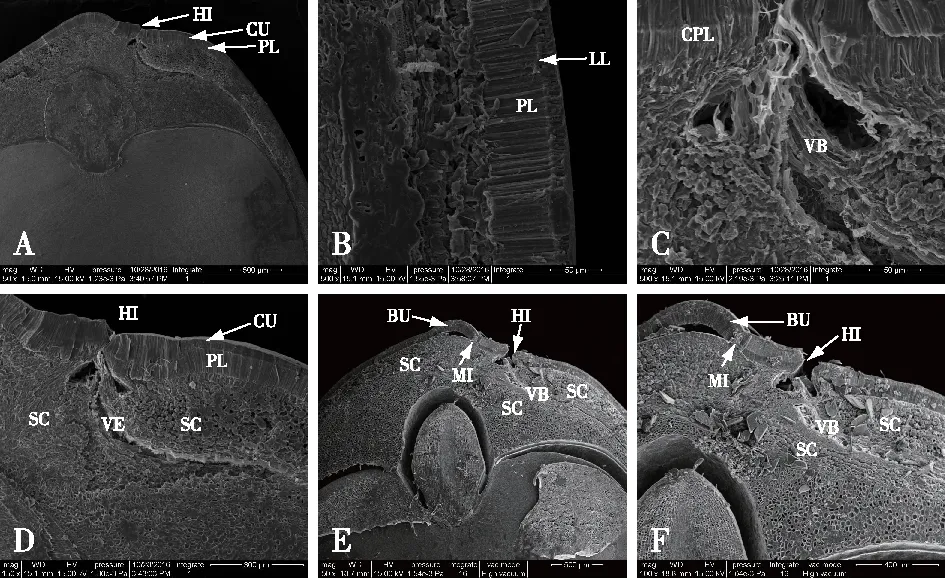
A.对照组种脐区域纵切面the longitudinal section near hilar region of the control seed(50×);B. 栅栏层结构palisade layer(500×);C.维管束结构vascular bundle(500×);D. 对照组种脐区域纵切面放大hilar region of CK(150×); E. 处理组种脐区域纵切面hilar region of the seed treated by hot water(50×);F. 处理组种脐区域纵切面放大hilar region of the seed treated by hot water(100×)。BU. 凸起bulge; CPL. 反栅栏层counter-palisade layer; CU. 角质层cuticle layer;HI. 种脐hilum;LL. 明线light line;MI. 种孔micropyle; PL. 栅栏层palisade layer;SC. 厚壁细胞sclerenchyma cells;VB. 维管束vascular bundle。图3 加拿大紫荆种子纵切面的扫描电镜结构观察Fig.3 The longitudinal section structure of Cercis canadensis seed coat revealed by scanning electron microscopy (SEM)
2.4 加拿大紫荆种子吸水特性
2.4.1 种皮不同部位吸水速率的差异
解除硬实性的种子,采用凡士林密封不同部位后,各处理的吸水情况见图4。由图4可知,完全密封的种子(处理IV),在吸水120 h后,吸水率仅为0. 6%,说明用凡士林密封种皮不同部位来研究种子吸水特性的方法是可行的。加拿大紫荆种子的吸水速度呈慢—快—慢的变化趋势,各吸水阶段,对照组种子的吸水速率明显快于密封种子不同部位的3个处理。在密封种子不同部位的3个处理中,它们的吸水速率也不相同:吸水12 h时,处理Ⅰ的吸水率为10.8%,显著高于处理Ⅱ和处理Ⅲ,此时Ⅱ、Ⅲ两个处理基本没有吸水,其吸水率分别为0.2%、0.5%,因此浸种12 h时只有种脐端吸水;吸水96 h时,处理Ⅰ的吸水率达88.6%,仍然显著高于处理Ⅱ和处理Ⅲ,此时处理Ⅲ的吸水率为5.0%,较之前略有上升,因此中间部位开始有吸水的迹象,但与处理Ⅱ差异仍不显著;吸水120 h时,处理Ⅲ的吸水率为12.0%,仍然远低于处理Ⅰ(91.4%),但已显著高于处理Ⅱ。本研究结果说明,加拿大紫荆种子刚吸水时,种脐端吸水较多,直至后期(96 h)种子中间部位才略有吸水,浸种120 h时,子叶末端的吸水率仍是很低。

图4 加拿大紫荆种子不同部位吸水曲线Fig.4 The curves of water absorption by blocking different parts of Cercis canadensis seeds
2.4.2 染色法确定加拿大紫荆种子吸水途径
从种子的纵切面可以发现,子叶占加拿大紫荆种子结构的绝大部分,胚的外面包裹着一层胶状胚乳残余组织,且胚根端的残余组织较厚。从该纵切面还可以看到,胚根端的种皮较其他部位更厚(图5A)。热水处理解除硬实性的种子,1 h时种皮未能染色(图5A);2 h时(图5B),厚壁细胞层与栅栏层分离,形成一个凸起(BU),染液由种孔进入该分离处,致使种孔部位最先染色,说明此时该部位有水分进入;3 h时(图5C),种脐裂缝处的种皮开始着色;4 h时(图5 D),厚壁细胞层与栅栏层的分离区域进一步扩大,角质层和栅栏层着色面积也随之扩大,并且染色区域大于种脐处;9 h时(图5E),种脐一侧的厚壁细胞层与栅栏层的分离区域和染色区域进一步扩大。从图中还可以发现,染液由裂缝处沿着维管束通道向子叶末端扩散,但厚壁细胞没有染色,说明水分不能进入厚壁细胞中;种脐对面区域也是仅在角质层和栅栏层有着色。染色36 h时(图5F),整个种皮充满了苯胺蓝染液,并且厚壁细胞层也被着色。
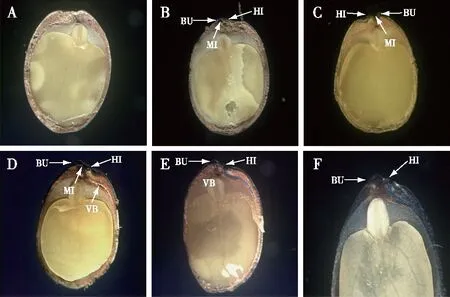
A.染色1 h;B.染色2 h;C.染色3 h;D.染色4 h; E.染色9 h;F.染色36 h。Dyed in aniline blue for 1 h (A),2 h (B),3 h (C),4 h (D),9 h (E),36 h (F). HI.种脐hilum;MI.种孔micropyle;VB.维管束vascular bundle;BU.近种孔端的凸起bulge。图5 加拿大紫荆种子苯胺蓝染色结果Fig.5 Water entry sites in Cercis canadensis seeds displayed using aniline blue dye
3 讨 论
3.1 种子硬实性的解除
解除种子硬实性的方法有多种,最常见的有酸蚀处理、机械处理和热水处理。酸蚀处理不如机械处理和热水处理法经济、环保,但机械处理方法操作比较复杂,不适用于大规模的种苗生产[14]。热水处理可使种皮得以软化、适当开裂,还可去除种皮表层的油脂和蜡质,改善种皮透性,解除种子硬实性进而促进萌发[15]。结合热水处理后加拿大紫荆种子吸胀率和生活力的结果,最终确定解除该种子硬实性的最佳条件为:始温80 ℃ 热水处理5 min。
3.2 种皮结构与吸水特性的关系
完整种子的吸水研究结果表明,加拿大紫荆种子具有较强的硬实性,即具有明显的物理休眠特性,自然状态下种子很难吸水萌发。种皮结构及细胞排列方式的不同都会影响种皮的透性,进而对种子吸水特性有影响。加拿大紫荆的种皮表面(角质层)覆有较厚的蜡质,这是影响种子吸水的重要原因。有学者认为,种子的物理休眠与种皮中不透水的栅栏层有关[16]。杜凤国等[17]认为紫椴(Tiliaamurensis)种子种皮中紧密排列的柱状石细胞、种脐处增厚的角质层以及种孔处的石细胞造成了种皮的不透性。De Souza等[18]认为明线是阻碍种子吸水的一道屏障。加拿大紫荆种子也具有角质层、明线、栅栏层等结构,它们可能是造成成熟(干)种子不能顺利吸水的重要原因。本次苯胺蓝染色9 h后,种脐一侧的维管束被染色,而厚壁细胞开始未染色,36 h后才被染色,这说明热水处理后,厚壁细胞在一定程度上仍会阻碍种子吸水的进行。
有学者认为,除了角质层和栅栏层,成熟种子的种孔和种脐等部位呈关闭状态,可以阻止外界水分进入种子体内,这也可能是豆目植物种皮不透水的重要原因[19]。还有研究者认为,种脐部位常被种子分泌的一些不透水物质所填充,从而使种子具有不透性[20]。对本研究中加拿大紫荆种子的电镜观察发现,成熟种子种脐裂缝和维管束连接处覆盖着白色蜡质物,热水处理后蜡质被溶解,缝隙变宽,从而使水分能够进入种皮内部,使种孔端栅栏层与厚壁细胞分离。热水处理前后种皮结构的变化表明,紧闭的种脐及其缝隙中的蜡质是造成该种子难以吸水的原因之一,也是造成种子物理休眠的重要原因。
加拿大紫荆种子在夏末秋初成熟,如果它们在冬季来临之前就已经发芽,幼苗就不能正常越冬。上述种脐、种孔的特殊变化以及种脐所在一侧种皮较厚、反栅栏层、明线等特殊结构的存在,是种子在进化过程中形成的一个重要适应性状,为促使种子在最理想的环境条件下萌发提供了保障,但这些休眠特性对种子检验以及播种育苗生产也带来了一些不利影响。
3.3 加拿大紫荆种子的初始吸水位点及吸水后水分的移动规律
密封法可以对种子不同部位的吸水情况进行量化分析,以此判断种子的初始吸水区域。有学者用凡士林密封种子不同部位的方法,推测种脐是刺叶锦鸡儿(Caraganaacanthophylla)和荒漠锦鸡儿(C.roborovskyi)种子的主要吸水位点[21],这与本研究结果类似。加拿大紫荆种子吸水12 h时,种脐区域的吸水率远高于种子中间部位及子叶末端(后面两个部位此时基本没有吸水),因此种脐区域是种子最初的吸水部位。
苯胺蓝染色法能够对水分的迁移路线进行示踪,在种子吸水机理的研究中常被采用。本研究发现:水分最初由种孔进入种皮,随后种脐的裂缝处也有水分进入,由于厚壁细胞层与栅栏层的分离,使水分能够沿种皮向子叶末端方向延伸,同时水分还能够沿维管束组织进行迁移,另外还发现吸水前期(9 h)厚壁细胞层对种子吸水仍有一定的影响。由于苯胺蓝是大分子染料,不能进入种胚,因此该方法只适合于研究种皮早期的吸水过程。虽然苯胺蓝能进入胚乳组织中,但本次并未观察到不同吸水阶段苯胺蓝运动的变化规律,因此该方法也不能用来确定水分在胚乳组织中的迁移规律。

