地塞米松玻璃体内植入剂治疗难治性非感染性葡萄膜炎的有效性与安全性
陈青山,梁思颖,赵 霞,胡晨丽,阳 铭,陈妙虹,曾 平
0引言
葡萄膜炎按病因分为感染性和非感染性,有研究表明我国非感染性葡萄膜炎占总葡萄膜炎比例为84.2%~95.1%[1-2]。国外相关研究显示非感染性葡萄膜炎占致盲性眼病的10%~15%[3-5]。除葡萄膜外,该类疾病还可累及视网膜、视神经和玻璃体引起黄斑水肿、炎性玻璃体混浊等[3-4]。中间葡萄膜炎与后部葡萄膜炎因解剖位置靠后,发病较前部葡萄膜炎隐匿,且眼表药物作用有限,最终容易发展为难治性葡萄膜炎,造成更为严重的视力损害[3,5]。而难治性葡萄膜炎一般定义为需要长期全身使用糖皮质激素或免疫抑制剂,存在严重并发症风险或应答不良及减量后反复发作的葡萄膜炎[6]。糖皮质激素类药物因强大的抗炎及免疫抑制作用而广泛应用于非感染性葡萄膜炎的治疗,局部或全身用药是糖皮质激素类药物最为常见的给药途径。对于中间部或后部的葡萄膜炎,眼表局部用药很难作用到晶状体虹膜膈以后的眼部组织,而全身用药由于血-眼屏障的存在则需要很高的血浆药物浓度从而达到眼内有效药物浓度。长期大剂量的糖皮质激素药物全身应用不仅会干扰糖和脂肪代谢,还会导致骨质疏松、高血压等一系列并发症,并增加感染风险[6-7]。近年来,国内外多项研究表明地塞米松玻璃体腔注射或植入可以有效控制玻璃体腔炎症及黄斑水肿,降低全身糖皮质激素用药剂量及不良反应[6-9],HURON研究表明缓释型地塞米松玻璃体植入剂用于治疗非感染性葡萄膜炎具有药物作用时间长、疗效显著及安全性高等特点[10],即使对于玻璃体切除术后的葡萄膜炎,地塞米松玻璃体内植入剂的长期疗效依然显著,具有药代动力学的明显优势[11]。目前地塞米松玻璃体内植入剂用于难治性非感染性葡萄膜炎的报道相对较少,本研究回顾分析了我们应用地塞米松玻璃体内植入剂治疗难治性非感染性葡萄膜炎的临床疗效,现将结果报告如下。
1对象和方法
1.1对象纳入2018-01/2019-09在我院确诊为难治性非感染性葡萄膜炎并接受地塞米松玻璃体内植入剂玻璃体腔植入术治疗的患者19例21眼,其中男8例,女11例,年龄17~84(平均47.1)岁。本研究经暨南大学附属深圳市眼科医院伦理委员会批准(伦理号:20180102)并符合《赫尔辛基宣言》,患者均签署知情同意书。
1.1.1纳入标准(1)经眼底照相、荧光素眼底血管造影(fluorescein fundus angiography, FFA)和光相干断层扫描(optical coherence tomography,OCT)及实验室检查(外周血及眼内液检查)确诊为非感染性中间部及后部葡萄膜炎患者;(2)OCT示黄斑囊样水肿(增厚≥400μm),FFA显示视盘与视网膜毛细血管或视网膜静脉荧光素渗漏;(3)术前经非接触式眼压计测量眼压均正常(10~21mmHg,1mmHg=0.133kPa)、角膜后KP,房水闪辉(+~++);(4)B超显示玻璃体炎性混浊。
1.1.2排除标准(1)感染性葡萄膜炎(如梅毒、病毒、真菌、结核、弓形虫、常见的细菌感染等);(2)3mo内接受过眼内手术或眼内/球周/球后注射曲安奈德;(3)OCT提示存在黄斑前膜或玻璃体视网膜界面牵拉需要玻璃体手术者。
1.2方法
1.2.1收集一般资料收集纳入研究患者全身疾病及地塞米松玻璃体内植入剂植入前病程、用药情况。植入后1、2、4、6mo随访的BCVA、非接触眼压、黄斑中心凹视网膜厚度(central retinal thickness,CRT)、炎性玻璃体混浊评分。将国际标准视力表检测的视力转换成最小分辨角对数视力(LogMAR)[12],参照国际玻璃体炎性混浊评分标准的临床研究[13],玻璃体炎性混浊评分以眼底3个标志作为标准:视神经乳头、视网膜血管和神经纤维层,分4+、3+、2+、1+、轻微混浊、0级。4+:视神经乳头遮蔽;3+:能看到视神经乳头,但边界模糊;2+:能看到视网膜血管;1+:能看到视神经乳头和视网膜血管;轻微混浊:视盘边界轻度模糊,无法看到神经纤维层的正常条纹和反光;0级:均显示清晰。本组患者治疗前玻璃体混浊4+的4眼,3+的6眼,2+的9眼,1+的2眼。
1.2.2手术方法手术在无菌层流手术室进行。术前1d给予左氧氟沙星滴眼液点术眼,4次/日,手术方式为0.4%丁卡因表面麻醉,消毒铺巾后1%聚维酮碘冲洗结膜囊,颞下方角膜缘后3.5mm玻璃体腔植入地塞米松玻璃体内植入剂(其中双眼接受注射的患者,两只眼的注射间隔均≥1mo)。治疗及随访记录地塞米松玻璃体内植入剂植入患者有无结膜下出血及角膜上皮损伤、继发性青光眼、并发性白内障、植入剂迁移入前房、玻璃体牵引、玻璃体积血、黄斑裂孔、眼内炎及视网膜脱离等不良反应及并发症。
1.2.3植入的指征(1)伴有黄斑囊样水肿或玻璃体炎性混浊2+及以上的非感染性中间部及后部葡萄膜炎患者;(2)不耐受长期全身大剂量使用糖皮质激素或免疫抑制剂;(3)单眼植入。
1.2.4疾病复发和补救治疗措施炎症复发定义为与前次检查相比,前房细胞和/或玻璃体混浊较前增加2级或2级以上。随访过程中如发现炎症复发,首选糖皮质激素滴眼剂局部给药,若炎症仍无法控制,则联合口服糖皮质激素或免疫抑制剂进行治疗。

2结果
2.1患者基线临床资料本研究共纳入非感染性葡萄膜炎患者19例21眼,其中男8例(42%),女11例(58%),18~50岁中青年龄段患者11例(61%)。地塞米松玻璃体内植入剂植入前患者的葡萄膜炎病程均大于3(平均29)mo。本组患者葡萄膜炎病因为中间葡萄膜炎、白塞氏病、视网膜血管炎、非肉芽肿性葡萄膜炎、后葡萄膜炎、原田氏病及视网膜静脉周围炎,其中1例艾滋病控制后发生特发性视网膜血管炎,经感染科会诊同意后使用地塞米松玻璃体内植入剂,见表1。

表1 非感染性难治性葡萄膜炎患者基线资料
2.2地塞米松玻璃体内植入剂植入前后BCVA比较基线,地塞米松玻璃体内植入剂植入后1、2、4、6mo BCVA分别为0.671±0.469、0.527±0.431、0.492±0.488、0.366±0.364、0.376±0.374,差异有统计学意义(F=8.230,P=0.001)。随访显示患者植入后BCVA均较基线有显著提高。
2.3地塞米松玻璃体内植入剂植入前后CRT比较FFA及OCT检查显示地塞米松玻璃体内植入剂植入后患者视网膜血管渗漏与黄斑水肿较植入前明显缓解(图1),地塞米松玻璃体内植入剂植入后随访CRT均较基线显著降低(基线:369.667±177.100μm,1mo:298.571±155.577μm,2mo:265.714±188.552μm,4mo:253.810±183.043μm,6mo:264.571±194.036μm,F=7.361,P=0.001)。
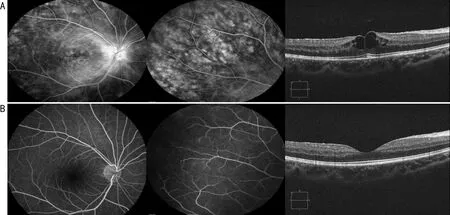
图1 右眼肉芽肿性后部葡萄膜炎合并黄斑囊样水肿治疗前后FFA及OCT A:治疗前;B:治疗后。
2.4地塞米松玻璃体内植入剂植入前后玻璃体炎性混浊评分比较地塞米松玻璃体内植入剂植入前玻璃体炎性混浊评分2.35±0.88分,植入后1、2、4、6mo玻璃体炎性混浊评分分别为1.25±0.79、0.58±0.61、0.47±0.52、0.75±0.93分。地塞米松玻璃体内植入剂植入后随访玻璃体炎性混浊评分较基线显著降低(均P<0.05,图2)。

图2 基线及地塞米松玻璃体内植入剂植入后玻璃体混浊评分变化。
2.5患者系统用药分析6例在基线时需口服醋酸泼尼松片及免疫抑制剂治疗,地塞米松玻璃体内植入剂植入后6mo随访,仅2例需口服醋酸泼尼松片5mg/d,其余患者全部停用糖皮质激素及其他免疫抑制剂。本研究中纳入4例4眼白塞氏病患者,3例3眼白塞氏病的患者在地塞米松玻璃体内植入剂治疗后4~6mo期间均出现黄斑水肿复发,1例患者再次口服醋酸泼尼松片30mg/d,联合甲氨蝶呤25mg/d,黄斑水肿控制。
2.6治疗后临床安全性分析基线,地塞米松玻璃体内植入剂植入后1、2、4、6mo IOP分别为14.26±3.44、18.74±9.03、19.34±6.82、17.07±3.72、15.89±2.43mmHg。地塞米松玻璃体内植入剂植入后随访患者平均眼压较基线升高,差异均有统计学意义(1mo:t=-3.043,P=0.002;2mo:t=-3.159,P=0.002;4mo:t=-2.858,P=0.004;6mo:t=-1.991,P=0.046)。植入2mo后有2例患者眼压升高需局部降眼压药物控制,但地塞米松玻璃体内植入剂植入后6mo随访所有患者眼压值均在正常范围内(6mo随访眼压范围:14.0~19.7mmHg),随访期间患者平均眼压变化见图3。

图3 基线及地塞米松玻璃体内植入剂植入后IOP变化。
2.7并发症分析随访过程中2例2眼患者因晶状体混浊加重行白内障手术治疗。其余患眼并未见明显晶状体混浊进展。本组患者中共5眼为人工晶状体眼,研究期间并无患者需行YAG激光后囊切开术,并未发现植入剂迁移入前房。手术后少数患者出现结膜下出血,但所有纳入患者均未出现继发性青光眼、玻璃体牵引、玻璃体积血、黄斑裂孔、眼内炎及视网膜脱离等严重不良反应及并发症。
3讨论
非感染性难治性葡萄膜炎是临床常见的致盲性眼病,尤其是位于中间部与后部的葡萄膜炎病程迁延且易反复,较前葡萄膜炎视觉损伤更严重、治疗更困难。糖皮质糖皮质激素作为目前非感染性葡萄膜炎的一线治疗选择,其系统性应用的副作用不可忽视,而传统的免疫抑制疗法仍然难以完全控制眼内炎症或维持疾病缓解[2-5,14]。与全身应用糖皮质激素相比,眼内糖皮质激素的直接应用避免了全身副作用,对于某些不能耐受全身用药的患者而言是更佳选择。
本研究纳入的男性患者占42%,中青年患者占总发病61%,比例构成与国内外葡萄膜炎相关的报道基本一致[15-17]。患者应用地塞米松玻璃体内植入剂前病程均大于3mo,平均病程为29mo,绝大部分既往有病情反复、糖皮质激素类药物多次全身应用史,体现非感染性葡萄膜炎患者病情迁延、难治的特征。研究显示,玻璃体腔植入地塞米松玻璃体内植入剂用于非感染难治性葡萄膜炎患者安全有效,可减轻黄斑水肿与玻璃体炎症,进而提高视力,同时减少全身糖皮质激素或免疫抑制剂的使用。
HURON临床研究证实玻璃体腔植入0.7mg地塞米松玻璃体内植入剂可以迅速改善BCVA、降低CRT与玻璃体炎性混浊并有效维持26wk,视力改善维持时间显著高于每月一次的抗VEGF药物注射治疗[10],与本研究结果相似。Alba-Linero等[18]在葡萄膜炎为期60wk的长期观察也得出类似结论。黄斑水肿和玻璃体炎性混浊是非感染性葡萄膜炎患者视力受损的主要原因[3,6,19-20],Pohlmann等的研究显示,非感染性葡萄膜炎患者植入地塞米松玻璃体内植入剂1mo后CRT即有显著降低[9,19-20],与本研究结果一致,但本研究纳入的患者在接受地塞米松玻璃体内植入剂植入前病程更长(平均病程29mo)。此外,本研究显示,地塞米松玻璃体内植入剂植入后历次随访,患者玻璃体炎性混浊均较基线明显缓解。这表明无论对于初次发作,还是复发的难治性非感染性葡萄膜炎,地塞米松玻璃体内植入剂植入均能快速改善黄斑水肿,缓解玻璃体炎症、提高视力。
眼压升高是糖皮质激素类药物眼部应用最主要的不良反应。本研究结果显示植入后1~6mo患者眼压与基线相比,植入后随访患者平均眼压较基线升高,差异有统计学意义。虽然平均眼压较基线升高,但平均眼压均在正常范围内。其中分别有2例患者在植入1、2mo后眼压升高达30mmHg,予以局部降眼压药物治疗后缓解,植入后6mo随访所有患者眼压均在正常范围内(<21mmHg)。本研究结果和既往研究相似,表明地塞米松玻璃体内植入剂植入后虽会引起部分患者眼压一定程度升高(2/21),但使用局部降眼压药物均可有效控制[7,9,21-23]。此外,Alba-Linero等[18]为期60wk的随访研究表明,再次植入对眼压的影响无累加作用。
由于慢性迁延性炎症和糖皮质糖皮质激素的使用,并发性白内障是葡萄膜炎患者最常见的并发症,本研究仅2眼(10%)在治疗随访期间行白内障手术,与既往玻璃体腔注射曲安奈德相比地塞米松玻璃体内植入剂引起并发性白内障的比例较低[24]。
顽固性黄斑水肿是白塞氏病的主要并发症之一,本研究中纳入的4例白塞氏病患者中3例在治疗后4~6mo出现视力下降,玻璃体混浊,视网膜水肿,导致病情复发。我们分析复发时玻璃体腔内地塞米松的药物释放剂量已达较低水平,不足抑制眼内炎症,导致玻璃体混浊,视网膜黄斑水肿可能是由于全身糖皮质糖皮质激素药物的减少和眼内地塞米松浓度的下降引起。地塞米松玻璃体内植入剂药代动力学结果显示,注射后2mo视网膜内地塞米松浓度维持在较高水平,随后急剧下降,低浓度继续维持3~4mo。复发的3例患者中,1例在增加了口服糖皮质糖皮质激素(醋酸泼尼松片30mg/d)和免疫抑制剂(甲氨蝶呤25mg/d)后黄斑水肿缓解。另外2例于6~8mo后再次接受了植入治疗,黄斑水肿获得完全缓解。考虑到患者复发时间在本研究中的一致性,我们推测可在3mo时使用预防性再次注射可以减少患者的复发,但对此还需要进行更多的研究才能得出进一步结论。
本研究结果表明,对于难治性非感染性葡萄膜炎在全身规范使用糖皮质激素或联合免疫抑制剂,在密切关注眼压变化的情况下,地塞米松玻璃体内植入剂玻璃体植入治疗非感染性难治性葡萄膜炎患者安全有效,可起到辅助治疗效果,减少系统性糖皮质激素及免疫抑制剂用量。但作为回顾性研究,存在样本量较小、平均随访时间偏短等局限性。仍需要大样本、多中心、前瞻性的随机对照研究为非感染性葡萄膜炎治疗提供更多临床依据。
- 国际眼科杂志的其它文章
- An overview on dry eye disease diagnosis: options for new non-invasive testing technologies
- Change of subretinal fluid thickness and choroidal thickness after scleral buckling surgery
- 人翼状胬肉中miR-486-3p的表达及其潜在靶基因的生物信息学分析
- 重组人生长激素对兔角膜损伤早期修复的研究
- 基于SD-OCT建立新的前膜分级法评估IMEM对年龄相关性白内障患者术后视功能的影响
- 氯喹性视网膜病变的监测方法

