Bacillus sp. Y112环糊精葡萄糖基转移酶位点R81定点突变提高产物特异性
李晓涵,郭姣梅,宋 凯,孙晶晶,王 伟,郝建华,*
(1.上海海洋大学食品学院,上海 201306;2.农业农村部极地渔业开发重点实验室,中国水产科学研究院黄海水产研究所,山东 青岛 266071;3.海洋药物与生物制品实验室,青岛国家海洋科学与技术实验室,山东 青岛 266071)
环糊精葡萄糖基转移酶(cyclodextrin glycosyltransferase,CGTase)属于糖基水解酶α-淀粉酶家族(家族13)[1]。CGTase能够催化包括环化、水解、偶联和歧化在内的4 种反应,其中环化反应是特征性反应,该反应可以以淀粉类基质作底物合成环糊精(cyclodextrin,CD)。目前,酶法合成是工业生产CD的主要方法。常见的CD包括α-CD、β-CD和γ-CD,分别通过α-1,4糖苷键连接的6、7 个和8 个葡萄糖单元组成[2]。CD分子具有外部亲水性和内部疏水性,其疏水性空腔可以包裹疏水性分子或基团形成包合物,改变被包埋物的物理及化学性质[3],因此在食品、药品和化妆品等方面有着广泛的应用[4]。
基于酶蛋白的同源建模或晶体结构的定点突变是一种改善酶催化活性及酶学性质的有效方法[5-7]。近年来,定点突变技术已被多次应用于改善CGTase的产物特异性[8]。将来自Paenibacillussp. 602-1的α-CGTase第195位点处的酪氨酸替换为精氨酸和赖氨酸的后,主要CD产物由α-CD变为γ-CD。其中突变体Y195I极大改变了产物特异性,催化生成的CD中β-CD和γ-CD所占比例比分别为34%和38%[9]。用谷氨酸和精氨酸取代来源于Bacillus circulansSTB01的CGTase中第577位的天冬氨酸,结果表明这2 种突变体都显著提高了β-环化活性,特别是变体D577R,其β-环化活力增加了30.7%[10]。郭永华等[11]对淀粉结合位点2第623位天冬氨酸进行饱和诱变,得到突变体N623T的总环化活力与原始酶比提高了58.6%。
CGTase包含A、B、C、D、E 5 个结构域,A结构域具有催化活性,B结构域有一个位于酶蛋白表面的凹槽,凹槽周围的一些氨基酸残基能够与底物发生作用,使底物有效结合到酶蛋白上,因此该区域称为底物结合域。在底物结合凹槽内有9 个糖基结合亚位点,标记为+2~-7[12],每个亚位点都可以结合一个葡萄糖残基。本实验对来源于Bacillussp. Y112的CGTase-3亚位点附近第81位的精氨酸进行定点突变,构建一种能够提高β-CD产物专一性的突变体R81T,并进一步纯化野生型和突变体CGTase用于比对其在催化活性、产物特异性及酶学性质方面的差异,旨在获得产物特异性高的优势酶。
1 材料与方法
1.1 材料与试剂
含CGTase基因的原始菌株Bacillussp. Y112由实验室筛选得到;重组质粒pET24a/cgt由实验室构建。
大肠杆菌感受态细胞BL21(DE3)、DH5α 北京博迈德公司;pET24a 德国Novagen公司;BCA蛋白定量试剂盒、质粒小提试剂盒 北京天根生化科技有限公司;Q5定点突变试剂盒 美国NEB公司;Ni2+亲和层析柱 美国GE公司;zorbax NH2柱(250 mm×4.6 mm,5 μm) 美国安捷伦公司;乙腈(色谱纯) 德国Sigma公司;引物合成和DNA测序服务由生工生物工程(上海)股份有限公司完成。
1.2 仪器与设备
定性梯度聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Biometra公司;GI54DS高压蒸汽灭菌锅 厦门致微仪器有限公司;JY96-IIN型超声波细胞粉碎机 宁波新芝科技生物股份有限公司;Bio-Rad MiniIII蛋白电泳仪 美国伯乐公司;DC-2006低温恒温槽 上海比朗仪器公司;AKTA快速液相色谱仪美国通用电气公司;Infinite M200Pro多功能微孔板检测仪 瑞士Tecan公司;高效液相色谱系统(配有RID-20A示差检测器) 日本岛津公司。
1.3 方法
1.3.1 引物设计及定点突变
对CGTase的第81位氨基酸序列AGA进行定点突变引物设计,正向引物为CTTAACAA AATATTGTGGTGGAGATTGGCAAGG,反向引物为TTTTTACAATCCTCCGAATAAAGT TCTCCTGATGGG。用Q5定点突变试剂盒对R81位点进行PCR。PCR体系:Q5 Hot Start High-Fidelity 2×Master Mix 12.5 μL、Forward Primer(10 μmol/L)1.25 μL、Reverse Primer(10 μmol/L)1.25 μL、Template DNA(10 ng)1 μL、Nuclease-free water 9 μL;PCR条件:98 ℃预变性30 s;98 ℃变性10 s,68 ℃退火30 s,72 ℃延伸4 min,25 个循环;72 ℃延伸2 min;然后对扩增产物进行环化和模板去除反应,将扩增产物直接加入到Kinase-Ligase-DpnI酶混合液中,室温条件下放置5 min后转化DH5α感受态细胞,37 ℃放置过夜,挑取平板单菌落测序。测序正确的突变体质粒转化到BL21(DE3)感受态细胞,37 ℃放置过夜,挑取单菌落保菌。
1.3.2 蛋白表达与纯化
将保菌的甘油菌按1%接种量接种到5 mL含有50 μg/mL卡那霉素的LB试管,37 ℃、200 r/min过夜培养作为种子液。再将种子液以2%接种量接种到150 mL含有50 μg/mL卡那霉素的LB液体培养基中,37 ℃、200 r/min培养至OD600nm在0.6左右[13],加入终浓度0.4 mmol/L的异丙基-β-D-硫代吡喃半乳糖苷(isopropylβ-D-thiogalactoside,IPTG),20 ℃诱导18 h。诱导结束后9 000 r/min离心10 min收集菌体,用10 mL的pH 8.0的磷酸盐缓冲液重悬菌体后在冰浴中超声破碎,然后8 000 r/min离心60 min后取上清液制成粗酶液。
粗酶液过镍柱纯化[14],上样后先用A液(20 mmol/L磷酸缓冲液,500 mmol/L氯化钠,pH 8.0)洗脱,待穿透峰跑平后用5%的B液(20 mmol/L磷酸缓冲液,500 mmol/L氯化钠,500 mmol/L咪唑,pH 8.0)洗脱杂蛋白。待杂蛋白洗脱峰跑平后用20%的B液洗脱目的蛋白CGTase。
1.3.3 酶活力测定
参考Jemli等[15]方法测定酶活力。0.2 mL 0.2 mol/L甘氨酸-NaOH缓冲液(pH 9)中加入10 μL酶液,再加入0.2 mL 0.2%可溶性淀粉溶液,40 ℃水浴反应10 min后加入0.5 mL 0.5 mol/L醋酸溶液终止反应,再加入3 mL 0.005%碘液显色。以不加淀粉溶液为空白组,不加酶液为对照组。在700 nm波长处测定吸光度,以吸光度下降10%的酶量定为1 个单位。酶活力计算公式如下:
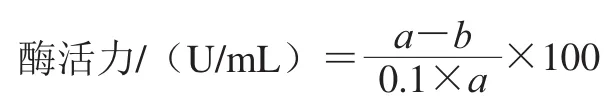
式中:a为对照减去空白的吸光度差值;b为样品减去空白的吸光度差值。
1.3.4 蛋白表达电泳验证和蛋白质含量测定
对诱导表达后的粗酶液以及镍柱纯化后的酶液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)验证蛋白表达及纯化效果。用BCA试剂盒对纯化后的蛋白含量进行测定[13]。
1.3.5 CD产物特异性分析
取1 mL 1%可溶性淀粉溶液,加入1 mL的适当稀释的酶液(100 U),总反应体积为2 mL。40 ℃水浴反应,每隔10 min取200 μL反应液,煮沸灭活10 min。灭活后的反应液过0.22 μm滤膜后取20 μL进行高效液相色谱分析。洗脱液为70%乙腈溶液,洗脱速率为1 mL/min,柱温箱温度为30 ℃。
1.3.6 酶学性质的对比
用不同pH值(pH 4.0~12.0)缓冲液测定大肠杆菌表达的原始酶和突变酶的最佳pH值。缓冲液种类分别为:柠檬酸缓冲液(pH 4.0~5.0)、Na2HPO4-NaH2PO4缓冲液(pH 6.0~8.0)、Gly-NaOH缓冲液(pH 8.6)和Na2HPO4-NaOH缓冲液(pH 10.0~12.0)[16],所用缓冲液pH值均在25 ℃测定。将原始酶和突变酶的酶液在上述各种缓冲液中于4 ℃温育12 h后测定剩余活力,对比2 种酶的pH值稳定性。在30~60 ℃范围内,测定原始酶和突变酶的最佳反应温度。将2 种酶溶液在10~60 ℃条件下温育12 h后测定剩余活力,对比2 种酶的热稳定性。酶活力测定方法参照1.3.3节。
1.3.7 同源模建与氨基酸序列比对
采用Swiss-Model(http://swissmodel.expasy.org)网站对CGTase进行三维结构模拟,并通过pyMOL对结构模型进行分析以及构建说明性图形。使用DNAMAN软件对氨基酸序列进行比对[17]。
1.4 数据处理
数据统计及图表绘制均利用Microsoft Office Excel 2007完成。
2 结果与分析
2.1 定点突变位点的选择

图1 带有γ-CD的原始CGTase的活性凹槽Fig.1 Active groove structure of the wild-type CGTase with γ-CD
同源建模得到的CGTase三维结构(图1)显示R81位于底物结合的活性凹槽。通过比对已知的CD酶蛋白结构确定了该位点位于-3亚位点附近。有研究[18-19]表明对CGTase底物结合亚位点周围的氨基酸进行定点突变可以影响环化活力和产物特异性,其中-6和-3底物结合亚位点在环化反应中起重要作用[8]。

图2 α-、β-和γ-CGTase序列对比Fig.2 Sequence alignment among α-, β- and γ-CGTases
对Bacillussp. Y112的CGTase与Paenibacillussp. 602-1[20]的α-CGTase、Bacillus circulans251的β-CGTase[21]、Bacillussp. G-825-6的γ-CGTase[22]的氨基酸序列进行比对(图2)可以发现,各种CGTase氨基酸序列中大部分氨基酸序列高度保守,其中γ-CGTase与其他2 种CGTase的相似程度较低。红色框中圈出的氨基酸位点为Bacillussp.Y112 CGTase的第81位氨基酸位点,此位点在α-CGTase中为赖氨酸,在β-CGTase中为精氨酸,在γ-CGTase中为苏氨酸。在α-CGTase和β-CGTase第81位点处的氨基酸虽然不同,分别为精氨酸和赖氨酸,但2 种氨基酸性质相似,都属于碱性氨基酸,且结构相似。而苏氨酸属于酸性氨基酸,且侧链较小[23]。所以推测将Bacillussp. Y112 CGTase第81位的精氨酸突变为苏氨酸可能倾向于产生较大的CD产物。
2.2 氢键比较
研究表明[24],氢键作用的改变可以影响酶的催化作用及底物的结合。图3为原始酶和突变酶第81位氨基酸残基的三维结构,标出了可能与该位点有氢键作用的氨基酸以及结合底物,由图3A可以看出,突变前的R81位点与氨基酸残基N79、T128有氢键作用,由于氨基酸侧链较长,还显示出与较远氨基酸残基D402和结合底物的氢键作用。突变后, R81T位点与周围氨基酸的氢键作用力有所改变,与D402的氢键作用力消失,增加了与G126位点的氢键作用力。图3还显示出,突变前R81位点的精氨酸与底物有氢键作用,该位点突变为苏氨酸后,由于氨基酸侧链变短,氢键与底物的作用力消失。氢键作用力的改变会对CGTase的环化作用产生影响[11]。Xie Ting等[9]的研究结果表明,当突变氨基酸的侧链不通过氢键与底物相互作用时,突变体倾向于形成更大的CD。侧链长度较短的氨基酸也可以加大底物结合凹槽的作用空间,有利于生成较大的CD产物。说明侧链大小和环化作用之间有一定的相关性。凌凯等[25]研究结果表明用侧链较短的氨基酸替换CGTase第48位点处的氨基酸能有效提高γ-CD的生成量。
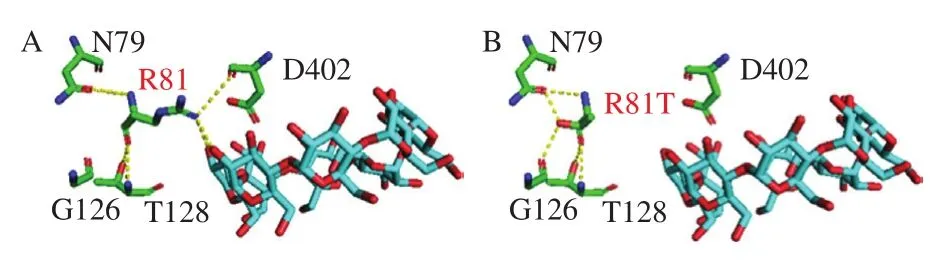
图3 原始酶(A)和突变酶(B)第81位氨基酸与周围氨基酸与γ-CD底物分子之间的氢键作用力Fig.3 Hydrogen bonding interaction of the amino acid residue 81 of wild-type (A) and mutant (B) CGTases with surrounding amino acid residues and substrate molecules
2.3 蛋白表达与纯化

图4 纯化后的原始酶及突变酶的SDS-PAGE分析Fig.4 SDS-PAGE analysis of purified wild-type and mutant CGTases
通过SDS-PAGE验证镍柱纯化得到的原始酶与突变酶的蛋白纯度,结果如图4所示。在75 kDa处显示为单一条带,达到电泳纯。测定纯化后的2 种酶的蛋白质量浓度及比活力,表1结果表明,与原始酶相比,突变酶的蛋白表达量及比活力没有明显降低。

表1 原始酶与突变酶比活力Table 1 Specific activity of wild-type and mutant CGTases
2.4 产物特异性分析
以1%的可溶性淀粉为反应底物分别与原始酶和突变酶反应,分析α、β和γ三种CD产物的生成量。如图5所示,2 种酶的主要产物均为β-CD,其产量在70 min到达最高,约为1.1 g/L,随后呈下降趋势。与原始酶相比,突变酶的α-CD产量下降明显,γ-CD在0~50 min内的生成量也有较明显的提高。计算反应70 min各种CD产物的所占比例及淀粉转化率(表2)可以看出,2 种酶的淀粉总环化率相差无几,α-CD所占产物比例降低8%,β-CD所占产物比例提高7%。说明用苏氨酸替代R81位点的精氨酸确实能够提高较大CD的生成率。

表2 原始酶与突变酶淀粉转化率Table 2 Conversion efficiency of soluble starch into cyclodextrins by wild-type and mutant CGTases
2.5 pH值和温度对酶活力的影响
在20~70 ℃的范围内测定原始酶和突变酶的最适反应温度,通过图6a可以看出,2 种酶均在50 ℃活力最高,在45~55 ℃范围酶活力保持在80%以上,且在60 ℃的高温下反应仍保留了60%以上活力。通过图6b可以看出,突变酶和原始酶在0~30 ℃放置12 h后仍保持了80%以上的热稳定性。且在20~30 ℃范围内表现出最好的热稳定性。说明原始酶和突变酶均为嗜热酶,且可以常温贮存。以上数据说明第81位精氨酸突变为苏氨酸后,突变体保留了原始酶良好的嗜热性及热稳定性。

图6 原始酶与突变酶的酶学性质Fig.6 Characteristics of wild-type and mutant enzymes
在pH 4.0~12.0范围内测定原始酶和突变酶的最适反应pH值和pH值稳定性,通过图6c可以看出,原始酶和突变酶的最适pH值为10.0,之后随pH值的升高酶活力下降明显。在pH 9.0出现酶活力先下降后上升的趋势,分析其原因是更换了缓冲液的种类;通过图6d可以看出,原始酶和突变酶在pH 10.0~11.0的范围内酶活较为稳定,保留了80%以上活力,之后随pH值的升高酶活力下降明显。说明与原始酶相比,突变酶在pH值方面的酶学性质无明显变化,保持了原始酶的嗜碱性。
3 结 论
本实验通过定点突变技术将来源于Bacillussp. Y112的CGTase N末端起第81位氨基酸的精氨酸突变为苏氨酸,突变体在保留了原始酶耐热性、嗜碱性及热稳定性的基础上,明显降低了α-CD产量,提高了β-CD产量,分析原因可能是因为精氨酸突变为苏氨酸后,氨基酸侧链变短,减小了空间位阻,增加了底物结合活性位点的空间,有利于生成较大体积的CD产物。通过分析氢键作用力,发现氨基酸突变后与周围氨基酸及底物的氢键作用力有明显改变。本实验结果可使研究者进一步了解底物结合亚基-3位氨基酸残基与环化反应的相关性。突变体R81T对提高催化产物的专一性以及应用于工业化CD生产有重要意义。
然而单一突变在改善产物特异性方面的作用有限,迭代饱和诱变[26]是CGTase定向进化的有效方法。Han Ruizhi等[27]利用这项技术建立了多位点突变体Y167S/G179K/N193R/G180R,其L-抗坏血酸-2-葡萄糖苷滴度达到2.12 g/L,比野生型高84%。Tao Xiumei等[28]构建的突变体K228R/M230L达到了迄今为止报道的最高L-抗坏血酸-2-葡萄糖苷浓度(211 g/L、624 mmol/L)。因此,可以利用迭代饱和诱变技术在突变体R81T基础上构建多位点突变体进行研究,旨在得到产物特异性高并符合工业生产的优势酶[29]。
——以高中化学“氢键”的教学为例

