α-(1,2-亚乙基)酰胺与端炔[4+1]合成螺环吡咯啉-2-酮
任传清, 季晓晖, 季建伟, 张 强, 宋 娟
(陕西理工大学 化学与环境科学学院 催化基础与应用重点实验室,陕西 汉中 723000)
在有机化合物中,螺杂环化合物是一类含有氮、硫、氧等电负强的杂原子组成的两个相互垂直的环平面的具有特殊刚性骨架化学结构的杂环类化合物,其中两个相互垂直的环平面还具有共扼、超共轭等相互作用,在一定条件下,通过分子内手性轴构成具有稳定手性结构的螺杂环化合物[1-2],其中螺杂环化合物中电负强的杂原子的存在,也使得它具有较强的分子间作用力,是许多医药、材料分子的核心骨架结构,因而在医药、抗菌剂、抗病毒试剂、农药、防火材料、涂料、电致发光材料、光致变色材料等方面有广泛的应用[3-7]。使其成为人们在新药研发以及材料合成等方面有着重要的研究前景的领域。近年来,关于螺杂环化合物的研究发展较快,有大量关于此类化合物的合成方法的文献报道[8-15]。鉴于螺杂环化合物良好的应用前景,因此开发一种高效、简便的方法来合成螺杂环化合物仍然具有重要现实意义。
本文在前期研究基础[16-19]以及参照文献中关于螺杂环化合物的合成方法之上,在碱性条件下,以α-(1,2-亚乙基)酰胺与端炔类化合物为底物,通过[4+1]环化合成了一系列多取代的螺环吡咯啉-2-酮类化合物,其结构经1H NMR,13C NMR 和 HR-MS(ESI) 表征,并对该反应机理进行了探讨。
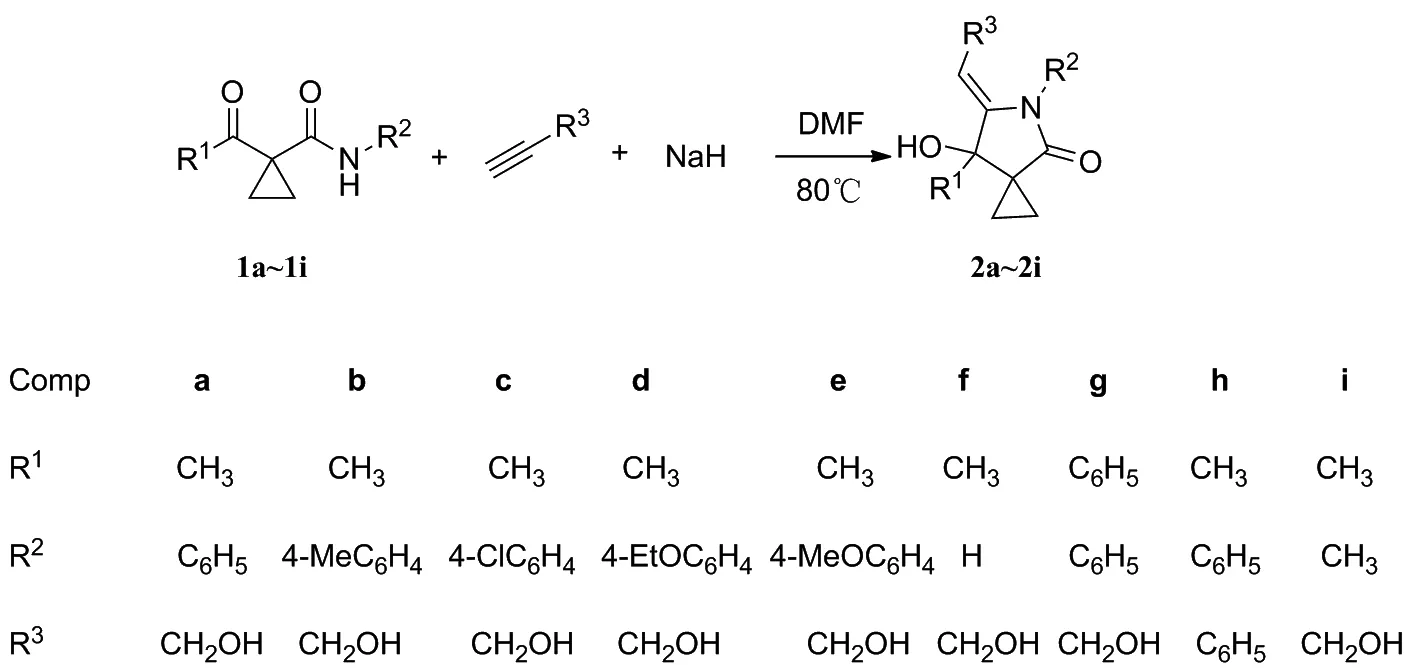
Scheme 1
1 实验部分
1.1 仪器与试剂
X-4型显微熔点仪(温度未经校正);ASCEND-BRUKER-600 MHz型核磁共振仪(溶剂CDCl3,内标TMS);Agilient 1100 LCMsD型高分辨质谱仪。
所用试剂均为分析纯。
1.2 合成
以2a的合成为例:
向干燥的25 mL的圆底烧瓶中依次加入化合物1a(1 mmol, 1 eq.),DMF 10 mL,丙炔醇(1.2 mmol, 1.2 eq.)和氢化钠(3.0 mmol, 3 eq.), 80 ℃搅拌20 h(TCL检测)。将反应液慢慢倒入盛有盐水的250 mL烧杯中,搅拌,二氯甲烷(3×10 mL)萃取,合并有机相,经无水硫酸镁干燥,减压蒸馏除去溶剂,残余物经硅胶柱层析(洗脱剂: A=乙酸乙酯/石油醚=1/15,V/V)纯化得白色固体2a0.91 mmol,产率91%, m.p.156.7~157.6 ℃;1H NMR(CDCl3, 600 MHz)δ: 1.01~1.05(m, 1H), 1.12~1.16(m, 1H), 1.17~1.23(m, 1H), 1.31~1.36(m, 1H), 1.42(s, 3H), 1.64(s, 1H), 2.12(s, 1H), 3.51(t,J=7.20 Hz, 1H), 3.58(t,J=7.20 Hz,1H), 5.08~5.11(m, 1H), 7.28(d,J=10.8 Hz, 2H), 7.34~7.37(m, 1H), 7.44(t,J=9.00 Hz, 2H);13C NMR(CDCl3, 151 MHz)δ: 10.6, 11.8, 14.7, 26.4, 32.8, 57.3, 102.3, 115.1, 127.9, 129.3, 148.5, 158.5, 175.4; HR-MS(ESI)m/z: Calcd for C15H18NO3{[M+H]+} 260.1281, found 260.1276。
用类似的方法合成2b~2i
2b: 白色固体,收率86%, m.p.143.1~145.3 ℃;1H NMR(CDCl3, 600 MHz)δ: 1.62~1.64(m, 2H), 1.76~1.78(m~2H), 1.93(s, 3H), 2.28(s, 3H), 1.70(s, 1H), 2.41(s, 1H), 3.61(t,J=8.40 Hz, 2H), 4.97(t,J=8.40 Hz, 1H), 6.90(d,J=10.8 Hz, 2H), 7.01(d,J=10.8 Hz, 2H);13C NMR(CDCl3, 151 MHz)δ: 14.7, 23.1, 26.1, 30.2, 30.7, 57.6, 58.8, 102.5, 115.6, 127.2, 128.0, 147.1, 158.3, 179.6; HR-MS(ESI)m/z: Calcd for C16H20NO3{[M+H]+} 274.1438, found 274.1435。
2c: 白色固体,收率83%, m.p.103.1~104.6 ℃;1H NMR(CDCl3, 600 MHz)δ: 1.69(t,J=10.8 Hz, 2H), 1.76(t,J=10.8 Hz, 2H), 1.98(s, 3H), 2.17(s, 1H), 3.01(s, 1H), 3.53~3.62(m, 2H), 4.99(t,J=7.20 Hz, 1H), 7.14(t,J=10.2 Hz, 2H), 7.36(t,J=10.8 Hz, 2H);13C NMR(CDCl3, 151 MHz)δ: 22.6, 25.8, 30.3, 30.5, 57.9, 59.0, 103.1, 127.0, 129.3, 132.8, 135.6, 146.2, 179.2; HR-MS(ESI)m/z: Calcd for C15H16NO3ClNa{[M+Na]+} 316.0711, found 316.0716。
2d: 白色固体,收率91%, m.p.132.3~134.6 ℃;1H NMR(CDCl3, 600 MHz)δ: 0.99~1.04(m, 1H), 1.01~1.14(m, 1H), 1.17~1.22(m, 1H), 1.29~1.33(m, 1H), 1.39(s, 3H), 1.42(t,J=8.40 Hz, 3H), 1.60(s, 1H), 2.45(s, 1H), 3.47~3.52(m, 1H), 3.53~3.61(m, 1H), 4.02~4.06(m, 2H), 5.02~5.05(m, 1H), 6.92(d,J=9.00 Hz, 2H), 7.16(d,J=10.2 Hz, 2H);13C NMR(CDCl3, 151 MHz)δ: 10.6,11.8, 14.7, 26.4, 32.8, 57.2, 63.7, 72.9, 102.3, 115.1, 127.9, 129.3, 148.5, 158.5, 175.4; HR-MS(ESI)m/z: Calcd for C17H21NO4Na{[M+Na]+} 326.1363, found 326.1358。
2e: 白色固体,收率83%, m.p.123.3~125.6 ℃;1H NMR(CDCl3, 600 MHz)δ: 1.66(t,J=8.40 Hz, 2H), 1.75(t,J=8.40 Hz, 2H), 1.96(s, 3H), 1.91(s, 1H), 2.35(s, 1H), 3.82(s, 3H), 3.60~3.65(m, 2H), 4.98(t,J=7.80 Hz, 1H ), 6.92(d,J=10.8 Hz, 2H), 7.12~7.14(m, 2H);13C NMR(CDCl3, 151 MHz)δ:23.1, 26.1, 30.3, 30.7, 55.5, 57.6, 58.8, 102.1, 114.5, 127.3, 129.8, 147.5, 158.8, 179.3; HR-MS(ESI)m/z: Calcd for C16H19NO4Na{[M+Na]+} 312.1206, found 312.1201。
2f: 白色固体,收率65%, m.p.98.3~101.3 ℃;1H NMR(CDCl3, 600 MHz)δ:0.76~0.99(m, 1H), 1.02~1.13(m, 1H), 1.15~1.20(m, 1H), 1.26~1.31(m, 1H), 1.35(s, 3H), 1.27(s, 1H), 2.13(s, 1H), 4.20~4.35(m, 2H), 5.16~5.19(m, 1H), 6.99(s, 1H);13C NMR(CDCl3, 151 MHz)δ: 13.4, 19.1, 26.2, 39.5, 56.2, 63.8 102.6, 140.4, 179.4; HR-MS(ESI)m/z: Calcd for C9H14NO3{[M+H]+} 184.0968, found 184.0961。
2g: 白色固体,收率90%, m.p.168.3~172.1 ℃;1H NMR(CDCl3, 600 MHz)δ: 1.27~1.31(m, 2H), 1.33~1.39(m, 2H), 1.62(s, 1H), 2.42(s, 1H), 3.51~3.55(m, 2H), 4.86(t,J=8.40 Hz, 1H), 7.15(d,J=9.60 Hz, 2H), 7.25(d,J=9.60 Hz, 2H), 7.28(d,J=13.2 Hz, 1H), 7.36(t,J=9.60 Hz, 3H), 7.48(d,J=8.40 Hz, 2H);13C NMR(CDCl3, 151 MHz)δ: 10.6, 11.8, 14.7, 26.4, 32.8, 57.2, 63.7, 72.9, 102.3, 115.1, 127.9, 129.3, 148.5, 158.5, 175.4; HR-MS(ESI)m/z: Calcd for C20H20NO3{[M+H]+} 322.1438, found 322.1441。
2h: 白色固体,收率 72%, m.p.132.3~130.1 ℃;1H NMR(CDCl3, 600 MHz)δ: 1.13~1.15(m, 2H), 1.66~1.68(m, 2H), 1.72(s, 1H), 2.13(s, 1H), 5.81(s, 1H), 7.16 (q,J=9.6 Hz, 2H), 7.20 (q,J=4.0 Hz, 1H), 7.30(d,J=8.40 Hz, 4H), 7.37(q,J=9.60 Hz, 2H), 7.41 (q,J=8.40 Hz, 1H), 7.50~7.51 (m, 2H);13C NMR(CDCl3, 151 MHz)δ: 11.6, 12.8, 16.7, 21.2, 27.2, 104.9, 106.6, 126.9, 128.4, 128.5, 129.1, 135.2, 136.1, 140.1, 140.7, 174.5; HR-MS(ESI)m/z: Calcd for C20H20NO2{[M+H]+} 306.1489, found 306.1493。
2i: 白色固体,收率 67%, m.p.148.3~149.2 ℃;1H NMR(CDCl3, 600 MHz)δ: 1.54~1.57(m, 2H), 1.64~1.73(m, 2H), 1.82(s, 3H), 2.16(s, 1H), 2.41(s, 1H), 2.80 (d,J=6.0, 3H), 3.47~3.61(m, 2H), 5.96(s, 1H);13C NMR(CDCl3, 151 MHz)δ: 11.1, 12.3, 16.8, 21.6, 27.5, 56.8, 65.7, 110.1, 142.7, 178.5; HR-MS(ESI)m/z: Calcd for C10H16NO3{[M+H]+} 198.1125, found 198.1129。
2 结果与讨论
2.1 反应条件优化
以1a和丙炔醇的反应(Scheme 2)为例,从反应所使用碱的种类、用量、溶剂、反应温度以及时间所组成的不同反应体系,来探索最佳反应条件,结果见表1。
实验表明:在各种碱中,80 ℃条件下,DMF为溶剂,当分别使用NaOH、t-BuOK以及NaH的量为3.0 mmol 时,目标产物2a的产率分别为61%、 70%以及91% (Table 1, Entry 1~3)。当NaH的量增加到4.0 mmol时,目标产物2a的产率为89% (Table 1, Entry 4)。在同样的条件下,当用DBU以及K2CO3为碱时,目标产物2a的产率均为0% (Table 1, Entry 5~6)。当分别使用CH3CH2OH以及CH3CN为溶剂,目标产物2a的产率分别为36%和56%(Table 1, Entry 7~8)。在确定80 ℃条件下,NaH的量为3.0 mmol, DMF为溶剂的基础上,通过提高反应温度以及延长反应时间,目标产物2a的产率分别为78%和46% (Table 1, Entry 9~10)。通过以上实验探索确定,底物1a在80 ℃的DMF溶剂中,以3.0 mmol的NaH为碱,反应20 h,以最高反应产率91%得到目标化合物2a。
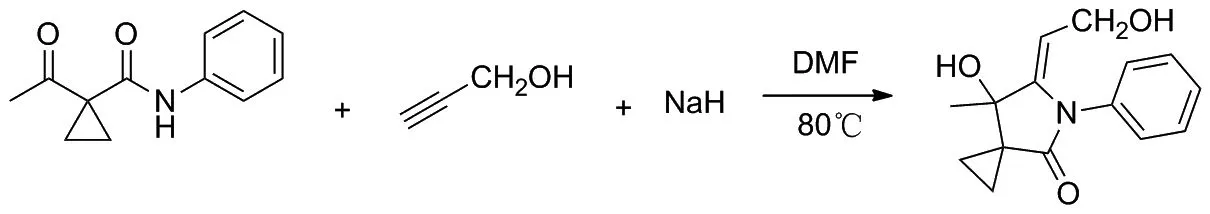
Scheme 2
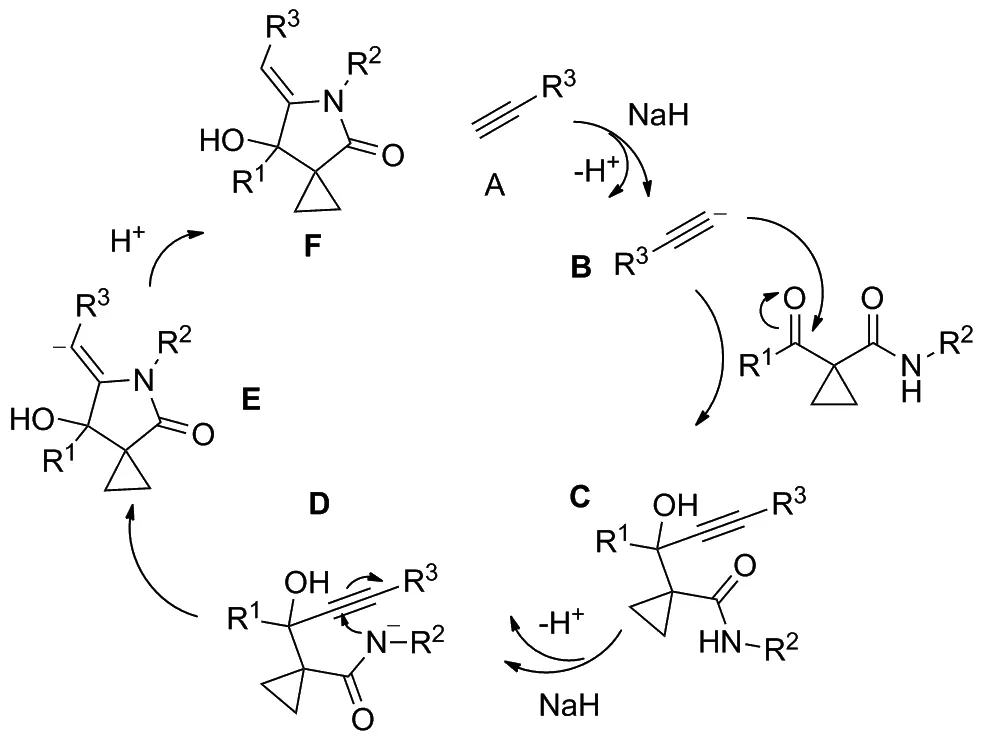
Scheme 3
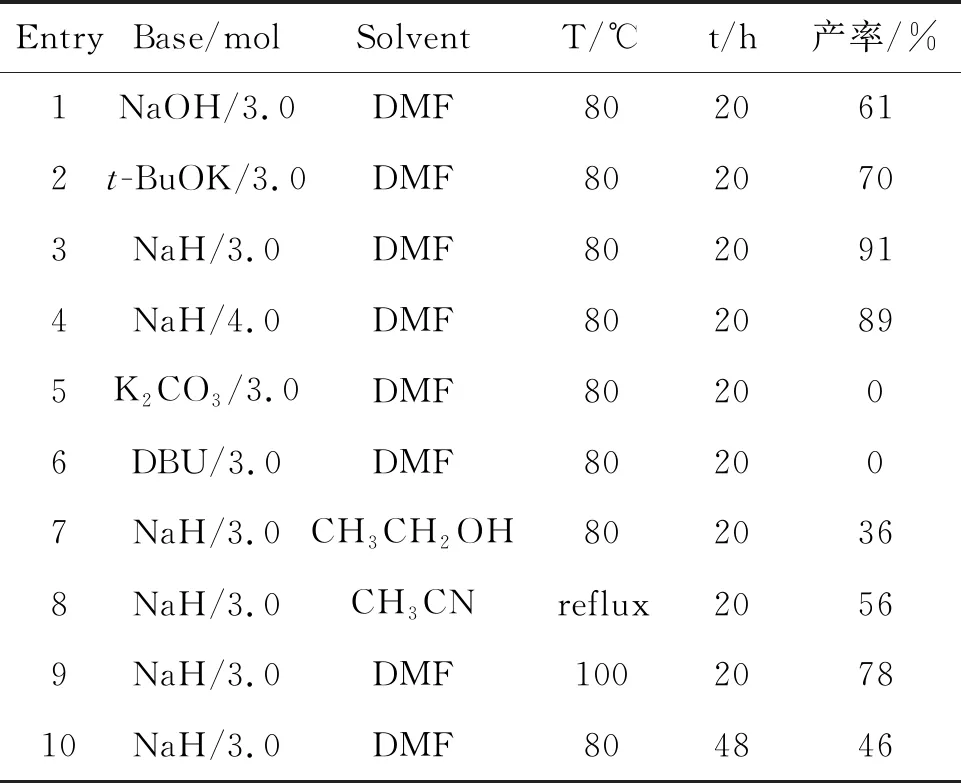
表1 反应条件的优化
2.2 反应机理
通过上面的实验探索以及对相关文献报道反应的研究,推断可能的反应机理如下。首先,在氢化钠作用下,端炔类化合物A失去一个氢质子,生成一个具有亲核基团的中间体B,然后与乙酰乙酰环丙烷类化合物发生发生分子间亲核加成生成中间产物C,中间产物C在氢化钠作用下,生成具有亲核性的中间体D,D发生分子内的亲核环化反应,生成中间体E,E结合一个H+,生成目标化合物F。
在80 ℃,氢化钠剂为碱,DMF溶剂中成功实现了由α-(1,2-亚乙基)乙酰乙酰胺类化合物和端炔类化合物,通过底物之间分子间以及分子内的亲核环合反应,合成了一系列重要的多取代螺环吡咯啉-2-酮类化合物。该合成路线具有所用底物廉价易得、反应条件温和,实验过程操作简单等特点,为螺环吡咯啉-2-酮类化合物合成探索了一条高效的新途径。

