HNF-4α基因多态性与非酒精性脂肪性肝病的关系
黄海燕,李毅,吕其军,周芳,王济红,杨长春,徐娟△
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)属一种临床病理综合征,主要病理特征是肝实质细胞发生脂肪变性,甚至坏死、脂肪贮积及炎性细胞浸润等[1-2]。NAFLD作为代谢综合征在肝脏的表现,单纯性脂肪肝、脂肪性肝炎及与其有关的肝硬化或肝癌等均属该病的疾病谱[3-4]。NAFLD可引起多种并发症,如动脉粥样硬化、2型糖尿病等[5]。其发病与环境、遗传等多种因素有关。肝细胞核因子4α(hepatocyte nuclear factor 4,HNF-4α)可调节肝脏多个脂代谢的通路[6],在NAFLD中的作用逐渐成为研究热点,但目前关于HNF-4α基因多态性与NAFLD的关系鲜有报道。本文以NAFLD患者为研究对象,分析HNF-4α基因多态性与NAFLD的关系,以期为探究NAFLD发病的遗传学因素提供参考。
1 对象与方法
1.1 研究对象 选择2018年10月—2019年4月胜利油田中心医院收治的NAFLD患者为研究对象。纳入标准:符合《NAFLD诊疗指南(2010版)》相关临床诊断标准[7];年龄18~75岁;无大量或长期饮酒史(饮酒换算乙醇量:女性<70 g/周、男性<140 g/周),均为非酒精性单纯性脂肪肝;精神状态尚可、意识清晰,可配合研究。排除标准:合并恶性肿瘤;合并心、肺、肾等其他重要器官的功能损伤;伴有病毒性肝炎、自身免疫性肝病、药物性肝病、肝豆状核变性等;伴发感染性疾病、传染性疾病、免疫性疾病、内分泌疾病等;处于妊娠期或哺乳期;近3个月服用可影响内分泌的药物。根据上述标准,共纳入100例NAFLD患者作为观察组。选择同时期来本院查体的100例健康人作为对照组。本研究已通过医院医学伦理委员会的审查,研究对象均签署知情同意书。
1.2 资料收集 收集研究对象的一般临床资料,包括年龄、性别、身高、体质量、体质量指数(BMI)、收缩压(SBP)、舒张压(DBP)、腰围、臀围、腰臀比(WHR),以及肝功能[丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、γ-谷氨酰转肽酶(γ-GT)]、血脂[三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)]、血糖(GLU)、胰岛素抵抗指数(HOMA-IR)、尿酸(UA)等生化指标,检测非酒精性单纯性脂肪肝严重程度和HNF-4α的基因多态性。
1.3 检测方法与分组(1)非酒精性单纯性脂肪肝严重程度。行腹部CT,观察病变程度,肝/脾CT比值≤0.5为重度病变,0.5<肝/脾CT比值≤0.7为中度病变,0.7<肝/脾CT比值<1.0为轻度病变。据此,将观察组分为轻度组(28例)、中度组(36例)和重度组(36例)。(2)HNF-4αrs4812829位点基因多态性。使用含乙二胺四乙酸(EDTA)的采血管采集研究对象的外周静脉血5 mL,十六烷基三甲基溴化铵(CTAB)法提取外周血内单个核细胞基因组DNA。HNF-4α基因上游引物为5'-GAGGATCCCCGGGTACCGGTCGCCACCATGC⁃GACTCTCCAAAACCCCT-3',下游引 物为5'-TCCTTG⁃TAGTCCATACCGATAACTTCCTGCTTGGTGATG-3',PCR的扩增体系包含2 U热启动混合Taq酶、200 ng DNA模板、正反向引物各5µL(10 mmol/L)、5µL dNTPs(200µmol/L)、5µL Tris-HCl(100 mmol/L)、5µL KCl(500 mmol/L)、5µL MgCl2(215 mmol/L),并加去离子水至体积为50µL。在热循环仪上展开聚合酶链式反应(PCR)扩增,条件及过程为:94℃预变性5 min;94℃变性1 min,60℃退火1 min,72℃延伸45 s,循环35次;最后72℃延伸10 min。PCR产物纯化后,37℃条件下采用限制性内切酶消化12 h,将16.5µL酶切产物放入含4%琼脂糖凝胶内,进行电泳分离并明确基因型。
1.4 统计学方法 采用SPSS 22.0对数据进行统计分析。计量资料采用均数±标准差(±s)表示,2组间比较采用t检验,多组间比较采用方差分析,多重比较采用SNK-q检验;计数资料采用例(%)表示,组间比较采用χ2检验;基因型数据进行Hardy-Weinberg遗传平衡检验,NAFLD发病风险采用多因素Logistic回归分析,以P<0.05为差异有统计学意义。
2 结果
2.1 对照组与观察组基线资料比较 2组性别、年龄差异无统计学意义,观察组SBP、DBP、BMI、WHR均明显高于对照组(P<0.05),见表1。
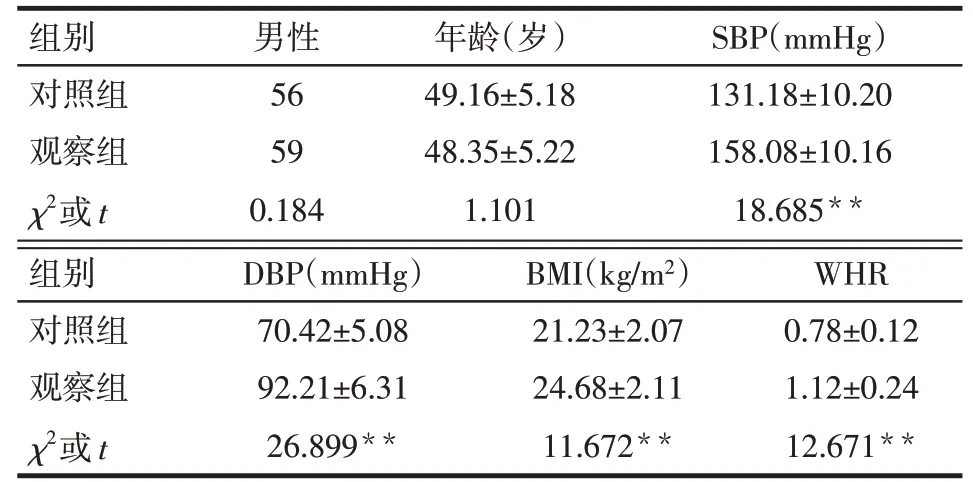
Tab.1 Comparison of general data between control group and observation group表1 对照组与观察组基线资料比较(n=100)
2.2 对照组与观察组各亚组肝功能、血脂、血糖、UA水平比较 对照组、轻度组、中度组、重度组的ALT、AST、γ-GT、TC、TG、LDL-C、GLU、HOMA-IR及UA水平大体呈现依次升高趋势(P<0.05),而HDL-C水平呈下降趋势,见表2。
Tab.2 Comparison of liver function,blood lipid,blood glucose and UA levels between control group and different subgroups of the observation group表2 对照组与观察组各亚组肝功能、血脂、血糖、UA水平比较 (±s)

Tab.2 Comparison of liver function,blood lipid,blood glucose and UA levels between control group and different subgroups of the observation group表2 对照组与观察组各亚组肝功能、血脂、血糖、UA水平比较 (±s)
**P<0.01;a与对照组比较,b与轻度组比较,c与中度组比较,P<0.05
?
2.3 对照组与观察组HNF-4αrs4812829等位基因及基因型分布比较 HNF-4α基因rs4812829位点多态性在对照组与观察组中的基因型分布均符合Hardy-Weinberg平衡规律(P>0.05),2组均有较好群体代表性,且2组HNF-4αrs4812829等位基因及基因型分布差异均无统计学意义(P>0.05),见表3。
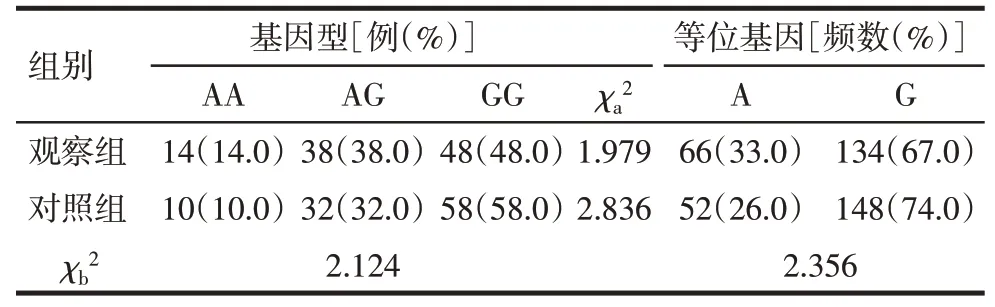
Tab.3 Comparison of allele and genotype distribution of HNF-4αrs4812829 between control group and observation group表3 对照组与观察组HNF-4αrs4812829等位基因及基因型分布比较 (n=100)
2.4 观察组不同亚组HNF-4αrs4812829等位基因及基因型分布比较 观察组不同亚组HNF-4α rs4812829等位基因及基因型分布差异均无统计学意义(P>0.05),见表4。
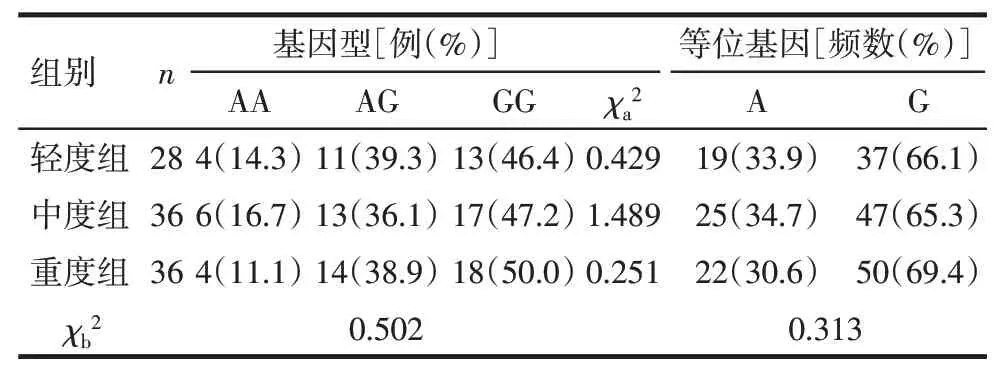
Tab.4 Comparison of allele and genotype distribution of HNF-4αrs4812829 in different subgroups of the observation group表4 观察组中不同亚组HNF-4αrs4812829等位基因及基因型分布比较
2.5 观察组HNF-4αrs4812829位点不同等位基因携带者之间肝功能、血脂、血糖、UA水平比较 观察组AA、AG、GG型基因携带者之间ALT、AST、γ-GT、TC、TG、HDL-C、LDL-C、GLU、HOMA-IR及UA水平差异均无统计学意义(P>0.05),见表5。
Tab.5 Comparison of liver function,blood lipid,blood glucose and uric acid levels of HNF-4αrs4812829 locus carriers in the observation group表5 观察组HNF-4αrs4812829位点不同等位基因携带者肝功能、血脂、血糖、UA水平比较 (±s)

Tab.5 Comparison of liver function,blood lipid,blood glucose and uric acid levels of HNF-4αrs4812829 locus carriers in the observation group表5 观察组HNF-4αrs4812829位点不同等位基因携带者肝功能、血脂、血糖、UA水平比较 (±s)
均P>0.05
?
2.6 HNF-4αrs4812829基因位点与NAFLD发病风险的关系 以是否发生NAFLD(是=1,否=0)为因变量,以性别、年龄、rs4812829基因型(GG=0,AG=1,AA=2)等为自变量,对2组性别、年龄等因素校正后进行Logistic回归分析。结果显示,与基因型为GG个体相比,基因型为AG、AA的个体发生NAFLD的风险均未增加,见表6。

Tab.6 Correlation analysis of HNF-4αrs4812829 gene locus and the risk of NAFLD表6 HNF-4αrs4812829基因位点与NAFLD发病风险的关联
3 讨论
3.1 NAFLD的临床特征 NAFLD已成为我国第二大肝病,其发病率仅次于慢性病毒性肝炎[8]。据统计,西方国家NAFLD发病率约30%,其发生与代谢功能障碍机制存在密切联系[9-10]。有研究发现,随着高脂血症、2型糖尿病等代谢性疾病增多,该病发病率明显升高[11];且NAFLD易引发肝硬化、不良心血管事件等,具有较高的死亡率[12-13]。本研究发现,观察组SBP、DBP、BMI、WHR均明显高于正常对照组,且肝功能、血脂、血糖、UA等指标均明显异于对照组,病情越重,上述代谢指标越差。由此可见,NAFLD患者存在多种代谢紊乱,肝功能下降、血脂及血糖代谢异常。
3.2 HNF-4α在NAFLD发病中的作用 NAFLD发病机制未有明确定论,可能与环境因素、遗传因素等相互作用相关[14]。近年来NAFLD发病的遗传学研究较多,多种核受体、转录调控因子等参与其发病过程[15-16]。其中,HNF-4α作为锌指蛋白的一种,属于核受体超级家族的孤儿核受体,HNF-4α编码基因位于20号染色体的长臂,以同源二聚体形式结合DNA,且其主要在肝脏表达,而在肾脏、胰腺等组织少量表达。HNF-4α参与葡萄糖、脂肪酸、胆固醇等物质代谢过程,参与肝脏的糖异生激活、调节胰岛细胞分泌、调节脂蛋白等相关基因表达[17]。HNF-4α基因rs4812829(G>A)位点是糖尿病的易感性位点,与迟发性糖尿病或2型糖尿病的发生相关,在调节体内脂质稳态、胆汁酸合成等过程中,HNF-4α亦发挥重要作用。本研究发现,观察组HNF-4α rs4812829位点基因型AA、AG、GG的分布及等位基因A、G的占比均与对照组无明显差异,且HNF-4α rs4812829位点各基因型及等位基因的分布在观察组各亚组之间亦无明显差异,对比观察组HNF-4α rs4812829位点不同基因型携带者之间肝功能、血脂、血糖、UA水平亦均无明显差异,可见HNF-4α rs4812829位点与NAFLD的发生无明显关系。Logistic回归进一步分析发现,与基因型为GG个体相比,基因型为AG、AA的个体发生NAFLD的风险均未增加,推测HNF-4αrs4812829位点的基因多态性尚未增加NAFLD的患病风险。
综上所述,HNF-4α基因rs4812829位点多态性及等位基因的分布与NAFLD发生无明显相关。但本研究仅对NAFLD患者进行血生化指标、CT影像学等检查,且整体样本量偏小,故而有待扩大样本深入研究HNF-4α基因多态性与NAFLD的关系,为预防NAFLD发生提供科学依据。

