DTI、骨膜蛋白及溶血磷脂酸联合检测对心肌梗死后心室重构的预测价值
刘文洪 罗光华 赵衡
心肌梗死(myocardial infarction,MI)治疗后左心室重构(left ventricle remodel,LVR)是一个复杂的过程,LVR 的肌纤维结构及容积可发生改变,诱发心血管事件,进而导致病人心功能障碍。因此,及早预测治疗后心室重构对于MI 病人的预后评估至关重要[1-2]。扩散张量成像(diffusion tensor imaging,DTI)是一种追踪肌纤维、反映纤维解剖连通性的功能MRI 技术,近年已越来越多地用于心脏成像[3-5]。骨膜蛋白(Periostin)属于基质细胞蛋白,在MI 及多种肿瘤中均存在高表达。研究[6]表明Periostin 在MI区高表达,且与梗死区的瘢痕修复有关。溶血磷脂酸(lysophosphatidic acid,LPA)是磷脂被磷脂酶水解后形成的化合物,它可以诱导形成多种疾病,如MI、动脉粥样硬化、肿瘤等[7]。研究[8]发现 MI 模型大鼠的心肌组织中存在LPA 高表达。目前尚无统一的预测MI 后心室重构的指标,单独使用上述指标敏感度、特异度低,稳定性差。基于此,本研究首次观察了 DTI 参数、Periostin 及 LPA 在 MI 后左心室重构中的预测价值,旨在为MI 后LVR 的预测提供新指标。
1 资料与方法
1.1 一般资料 回顾性纳入2017 年2 月—2018年11 月于南华大学附属第一医院住院治疗的100例 MI 病人,男 65 例,女 35 例,年龄 43~78 岁,平均(56.8±10.7)岁。体质量指数(BMI)22~30 kg/m2,平均(25.1±4.1)kg/m2。入院心电图显示ST 段抬高型MI 43 例,非 ST 段抬高型 MI 57 例;其中前壁 41 例,侧壁 12 例,下壁 35 例,后壁 12 例;单支 39 例,2 支40 例,3 支及以上 21 例。血流分级:0~1 级 46 例,2 级33 例,3 级 21 例。纳入标准:①年龄 18~80 岁;②从出现MI 临床症状到就诊时间在24 h 内;③MI 符合2012 年美国心脏病协会(AHA)、美国心脏病学会(ACC)、欧洲心脏病学会(ESC)及世界心脏联盟(WHF)制定的诊断标准[9];④入院前24 h 内未服用β 受体阻滞剂、他汀类、血管紧张素转化酶抑制剂(angiotension converting enzyme inhibitors, ACEI)等药物;⑤入院当天接受MRI 和超声心动图检查,急诊行 MI 溶栓治疗(thrombolysis in myocardial infarction,TIMI);⑥每 2 个月门诊随访 1 次,且于12 个月随访时行超声心动图检查;⑦临床及影像学资料完整,包括MI 所致的心力衰竭的Kiliip 分级、治疗方式[溶栓、冠状动脉介入(percutaneous coronary intervention,PCI)]、血脂检验[血清总胆固醇( total cholesterol, TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)]等。排除标准:①既往有 MI 或急、慢性心力衰竭病史;②合并扩张性心肌病、心脏瓣膜病等其他心脏疾病;③合并全身感染性疾病或免疫功能低下疾病;④合并恶性肿瘤。
1.2 超声心动图检查 采用飞利浦IU22 型号彩色多普勒超声诊断仪,高频探头,探头频率2.5~3.5 MHz。病人于呼气末屏气,采用双平面法测量左心室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)、左心室舒张末期容积(left ventricular enddiastolic volume,LVEDV)和左心室射血分数(left ventricular ejection fraction,LVEF),测量舒张末期室间隔厚度(intel-ventricular septum end-diastolic thickness,IVSTD)、舒张末期左室后壁厚度(posterior wall depth,PWTD),计算得到左心室质量(left ventricular mass,LVM):LVM=0.8×1.04×([LVEDD+PWTD+IVSTD)3-(LVEDD)3]+0.6[6]。再以 LVM/体表面积计算得到左室质量指数(left ventricular mass index,LVMI),LVMI≥116 g /m2(男)或≥96 g /m2(女)定义为LVR。由1 名超声科副主任医师分别测量每例病人的上述参数,每个参数测量3 次并取平均值作为测量结果。
1.3 MRI 扫描 采用 GE Discovery MR 750 3.0 T 超导MR 设备,6 通道心脏专用相控线圈,扫描范围自心尖至心底。DTI 扫描采用屏气平衡快速梯度回波序列(b-FFE/BH)结合敏感性编码(SENSE)技术,于呼气末屏气R 波触发扫描,重复时间(TR)3.9 s,回波时间(TE)1.9 s,FOV 320 mm×320 mm,矩阵200×256,体素大小 1.4 mm×1.0 mm×5.0 mm,翻转角 45°,激励次数5,加速因子1.9,层厚8 mm,层间距0.5 mm,重建矩阵200×256。使用GE AW 4.4 工作站处理数据。利用MACD 数据库软件划分DTI 上的梗死区(core-infarction zone,CIZ)、边缘区(peri-infarction zone,PIZ)及非梗死区(non-infarction zone,NIZ)。选取病灶最大层面,于上述区域在病灶内勾画兴趣区(ROI),ROI 放置通常略小于病灶范围,尽量避开出血等区域,测量各个ROI 上的各向异性分数(FA)和平均扩散系数(MD)。由1 名放射科副主任医师分别对同一图像选取 3 次 ROI,测量FA、MD 值,上述参数取平均值。
1.5 血浆Periostin、LPA 水平检测 所有病人均在治疗前抽取外周静脉血10 mL 置于抗凝管中,2500 r/min 离心 10 min 后取上层血清,-70 ℃保存待检。采用酶联免疫吸附测定(Enzyme linked immunosorbent assay,ELISA)法检测 Periostin、LPA,试剂盒购自美国Sigma 公司,严格按照说明书步骤进行。
1.6 统计学方法 采用SPSS 20.0 软件对数据进行统计学处理。符合正态分布且齐性检验的计量资料用均数±标准差()表示,2 组间比较采用 t 检验。计数资料用例(%)表示,2 组间比较采用χ2检验。采用多因素Logistic 回归分析影响MI 病人LVR 的危险因素。绘制受试者操作特征(ROC)曲线评估DTI、Periostin 及 LPA 对 MI 病人预后发生LVR 的诊断价值。P<0.05 为差异有统计学意义。
2 结果
2.1 2 组病人临床资料比较 病人根据LVMI 分为2 组,其中 LVR 组病人 46 例,非 LVR 组 54 例。相比非重构组,重构组病人更多见高血压病史(P<0.05),2 组间其他一般临床资料差异均无统计学意义(均 P>0.05),详见表 1。
2.2 2 组病人不同ROI 的FA 及MD 值的比较 LVR组 CIZ 区的 FA 值及 MD 值均高于非 LVR 组(P<0.05),而 2 组间 PIZ 区与 NIZ 区的 FA 值及 MD 值差异均无统计学意义(均 P>0.05),见表 2。
2.3 2 组病人血浆 Periostin、LPA 水平比较 LVR组 的 Periostin、LPA 均 高 于 非 LVR 组 [Periostin,(52.17±9.33)ng/L、(45.33±8.71)ng/L,t=7.211,P=0.026;LPA,(3.74±0.23)mmol/L、(3.45±0.14)mmol/L,t=3.620,P=0.043]。
2.4 左心室DTI 影像表现 左心室DTI 影像显示,正常人群左心室心肌纤维丰富、排列有序、连续,MI病人左心室心肌纤维稀少、排列疏松、走行中断,MI后LVR 病人心肌纤维减少、排列紊乱、走行中断。正常人群、MI 病人及MI 后LVR 病人左心室DTI 结果见图1-3。
2.4 LVR 多因素Logistic 回归分析 对有统计学意义的5 项危险因素进行Logistic 多因素分析。结果表明高血压、Periostin、LPA、FA 及 MD 是影响 MI 病人LVR 的独立危险因素(均P<0.05),见表3。
2.5 ROC 曲线分析 ROC 曲线分析结果表明,LPA、Periostin、CIZ 区 FA 及 CIZ 区 MD 诊断 LVR的AUC 分别是 0.801(95%CI:0.701~0.914,P<0.001)、0.864(95%CI:0.892~0.994,P<0.001)、0.611(95%CI:0.446~0.714,P=0.005)、0.664(95%CI:0.514~0.733,P=0.007);各指标联合预测 LVR 的 AUC 为 0.904,敏感度为 89.6%,特异度为 82.4%(图 4)。

表2 2 组病人不同ROI 的FA 及MD 值的比较
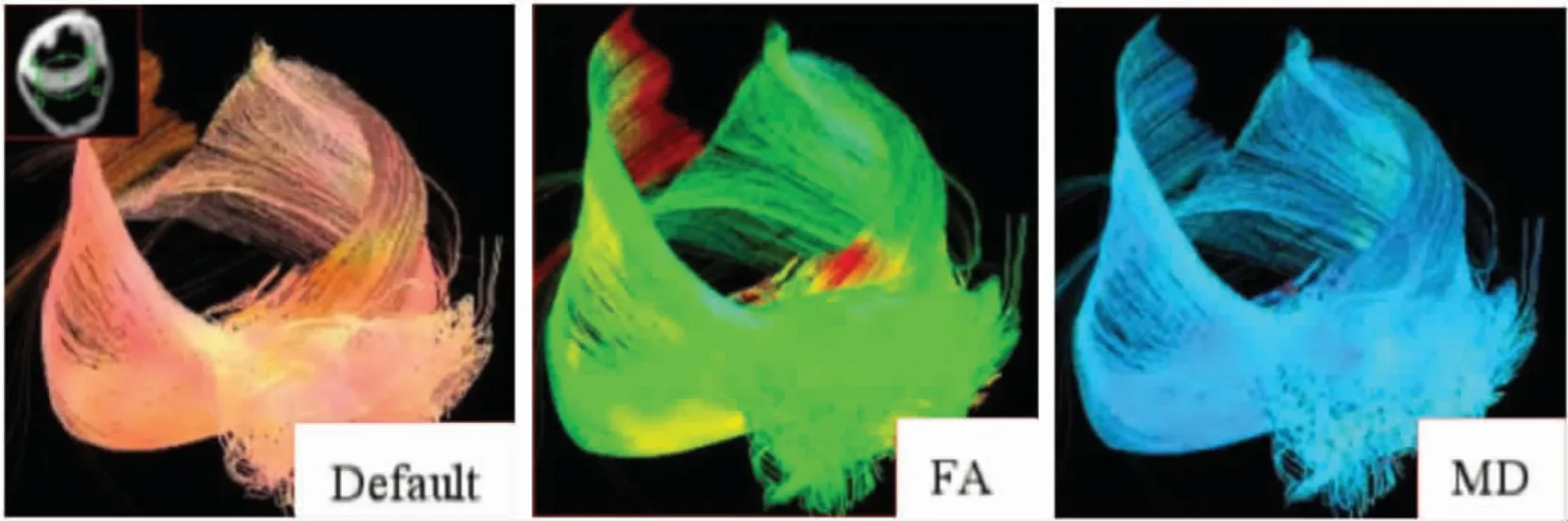
图1 正常人左心室DTI 影像,正常区心肌纤维束丰富,排列紧密有序,走行连续,心肌不同层次各向异性扩散显著。A 图为纤维束示踪默认图,B 图FA 伪彩图,C 图为MD 伪彩图。
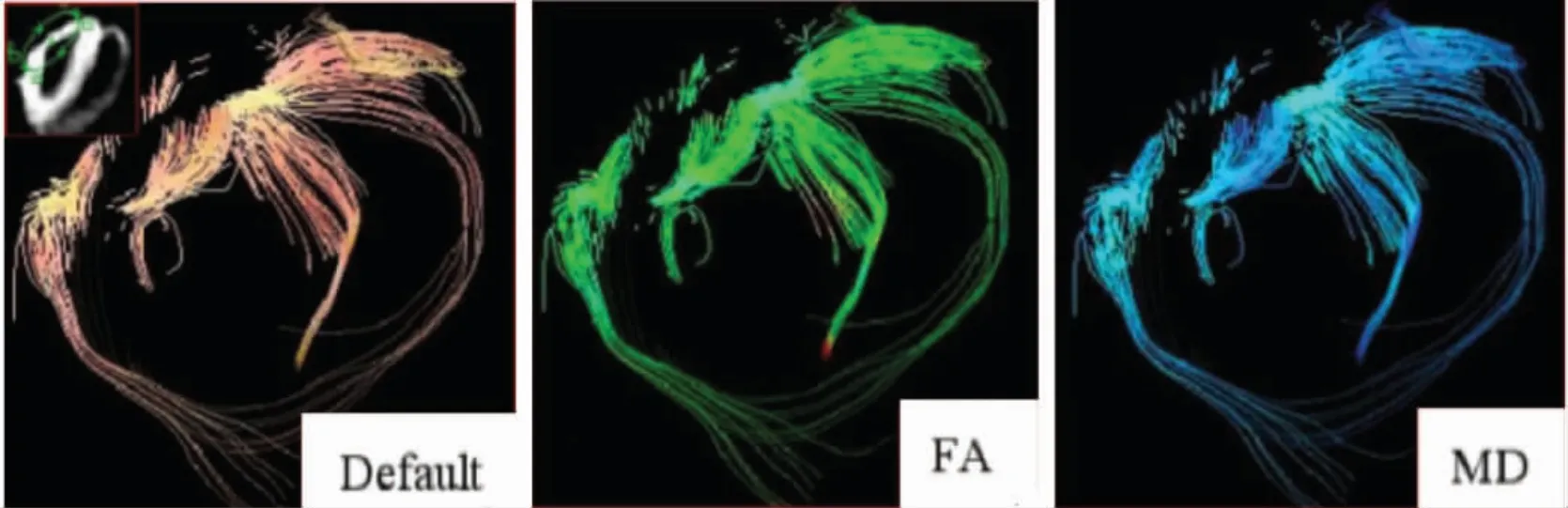
图2 MI 重构病人左心室DTI 影像,心肌纤维束稀少,排列疏松,走行中断,部分区无纤维束,心肌不同层次各向异性扩散明显减弱。A 图为纤维束示踪默认图,B 图FA 伪彩图,C 图为MD 伪彩图。

图3 MI 病人DTI 影像,显示心肌纤维束有所减少,排列紊乱,部分走行中断,部分区各向异性扩散减弱。A 图为纤维束示踪默认图,B 图FA 伪彩图,C 图为MD 伪彩图。
3 讨论
MI 病人的心肌出现缺血坏死后会导致心肌收缩能力丧失,心脏收缩功能出现不对称,心室壁扩张、变薄,形态结构出现变化,即发生LVR[10];进而导致室壁瘤、心力衰竭、心室破裂,甚至死亡。但是LVR 的过程缓慢、隐匿,很难早期诊断,因此早诊断、早治疗LVR 对提高病人的预后至关重要。
DTI 技术能够检测心肌组织中肌纤维的扩散情况,间接反映白质纤维的空间排列位置、完整性及走行方向,是目前研究心肌纤维形态结构的无创性方法。LVR 的心肌纤维表现为走行、排列、环绕方向、连续性等形态的改变,且CIZ、PIZ 和NIZ 肌纤维表现不同,因此检测不同区域的心肌纤维对预测LVR 至关重要[11]。FA 值和MD 值是评价组织内水分子运动的常用指标,FA 值代表组织完整性,MD 值则反映水分子的平均扩散情况。MI 会从CIZ 向PIZ扩展,最后波及NIZ,FA 值逐渐升高而MD 值逐渐降低[12]。本研究结果显示,2 组CIZ 区FA 值和MD值之间差异均有统计学意义,提示CIZ 区心肌组织的完整性遭到破坏。MI 的梗死区在重构早期心肌出现大片灶性凝固性坏死,心肌间质充血、水肿,炎症细胞浸润,随后微血管受损及钙化,成纤维细胞明显增生,后期坏死的心肌纤维逐渐溶解吸收,形成肌溶灶及肉芽组织。而非梗死区心肌后期表现为心肌细胞肥大、纤维排列紊乱、血管再生、间质胶原增生。本研究结果显示,重构组病人心肌纤维数量较非重构组病人明显减少,排列紊乱,提示DTI可反映重构心室的心肌纤维情况。

表3 影响LVR 的多因素Logistic 回归分析
LPA 由细胞内质网分泌,可靶向不同细胞表现出不同功能[13]。研究[14]发现,MI 病人血浆LPA 水平升高,提示LPA 在心室重构中可能发挥重要的作用。另外,有动物实验研究表明LPA 体外长时间刺激可诱导心肌细胞肥大,促进大鼠心肌成纤维细胞增殖[15]。此外,MI 病人血浆 LPA 含量升高,与心脏彩色多普勒超声上左室舒张末期内径呈正相关[16]。这些研究都提示LPA 可作为预测MI 后心室重构的标志物。
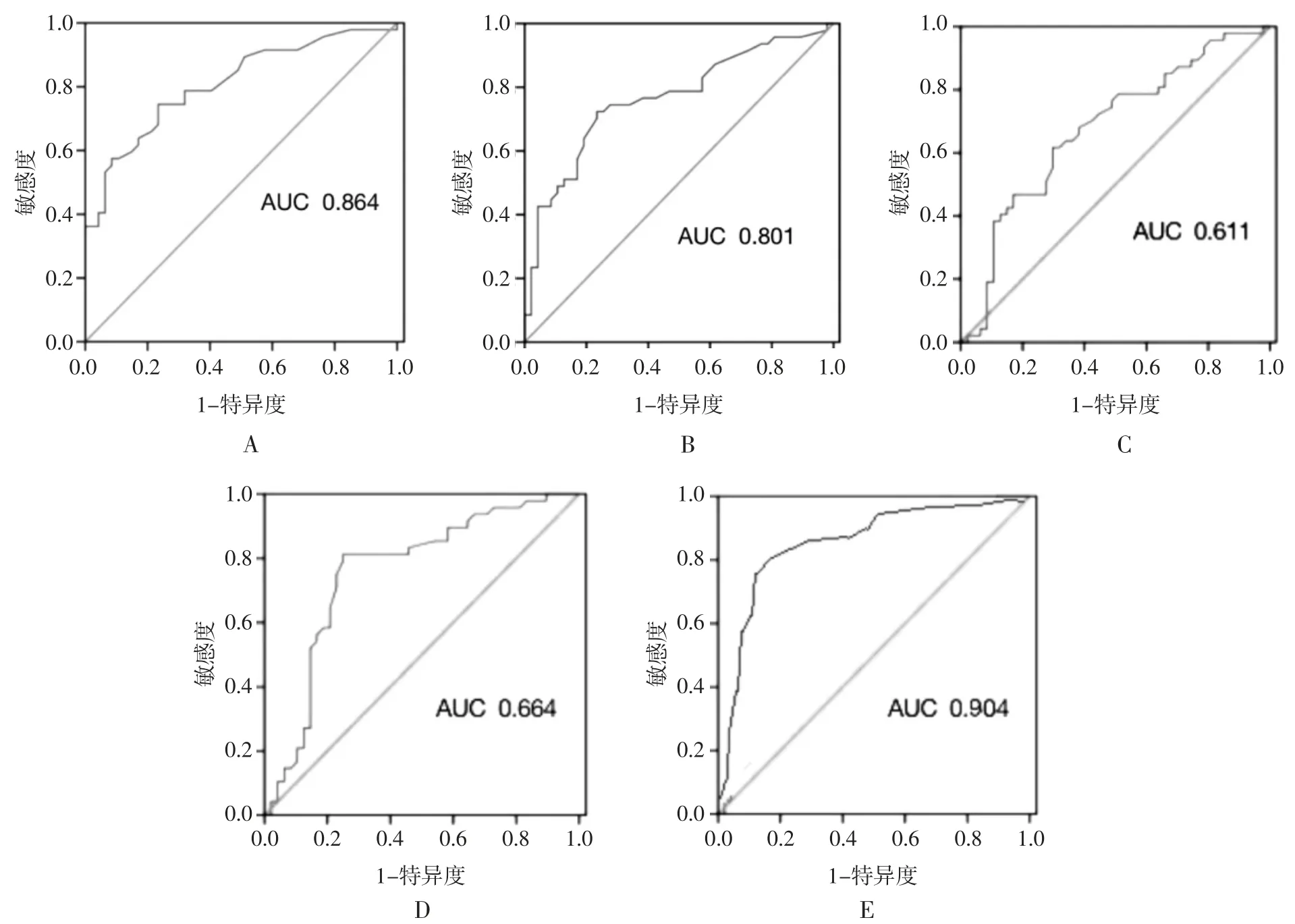
图 4 各指标预测 MI 病人 LVR 的 ROC 曲线。A 图为 Periostin,B 图为 LPA,C 图为 CIZ 区域 FA,D 图为 CIZ 区域MD,E 图为4 种指标联合检测。
Periostin 首先由Kruzynska 发现,在维持骨骼结构中发挥重要作用[17]。研究[18]表明,Periostin 敲除AMI 小鼠会出现心肌的延迟愈合,提示Periostin 对心肌纤维的恢复至关重要。另有研究[19]发现心力衰竭模型大鼠的的心肌细胞中Periostin 高表达,进一步研究结果提示Periostin 基因高表达大鼠可出现心功能衰竭,Periostin 基因得到抑制后心室功能的改善。临床研究[20]表明心力衰竭病人心肌Periostin mRNA 表达显著高于正常人群,Periostin 水平与心肌纤维化的程度、分布密切相关。由此推断Periostin蛋白可能是心力衰竭病人心脏重构的潜在标志物。
本研究结果表明,重构组MI 病人的血浆Periostin、LPA 含量高于非重构组病人,这与其他研究[6,16]结果基本一致,提示Periostin、LPA 参与了MI后的心室重构。研究[21]表明,高血压是左心室重构的危险因素。本研究中Logistic 回归分析显示,Periostin、LPA、FA 及 MD 是影响 MI 病人 LVR 的独立危险因素。ROC 曲线分析结果表明,Periostin、LPA、FA 及 MD 对 LVR 的 AUC 分别是 0.864、0.801、0.611、0.664,而 4 者联合的 AUC 为 0.904 最高,提示Periostin、LPA 及DTI 指标联合检测对MI 病人不良预后有较高的预测价值。
本次研究存在一定的局限性。首先,本研究纳入的样本量较少,研究结果有待进一步证实;其次,MI 病人行DTI 目前存在一定的困难,如何获得更为稳定的MI 病人DTI 图像有待临床探讨;最后,Periostin、LPA 参与左心室重构的机制有待动物实验验证。
总之,Periostin、LPA 及 DTI 指标可用于预测 MI后LVR,早期检测Periostin、LPA 可作为临床辅助评估预后的重要标志物。

