NEK7在慢性肝脏炎症及纤维化形成中的作用
王艺睿,王 皓,刘硕琛,倪 鸣,李相成
南京医科大学第一附属医院肝胆中心,江苏 南京 210029
慢性肝炎是肝硬化的主要病因,全球每年有100多万人死于肝硬化,目前中国有多达700万人患有肝硬化,而且患病人数不断增加[1]。肝硬化晚期患者通常由于肝功能受损、胃食管静脉曲张、腹水甚至肝细胞癌而导致预后不良[2]。
巨噬细胞在很多人类疾病的发生与发展中起着重要作用,运用巨噬细胞的治疗方案已经用于许多不同的疾病当中,如肾病、遗传性肺泡蛋白沉积症和肝纤维化[3]。虽然巨噬细胞在肝脏纤维化中起重要作用已经被公认,但是巨噬细胞在肝脏纤维化的发生和发展中的作用机制尚不清楚[4]。
NOD 样受体家族3(nucleotide⁃binding oligomer⁃ization domain⁃like receptors,NLRP3)炎症小体信号通路可由多种炎症因子激活[5],其中氧化应激产生的活性氧(reactive oxygen species,ROS)是NLRP3激活的关键因素。应激诱导的ROS通过调节相关信号通路进而诱导NLRP3 激活来介导宿主防御反应[6]。NIMA 相关蛋白激酶7(never in mitosis gene a⁃relat⁃ed kinase 7,NEK7)则是通过NEK7⁃NLRP3 的相互作用从而启动NLRP3 激活的关键介质,以响应ROS[7]。NEK7 和NLRP3 之间相互结合促进炎症小体的组装以及NLRP3炎症小体的形成,进而导致含半胱氨酸的天门冬氨酸蛋白水解酶⁃1(cysteinyl as⁃partate specific proteinase⁃1,caspase⁃1)的激活,白细胞介素(interleukin,IL)⁃1β的分泌和成熟[8]。因此,NEK7⁃NLRP3复合体可能在炎症反应过程中起到炎症小体感受器的作用。本研究即探讨NEK7在肝脏炎症及纤维化形成中的作用。
1 材料和方法
1.1 材料
冷冻离心机(Eppendorf 公司,德国);Veriti PCR仪(Applied Biosystems 公司,美国);WIX mini 电泳仪和酶标仪(北京Wix Technology 公司);Pannoram⁃ic DESK扫描仪(3D HISTECH公司,匈牙利);TRIzol(Invitrogen 公司,美国);RNA 反转录试剂盒,SYBR Green PCR(南京诺唯赞生物科技有限公司);免疫组化试剂盒、Masson、天狼星红染色试剂盒(上海碧云天生物技术有限公司);胎牛血清、DMEM 细胞培养基(Gibco公司,美国);NEK7抗体(Abcam公司,美国);ELISA 试剂盒(杭州联科生物技术有限公司);NLRP3、IL⁃1β、C⁃caspase⁃1和β⁃actin 等抗体(CST 公司,美国);LY6G、CD11b 和F4/80 等抗体(武汉赛维尔生物科技有限公司);NS⁃siRNA、NEK7⁃siRNA、siRNA 转染试剂盒(sc⁃61175,Santa Cruz Biotechnol⁃ogy公司,美国)。
所有肝脏标本取自南京医科大学第一附属医院肝切除患者。根据Metavir 评分和病理组织报告对患者肝组织的样本进行分析。正常对照男3例,女2例,年龄(48.3±4.2)岁,肝硬化评分为0~1分;纤维化患者中,男4例,女1例,年龄(58.6±3.5)岁,肝硬化评分为3~4分。本研究得到南京医科大学第一附属医院伦理委员会的批准(伦理批号:2018⁃SRFA⁃197)。
SPF 级8 周龄的C57BL/6J 雄性小鼠20 只,均采购自南京医科大学动物中心。分笼试养,在室温下每天予以12 h光照,自由饮水、摄食。
1.2 方法
1.2.1 小鼠分组和模型制备
C57BL/6J 小鼠采用腹腔注射四氯化碳(CCL4,10%橄榄油,2 mL/kg,每周2次,共8周)建立小鼠肝脏纤维化模型组;对照组则采用C57BL/6J小鼠腹腔注射10%橄榄油。巨噬细胞特异性表达甘露糖受体,运用甘露糖偶联聚合物作为载体,将NS⁃siRNA 和NEK7⁃siRNA与甘露糖偶联聚合体混合静置20 min,在腹腔注射CCl4造模4 h之前,通过尾静脉注射小鼠体内(siRNA 2 mg/kg,每周2 次,共8 周),用于特异性干扰小鼠巨噬细胞中NEK7 的表达。具体分组:橄榄油+NS⁃siRNA 组,橄榄油+NEK7⁃siRNA 组,CCL4+NS⁃siRNA组,CCL4+NEK7⁃siRNA组,每组5只。
1.2.2 组织免疫化学染色
所有标本均用10%福尔马林液固定,常规石蜡包埋、切片,行免疫组化染色,梯度酒精脱水,丙酮固定,抗原修复,加入NEK7抗体过夜,第2天经PBST 冲洗3 次,加入二抗,室温孵育30 min,冲洗3次。
1.2.3 HE、Masson和天狼星红染色
HE 染色:切片脱蜡处理后,使用苏木素染色液染色10 min,蒸馏水洗涤,伊红染色液染色2 min。进行乙醇脱水、二甲苯透明,封片剂封片。Masson染色:切片常规脱蜡,依次使用苏木素染色液、Mas⁃son 蓝化液和丽春红品红染色液染色后,弱酸工作液洗涤,行脱水、透明、封片剂封片。天狼星红染色:切片脱蜡,天狼星红染色液滴染1 h,蒸馏水冲洗后,行苏木素染色液染核,行脱水、透明、封片剂封片。
1.2.4 组织免疫荧光染色
切片抗原抗体修复与脱蜡处理后,用固定液固定30 min。洗涤液洗涤,用封闭液封闭60 min,去除封闭液,用稀释的一抗4 ℃孵育过夜,去除一抗,用洗涤液洗涤。加入带有荧光标记的二抗避光孵育60 min,洗涤液洗涤,DAPI 染色60 min,洗涤液洗涤,封片剂封片。
1.2.5 Western blot检测
取少量肝脏组织块并用剪刀尽量剪碎,加入500 μL 裂解液后置于冰上裂解30 min,4 ℃12 000g离心15 min离心后取上清,BCA法测定蛋白浓度。将蛋白样本行SDS⁃PAGE,采用电转膜法将蛋白转移至NC 膜上。采用快速封闭液封闭30 min 后,分别加入NEK7、IL⁃1β和C⁃caspase⁃1一抗4 ℃孵育过夜,次日加入二抗室温孵育2 h,加入化学显影液曝光。
1.2.6 qRT⁃PCR检测
取小鼠肝组织研磨后加入TRIzol 试剂提取组织总RNA,测定浓度,使用反转录试剂盒在37 ℃15 min,85 ℃5 s 的条件下反转录得到cDNA。在避光条件下,将逆转录好的cDNA 溶液1 μL,与0.2 μL的前引物,0.2 μL 的后引物,5 μL的SYBR Green,以及3.6 μL 无RNA 酶的ddH2O 配制成10 μL 体系。采用2-ΔΔCt值计算mRNA 的相对表达量。每组试验均重复至少3次。相关引物序列见表1。

表1 qRT⁃PCR引物序列Table 1 Sequences of the primers for qRT⁃PCR
1.2.7 提取纯化肝脏巨噬细胞
用腹腔注射戊巴比妥的方法麻醉C57BL/6J 小鼠,开腹,暴露肝叶下方的门静脉,将留置针插入其中,拔出针芯,灌注事先预热准备的37 ℃灌注液,肝脏充盈一段时间后,剪断下腔静脉,灌注到流出液体为清亮液体,再用事先预热准备的具有胶原酶的37 ℃灌注液,一直灌注至肝脏柔软。取出肝脏,去除多余组织,放置消化液中静置15 min,通过无菌滤嘴过滤,收集过滤后的组织液体,50g离心2 min,取上清液体500g离心8 min,然后用培养基重悬沉淀,分别采用3 mL 的50%Percoll 液、25%Percoll 液和3 mL的细胞悬浮液铺层,800g离心15 min,吸取中间一层至离心管中,500g离心8 min,培养基重悬沉淀,铺板,30 min 后换液,留下贴壁细胞,用于West⁃ern blot检测NEK7⁃siRNA的干扰效率。
1.3 统计学方法
统计学分析及相关绘图通过GraphPad Prism 6软件实现。所有实验数据均以均数±标准差()表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 NEK7在肝纤维化患者肝脏组织中的表达
为了检测NEK7在正常肝脏及肝纤维化患者肝脏组织中的表达,分别取5 例正常肝脏组织和5 例肝纤维化患者肝脏组织包埋切片,通过HE 和Mas⁃son 染色观察发现,肝硬化患者较正常肝脏组织肝纤维化更为明显(图1A)。通过qRT⁃PCR 技术检测对比发现肝纤维化患者纤维化相关指标金属蛋白酶组织抑制因子1(tissue inhibitor of metalloprotein⁃ases 1,TIMP1)和Ⅰ型胶原蛋白(Collagen⁃Ⅰ)的RNA 水平明显升高(图1B)。同时采用qRT⁃PCR 技术及Western blot 技术检测表明,NEK7 mRNA 和蛋白的表达水平在纤维化肝脏组织明显高于正常肝脏组织(图1C)。此外,通过免疫组织荧光染色技术发现CD68阳性细胞中NEK7的表达量显著增加(图1D)。这些结果表明在肝纤维化患者的肝脏组织中NEK7表达上调,尤其是在巨噬细胞当中。
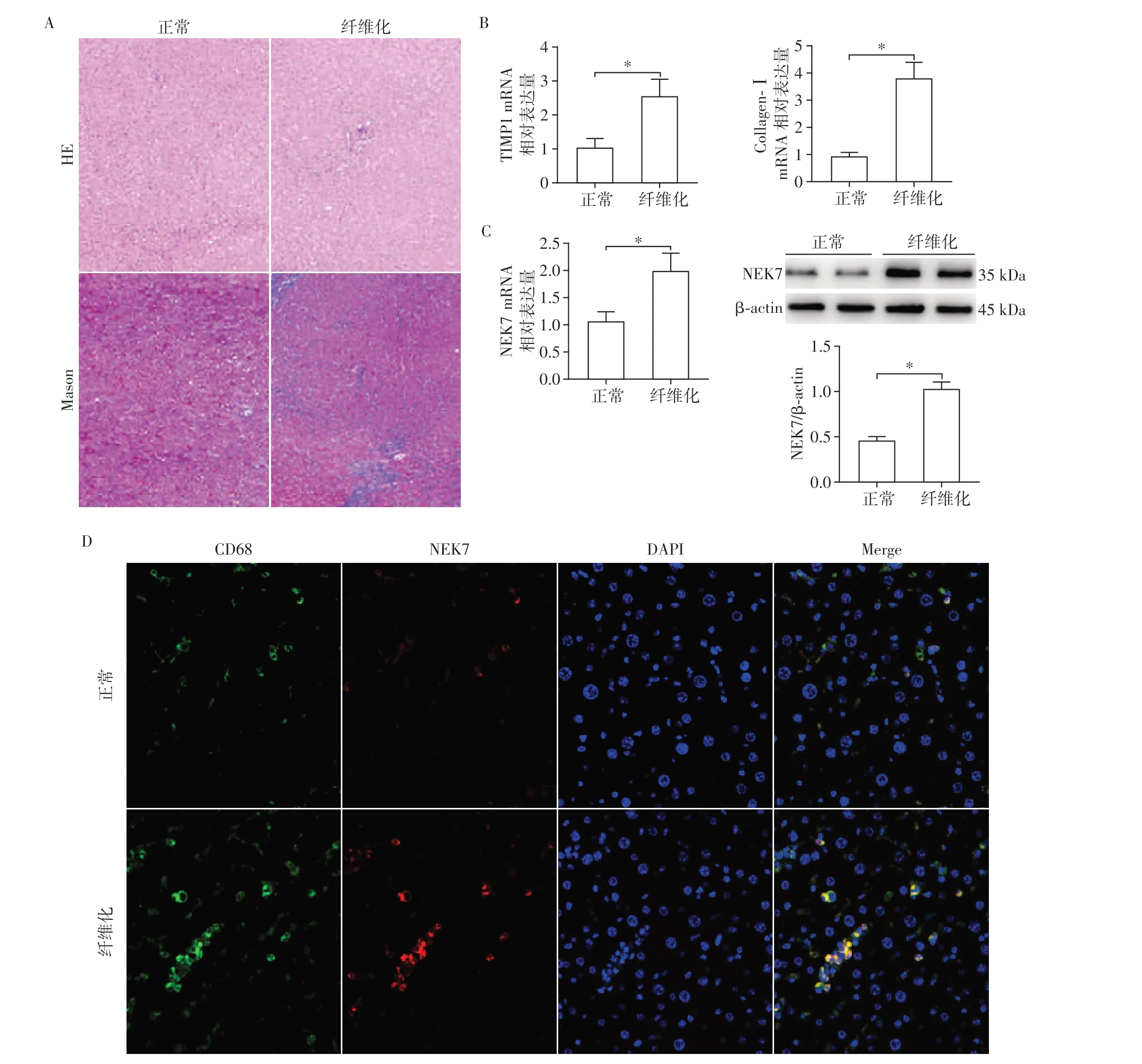
图1 NEK7在正常肝脏和肝纤维化患者肝脏组织中的表达Figure 1 Expression of NEK7 in liver tissues of normal and liver fibrosis
2.2 干扰小鼠巨噬细胞中NEK7的表达对肝脏纤维化的影响
通过HE、Masson 和天狼星红组织化学染色技术,观察到未经过腹腔注射CCL4的小鼠肝脏无明显纤维化,然而采用CCL4腹腔注射的小鼠当中,NS⁃siRNA组较NEK7⁃siRNA组纤维化明显(图2A)。同时采用qRT⁃PCR 技术发现,NS⁃siRNA 组较NEK7⁃siRNA 组纤维化指标Collagen、Collagen⁃Ⅰ、Ⅱ型胶原蛋白(Collagen⁃Ⅱ)、TIMP1、转化生长因子⁃β(transforming growth factor⁃β,TGF⁃β)的基因表达水平更高(图2B)。

图2 抑制小鼠巨噬细胞中NEK7的表达可减轻肝脏纤维化的程度Figure 2 NEK7 deficiency in macrophages alleviates CCl4⁃induced liver fibrosis
2.3 NEK7 可通过NLRP3 炎症小体信号通路调控炎症反应和纤维化
为了进一步探讨NEK7减轻炎症反应和肝脏纤维化发生和发展的机制,通过免疫组织化学染色和免疫荧光染色,检测了LY6G、CD11b 和F4/80 的表达,发现抑制巨噬细胞中NEK7 的表达可以减轻肝脏纤维化时中性粒细胞和巨噬细胞的聚集以及炎症反应(图3A、B、C)。通过ELISA 试剂Oil盒检测各组小鼠血清中IL⁃1β水平的差异(图3D)。为了验证甘露糖偶联聚合体体系中NEK7⁃siRNA对肝脏巨噬细胞的敲低效率,通过肝脏灌注纯化获取肝脏巨噬细胞,并进行了Western blot实验加以验证,结果显示,NEK7⁃siRNA较NS⁃siRNA组巨噬细胞中的NEK7的表达明显被抑制(图3E)。同时我们测定了NLRP3、IL⁃1β和C⁃caspase⁃1 的蛋白表达,结果显示,NEK7⁃siRNA 组中相应表达量明显减少(图3F),因此认为NEK7可通过NLRP3炎症小体信号通路调控小鼠肝脏纤维化的发生和发展进程。
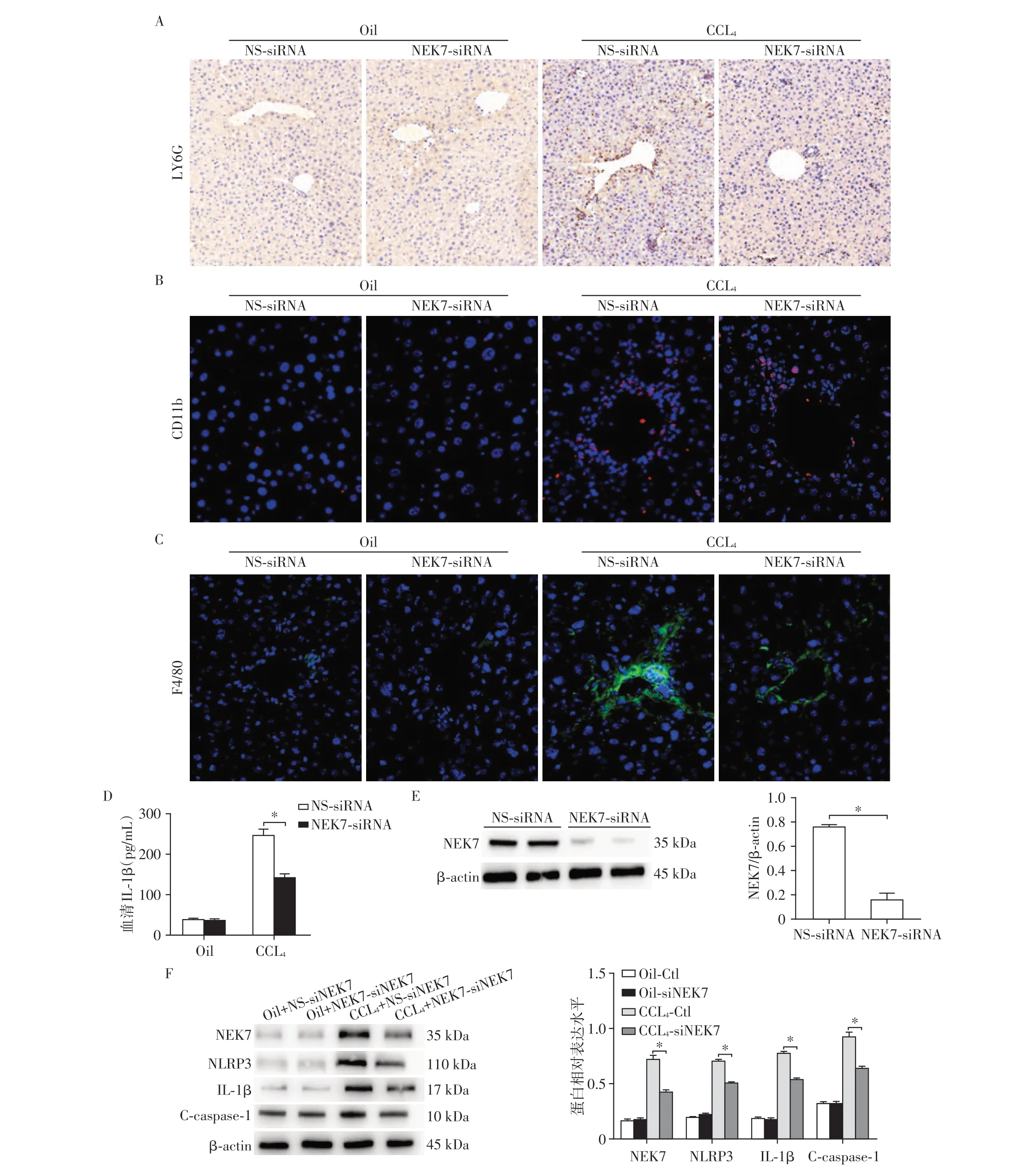
图3 NEK7可通过NLRP3炎症小体信号通路调控炎症反应和纤维化Figure 3 NEK7 can regulate inflammation response and liver fibrosis by NLRP3 signaling pathway
3 讨论
肝脏纤维化是慢性肝脏疾病的常见病理结果[9]。慢性肝炎的患者常可观察到过度肝脏纤维化。肝脏纤维化的发展是慢性肝病的主要并发症之一,其临床结局很多,如与肝纤维化相关的腹水和食管静脉曲张的发展相关联。有研究表明,在有纤维化病变的小鼠肝脏组织中NEK7的表达增加,然而,目前巨噬细胞中NEK7 对纤维化的影响未见报道。此前,本团队[10-11]以及Yue 等[12]都采用甘露糖偶联聚合体体系联合siRNA 进行小鼠尾静脉注射,用于体内特异性干扰巨噬细胞内基因表达。其中Yue等[12]研究证实了巨噬细胞中的热休克转录因子1(heat shock transcription factor,HSF1)通过NLRP3 炎症小体信号通路调节小鼠肝脏缺血再灌注中的损伤,其对下游巨噬细胞中NLRP3的回复实验中,运用甘露糖偶联聚合体体系,在小鼠肝脏缺血再灌注造模4 h前,通过尾静脉注射特异性干扰RNA抑制巨噬细胞中NLRP3 的表达。证实了在缺血再灌注损伤模型中,抑制巨噬细胞中HSF1 的表达可以促进炎症反应从而加重损伤。本文探究的NEK7已经被确定为NLRP3 炎症小体激活的选择性上游调节因子[13],NEK7可以通过激活NLRP3进而促进炎症反应。
慢性肝损伤不仅由损伤剂对肝细胞的直接作用引起,还与伴随的先天免疫反应产生的细胞因子有关。肝脏炎症和纤维化是由复杂的免疫途径控制,因而涉及许多可能的治疗靶点。对炎症潜在机制的理解应该转化为临床治疗的方法[14]。最近的研究表明,巨噬细胞是先天免疫系统的关键组成部分,参加肝脏炎症反应。巨噬细胞的主要功能涉及细胞因子的产生,并共同构成一个高度复杂的免疫系统稳态网络。虽然肝脏巨噬细胞在肝脏纤维化的发生和发展中起着重要的作用,但其潜在的机制在很大程度上仍然是未知的。
由NOD样受体形成的炎症小体中,NLRP3是最具有特征性的NOD 样受体。NLRP3 炎症小体是一个重要的信号转导节点,控制着IL⁃1β和IL⁃18 这2个因子的成熟[15]。NLRP3炎症小体组装完成后,将休眠的pro⁃caspase⁃1 裂解成活化的caspase⁃1。随后,caspase⁃1将细胞因子前体pro⁃IL⁃1β和pro⁃IL⁃18转化为成熟的、具有生物活性的IL⁃1β和IL⁃18。NEK7 作为在脊髓动物中发现的11 种NEK 激酶之一,属于调节有丝分裂进程中和DNA 损伤反应的NIMA 相关激酶(NRKs)家族,已经被确定为NLRP3炎症小体激活的选择性上游调节因子[13]。相应的,caspase⁃1 的激活和IL⁃1β的释放在没有NEK7 激活NLRP3炎症小体的信号转导下将被取消。因此,这说明了NLRP3⁃NEK7 相互作用在NLRP3 炎症小体激活中的特异性和重要性。本研究表明,NEK7 缺乏可以通过减少巨噬细胞中细胞因子的产生来减轻CCL4导致的肝脏炎症。
综上所述,本研究表明,肝纤维化患者较正常人肝脏组织中NEK7 的表达上调,体内特异性抑制巨噬细胞中NEK7的表达可以通过NLRP3炎症小体信号通路来减轻肝脏炎症反应和缓解肝脏纤维化。本研究结果提示,NEK7 可能在肝脏纤维化的发生发展起到关键性作用,可以作为临床上治疗肝硬化潜在的候选药物靶点。

