低强度脉冲超声抑制血管平滑肌和成纤维细胞的钙化
李珺晗,邱 铭,陆 艳,孙 伟,孔祥清
南京医科大学第一附属医院心血管内科,江苏 南京 210029
血管钙化是高血压、慢性肾病、血管损伤、糖尿病血管病变和衰老等过程中广泛存在的一种病理性血管重构,是导致心脑血管疾病高病死率的重要因素之一。众多研究表明血管钙化是一个与骨形成相似的主动性、可调控的异位成骨样分化和钙磷沉积过程。在血管组织中,间质细胞包括血管平滑肌细胞和成纤维细胞是发生钙化的主要细胞,它们在各种致病因素的作用下发生成骨样分化和钙磷含量增加,构成了血管钙化尤其是血管中膜、外膜钙化的主要细胞学基础[1]。由于钙化的机制复杂,目前实际诊疗中尚没有有效的治疗药物。近年来研究表明,低强度脉冲超声(low intensity pulsed ul⁃trasound,LIPUS)对机体的细胞和组织具有非灭活性生物学效应。例如LIPUS可以促进血管内皮细胞的成血管功能[2],促进骨折愈合等[3]。但LIPUS能否改善血管钙化尚没有研究报道。本研究拟通过研究LIPUS 对细胞生物学功能的调节,探索其抑制血管钙化的效果。
1 材料和方法
1.1 材料
大鼠平滑肌细胞、大鼠成纤维细胞来源于南京市江宁区青龙山动物繁殖场,配制钙化培养基:DMEM(含HEPES)高糖培养基,含1%胎牛血清(FBS)、1%青/链霉素、2 mmol/L 磷酸盐(Pi)、1.5 mmol/L 钙盐(Ca)。使用的一抗:GAPDH抗体(#5174)、RUNX2 抗体(#12556)(Cell Signaling Tech⁃nology 公司,美国),OPN 抗体(#BS1264)(Bioworld Technology公司,美国),HRP标记的羊抗鼠二抗、羊抗兔二抗(Cell Signaling Technology 公司,美国)。显影液(SuperSignalTMWest Femto Maximum Sensitivi⁃ty Substrate,Thermo 公司,美国),ChemiDoc XRS 成像系(Bio⁃Rad 公司,美国)。南京医科大学动物保护及使用委员会批准了所有动物协议。所有涉及动物的程序均按照美国国立卫生研究院出版的《实验动物护理和使用指南》(no.85⁃23;1996年修订)进行,研究方案获得了南京医科大学实验动物管理委员会的批准(IACUC⁃1906038)。
1.2 方法
1.2.1 实验分组
茜素红染色、钙浓度测定和碱性磷酸酶(alkaline phosphatase,ALP)活性测定分为6 组,包括空白对照组(Ctrl)、高钙磷处理组(HCa+Pi)、92 mW/cm2声强LIPUS 处理组(92 mW/cm2LIPUS)、14 mW/cm2声强LIPUS+高钙磷处理组(14 mW/cm2LIPUS+HCa+Pi)、44 mW/cm2声强LIPUS+高钙磷处理组(44 mW/cm2LIPUS+HCa+Pi)、92 mW/cm2声强LIPUS+高钙磷处理组(92 mW/cm2LIPUS+HCa+Pi)。Western blot、real⁃time PCR 实验分为4组,包括空白对照组(Ctrl)、高钙磷处理组(HCa+Pi)、14 mW/cm2声强LIPUS 处理组(14 mW/cm2LIPUS)、14 mW/cm2声强LIPUS+高钙磷处理组(14 mW/cm2LIPUS+HCa+Pi)。
1.2.2 大鼠平滑肌细胞(rat vascular smooth muscle cell,rVSMC)和成纤维细胞(rat vascular adventitial fibroblast,rVAF)的提取
rVAF 的提取:将3 只健康雄性清洁级SD 大鼠(180~200 g)麻醉后,在无菌条件下取出大鼠的胸主动脉,放入预冷无菌PBS中暂存。配置1 200 U/mL胶原酶消化液,抗生素梯度清洗血管后,转入放有胶原酶消化液的皿中,摇床消化30 min(37 ℃、转速45 r/min)。用显微器械在体式显微镜下分离主动脉外膜,将外膜转入加了胶原酶的消化液中,放入摇床消化1 h(37 ℃、转速120 r/min),离心弃上清,加入含10%FBS的DMEM新鲜完全培养基,用100 μm滤网过滤后转入25 cm2培养瓶中于37 ℃、5% CO2培养箱中培养,48 h 观察贴壁后换培养基。细胞进行传代培养,选取第3 代至第5 代的细胞进行后续实验。
rVSMC 的提取:抗生素梯度清洗撕去外膜的血管,将血管转入含有20%FBS的DMEM 新鲜完全培养基中,于37 ℃、5%CO2培养箱中过夜。18 h 后将沿血管纵轴剪开,钝物刮除内膜,将血管剪碎后,转入胶原酶消化液中,放入摇床消化2 h(37 ℃、转速50 r/min),弃上清,加有20%FBS 的DMEM 新鲜完全培养基,用100 μm滤网过滤后转入25 cm2培养瓶中37 ℃,5%CO2培养箱中培养。48 h观察贴壁后换培养基。细胞进行传代培养,选取第3代至第5代的细胞进行后续实验。
1.2.3 体外诱导rVCMC和rVAF钙化模型的构建
用生理盐水溶解钙、磷后加入DMEM 培养基中,使磷的终浓度达到2 mmol/L,钙的终浓度达到1.5 mmol/L,使用高钙磷钙化培养基处理rVSMC 和rVAF72 h。
1.2.4 体外细胞模型中低强度脉冲超声处理
低强度脉冲超声刺激是利用一组超声设备进行的,包括信号发生器(安捷伦科技有限公司,美国)、宽带功率放大器(罗切斯特电子创新有限公司,美国)和平面换能器(重庆海福)。平面换能器频率为1 MHz,通过改变电压和刺激周期来施加不同的LI⁃PUS 强度处理(以声强mW/cm2表示)。选择14、44、92 mW/cm23种不同的声强,将传感器(直径6 cm)置于水缸中,将细胞培养皿的底部放入传感器中,注入脱气水。细胞悬液暴露于LIPUS 刺激5 min(LIPUS 组),而对照不进行LIPUS 刺激。在超声波处理过程中,培养皿中细胞培养基的温度不超过37 ℃。
1.2.5 细胞钙浓度测定
吸去培养基后,用PBS将12孔板中培养的细胞清洗3次,每孔加入500 μL 0.6 mol/L盐酸对细胞进行脱钙处理,放入4 ℃摇床,24 h 后收集并进行检测。使用试剂盒:QuantiChromTMCalcium Assay Kit(DICA 500,QuantiChrom 公司,美国)。取5 μL样品加入96 孔板,加入200 μL 工作液,室温振荡3 min后使用SynergyTM2 microplate reader(BioTek 公司,美国)读取612 nm 处吸光度。将12 孔板中液体吸净,预冷PBS 冲洗3 次后加入0.1%SDS 或0.1 mol/L NaOH 裂解细胞,收集后离心(4 ℃、13 000g)20 min并吸取上清,使用BCA 法测蛋白浓度(BCA Protein Assay kit,Thermo Scientific Pierce 公司,美国)。钙浓度值计算:标准化钙浓度(μg/mg protein)=绝对钙浓度/蛋白浓度。
1.2.6 ALP活性测定
吸去培养基后,用PBS 将12 孔板中培养的细胞清洗3 次;每孔加入250 μL 0.05 %的曲拉通X⁃100 裂解细胞,3 次冻融后收集孔中液体,离心(4 ℃、15 000 r/min)15 min 后吸上清液作为样品。使用ALP 试剂盒(WAKO 公司,日本)。做标准曲线,将100 μL 底物和20 μL 样品加入96 孔板,振荡1 min 后37 ℃孵育15 min;添加80 μL 反应终止液,充分振荡1 min 后,用SynergyTM2 micro plate reader(BioTek 公司,美国)测量405 nm处的吸光度值。同法测定空白对照和标准品。BCA 法检测样品的总蛋白浓度,根据公式C×a/(t×M)计算ALP 活性。C:由标准曲线得到的吸光度值(实验值与空白值的差值);t:反应时间(min);M:样品的总蛋白浓度;a:样品的稀释倍数。
1.2.7 茜素红染色
吸取12 孔板中培养基,PBS 漂洗3 次;4%甲醛溶液固定10 min 后用PBS 漂洗3 次;95%乙醇固定20~30 min,去离子水洗涤3 遍;2%茜素红S 染色1 min,显微镜下观察橘红色结节的情况;去离子水洗涤数次至无非特异性染色,使用扫描仪扫描图像。
1.2.8 实时荧光定量PCR
使用RNeasy RNA isolation kit(Qiagen 公司,美国)提 取rVAF、rVSMC 的 总RNA,使 用Prime⁃ScriptTMRT re⁃agent Kit(TaKaRa 公司,日本)进行cDNA 合成。引物RUNX2:正向引物5′⁃TCTCA⁃GATCGTTGAACCTTGCTA⁃3′,反向引物5′⁃TGGT⁃TACTGTCATGGCGGGTA⁃3′;OPN:正向引物5′⁃GA⁃CACGAAGGTAAAGGTGAC⁃3′,反向引物5′⁃CTG⁃GTGCTCGTCCTCTACTAC⁃3′;通过实时荧光定量PCR(Prism 7900,ABI 公司,美国)系统进行检测。所有荧光定量PCR反应均重复3次,用GAPDH将目标基因进行标准化。按照对照组将CT值进行标准化,计算各组CT值的变化。
1.2.9 Western blot
将各组细胞用PBS 漂洗2 次,根据Cytoplasmic Extraction Reagents(Thermo 公司,美国)试剂盒提取细胞蛋白,并在-70 ℃下保存至直使用。蛋白产物经10%~15%的SDS 聚丙烯酰胺凝胶分离后转移到PVDF 膜(Roche 公司,瑞士)上,5%BSA 溶液封闭后孵育一抗,后孵育相对应的HRP 偶联二抗(1∶5 000稀释)。使用一抗:GAPDH抗体(#5174)、RUNX2抗体(#12556)、OPN抗体(#BS1264)[4],使用二抗:HRP标记的羊抗鼠二抗、羊抗兔二抗。使用显影液反应1 min 后,在ChemiDoc XRS 成像系统下曝光。Image Lab™软件用于条带灰度分析。
1.3 统计学方法
使用GraphPad Prism 5.0软件进行统计学分析,计量数据表示为均值±标准误()。两组比较选择t检验,4组数据选择单因素方差分析和Bonferroni多重比较。P<0.05为差异有统计学意义。
2 结果
2.1 LIPUS对rVSMC钙化的影响
分别应用14、44、92 mW/cm23个声强LIPUS 辐照rVSMC 1 次(5 min)后,给予高钙磷培养基培养72 h,结果显示,茜素红染色显示14~92 mW/cm2的LIPUS 预处理组细胞钙沉积显著低于对照组,以14 mW/cm2最为显著(图1A)。14~92 mW/cm2的LI⁃PUS 处理组与高钙磷处理组比较,细胞内钙含量明显降低(P<0.001,图1B)。ALP 活性结果表明高钙磷处理显著增加了rVSMC 的ALP 活性,而LIPUS 处理组与高钙磷处理组相比,降低了细胞内ALP活性(P<0.001,图1C)。
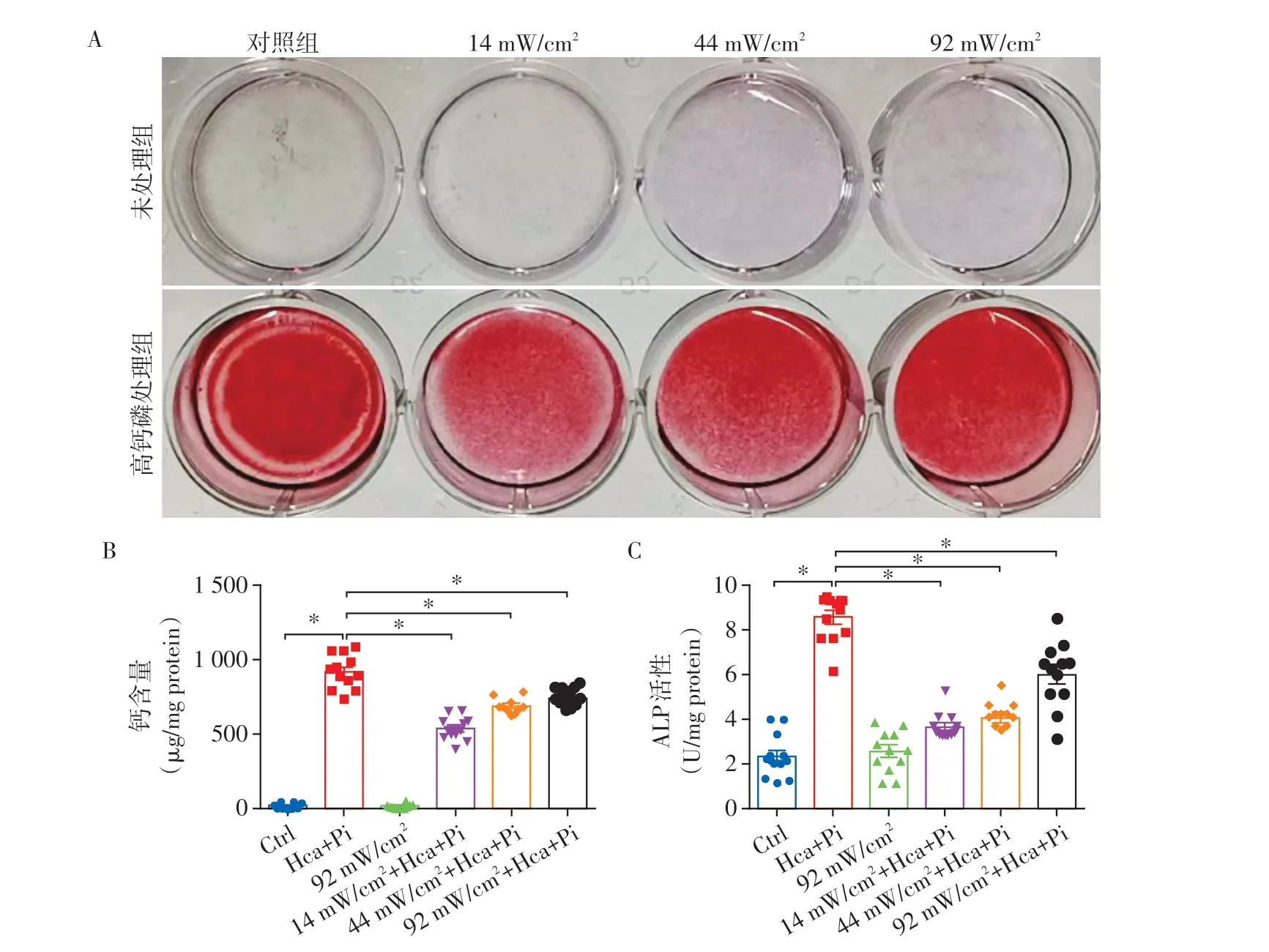
图1 不同声强低强度脉冲超声在大鼠rVSMC的抗钙化作用Figure 1 The protective effect of low intensity pulsed ultrasound with different intensity on calcification in rVSMV
2.2 LIPUS对rVAF钙化的影响
分别应用14、44、92 mW/cm23个声强LIPUS 辐照rVAF 1 次(5 min)后,给予高钙磷培养基培养72 h,茜素红染色显示14、44 mW/cm2的LIPUS 预处理组细胞钙沉积显著低于对照组,92 mW/cm2有下降趋势,但差异无统计学意义(图2A)。14~92 mW/cm2的LIPUS 处理组与高钙磷处理组比较,细胞内钙含量明显降低(P<0.01,图2B)。ALP 活性结果表明高钙磷处理显著增加了rVAF的ALP活性,而LIPUS处理组与高钙磷处理组相比,降低了细胞内ALP活性(P<0.001,图2C)。
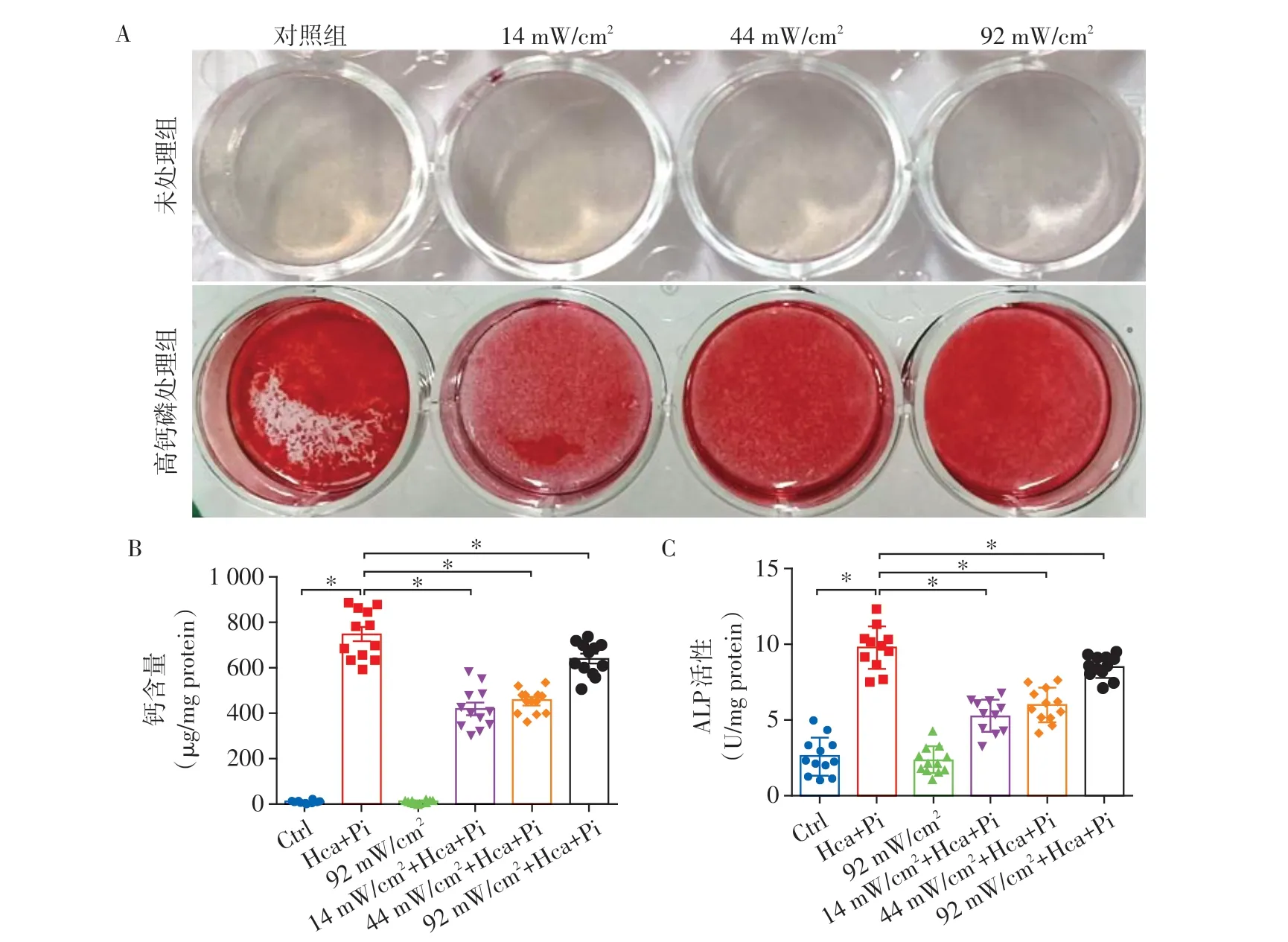
图2 不同声强低强度脉冲超声在大鼠rVAF的抗钙化作用Figure 2 The protective effect of low intensity pulsed ultrasound with different intensity on calcification in rVAF
2.3 LIPUS 抑制血管平滑肌细胞、血管成纤维细胞的成骨分化
Western blot 和real⁃time PCR 结果显示,高磷钙培养基显著增加了rVSMC 和rVAF 成骨分化指标RUNX2 和OPN的表达。14 mW/cm2LIPUS 处理抑制了高磷钙处理组的RUNX2 和OPN 蛋白高表达,表明其发挥了抗钙化的保护作用(图3)。

图3 低强度脉冲超声对成骨分化的抑制作用Figure 3 The inhibition of low intensity pulsed ultrasound on osteogenic differentiation
3 讨论
临床上促进血管钙化发生发展的因素主要有高血压、糖尿病、肾功能不全和吸烟等,其中尤其以慢性肾病引起的钙磷代谢紊乱所致的血管钙化后果最为严重,主要好发于中青年人群,是导致此类患者死亡的重要原因之一。慢性肾病相关的血管钙化主要表现为弥漫性血管中膜钙化,导致血管弹性丧失,从而引起顽固性血压升高和致死性出血等严重并发症[5],动脉钙化程度也被认为是影响慢性肾病患者预后的最佳血管指标之一[6]。血管钙化最终表现为钙磷结晶在动脉管壁上的沉积,组织内钙磷水平的失衡是血管钙化形成的核心环节,血清和局部组织内异常升高的钙磷水平促进血管间质细胞发生成骨分化、细胞凋亡等,导致羟基磷灰石结晶的形成和发展[7]。而迄今为止,由于对血管钙化的机制尚不完全清楚,临床上缺乏有效的防治血管钙化的方法。因此,关注血管钙化,尤其是加强对血管钙化病理机制和干预方法的研究对于提高对人体内血管稳态的深入理解,降低心脑血管严重并发症和病死率具有重要意义。
超声波应用于临床诊断已有50年的历史,诊断性超声由于其声波频率高、功率低,短时间内对人体组织不会产生明显影响。与诊断超声相比,治疗性超声在临床的应用也有近30年的历史,其中体外冲击波超声最先应用于泌尿系结石的治疗[8],近10年高强度聚焦超声也被用于肿瘤组织的消融[9],这两种方式的治疗原理都是通过高功率的超声能量作用与局部组织,产生损毁式效应,达到碎石和肿瘤组织灭活的效应。LIPUS 是一种特殊类型的超声,它具有热效应小、强度低等特点,同时能把声能传输到靶组织,能够为治疗应用提供非侵入性物理刺激[10]。已有研究表明,LIPUS 对多种细胞具有生物学效应,包括增加细胞膜渗透性[11],调节细胞凋亡[12-13]、增殖[14]、分化[15]和迁移[16]。那么在高钙磷诱导的rVSMC和rVAF的钙化中,LIPUS是否也可以发挥抑制血管钙化的作用,减少血管钙盐沉积?从本研究结果可以看出,LIPUS 显著降低了高钙磷诱导的rVSMC 和rVAF 内的钙含量,抑制了ALP 活性的增高,同时其钙沉积也显著下降。Western blot实验和real⁃time PCR 结果都显示LIPUS 组中,RUNX2 和OPN的表达显著降低。
综上所述,LIPUS 可以显著抑制高钙磷诱导的rVSMC和rVAF的钙化,通过抑制RUNX2的表达,缓解了rVSMC 和rVAF 的成骨分化过程,减少了细胞钙沉积。这一发现也将为临床开辟治疗血管钙化提供新思路。

