不同产地藤茶中二氢杨梅素含量及其与牛蒡子配伍的药效学研究
孙 睿,付 丽,雷 雨 (. 北京碧生源药业有限公司,北京,0433;. 上海交通大学医学院,上海,0040)
藤茶即显齿蛇葡萄Ampelopsis grossedentata(Hand.-Mazz.) W. T. Wang,是葡萄科蛇葡萄属的一种野生木质落叶藤本植物,俗称藤茶、白茶等。其产地主要分布于湖南、湖北、云南、贵州、广东、广西、福建等地[1]。我国壮族和瑶族百姓,以及产地居民将其幼嫩茎叶经揉制、干燥制成保健茶,用于感冒、发热、咽喉肿痛、疮疖等症,至今已有数百年的历史[2-3]。二氢杨梅素(dihydromyricetin,DMY)为藤茶中主要的二氢黄酮醇类化合物,既往研究证实二氢杨梅素具有抗氧化、抗肿瘤、抗炎、解酒保肝、抗病原微生物及调血脂等多方面的药理作用[4-5]。牛蒡子(Fructus arctii)又名大力子、鼠粘子、恶实等,为菊科二年生草本植物牛蒡(Arctium lappaL.)的干燥成熟果实。具有疏散风热、宣肺祛痰、利咽透疹和解毒消肿的功效[6-7]。笔者通过研究藤茶不同产地、部位、加工工艺的二氢杨梅素含量,进一步完善藤茶的质量标准。评价优选藤茶与牛蒡子配伍的清咽功效,为进一步开发清咽功能保健食品提供实验依据。
1 材料
1.1 药材与试剂
藤茶植物原料于2018 年6~8 月采自湖南、湖北、福建、贵州不同乡镇,所有采集的原植物均经药学高级工程师雷雨博士鉴定为葡萄科蛇葡萄属植物显齿蛇葡萄(Ampelopsis grossedentata)的茎叶部位。不同植株采收间隔不小于300 m,单株不同采收方式及部位分为人工采收(芽尖、嫩叶、粗老叶、茶梗)、机器采收;藤茶(批号:20180620,贵州江口梵净山云峰野生植物开发有限公司);牛蒡子(批号:171101,安国市深豪药业有限公司);藤茶牛蒡子浓缩液:取采收地为贵州江口县的芽尖部位优选藤茶及牛蒡子的复配样品105.0 g(藤茶63.0 g,牛蒡子42.0 g),常压、温度80 ℃,提取2 次,每次各用1 050 ml无菌水浸泡30 min,将提取液合并浓缩至70 ml,以下简称“复配样品”;二氢杨梅素对照品(99.57 %,MMST-18031501,中国科学院成都生物研究所成都曼思特生物科技有限公司);甲醇(色谱纯,Fisher Chemical);纯水(MLMP-1-20T,四川优普超纯科技有限公司优普系列超纯水器);磷酸(90 %,BCBD9465,Fluka);乙醚(国药集团化学试剂北京有限公司);碘伏(山东利尔康牌医疗科技股份有限公司)。
1.2 仪器
安捷伦高效液相色谱仪(Agilent 1 290,DAD检测器);超声波仪器(上海睿祺电子设备有限公司);QHAMS 型精密十万分之一天平;FW100 型高速万能粉碎机(天津市泰斯特仪器有限公司);XRYLS-25A 型电动耳肿打孔器(上海欣软信息科技有限公司);电热鼓风干燥箱(上海一恒科技有限公司);微量加样器(Hamilton)。
1.3 动物
SPF 级SD 大鼠,雄性,体重(185 ± 15)g,10 周龄,购自北京华阜康生物科技股份有限公司 [许可证号:SCXK(京)2019-0008]。SPF 级BALB/c 小鼠,雄性,体重(20 ± 2)g,6 周龄,购自北京华阜康生物科技股份有限公司 [许可证号:SCXK(京)2019-0008]。实验动物饲养于北京联合大学应用文理学院保健食品功能检测中心SPF 级动物室 [许可证号:SYXK(京)2017-0038]。分笼饲养,控制室温(25 ± 2)℃,自由摄食、饮水。维持饲料由北京华阜康生物科技股份有限公司 [许可证号:SCXK(京)2019-0008] 生产。
2 实验方法与结果
2.1 色谱条件
色谱柱为Agilent ZORBAX SB-C18柱(250 mm×4.6 mm, 5 μm);甲醇-0.05 %磷酸水溶液(30∶70)为流动相;流动相流速:1 ml/min;检测波长291 nm;柱温25 ℃;进样量10 μl;运行时间20 min;理论塔板数按二氢杨梅素计算不低于3 000。二氢杨梅素保留时间为8.37 min,如图1 所示获得样品色谱图。
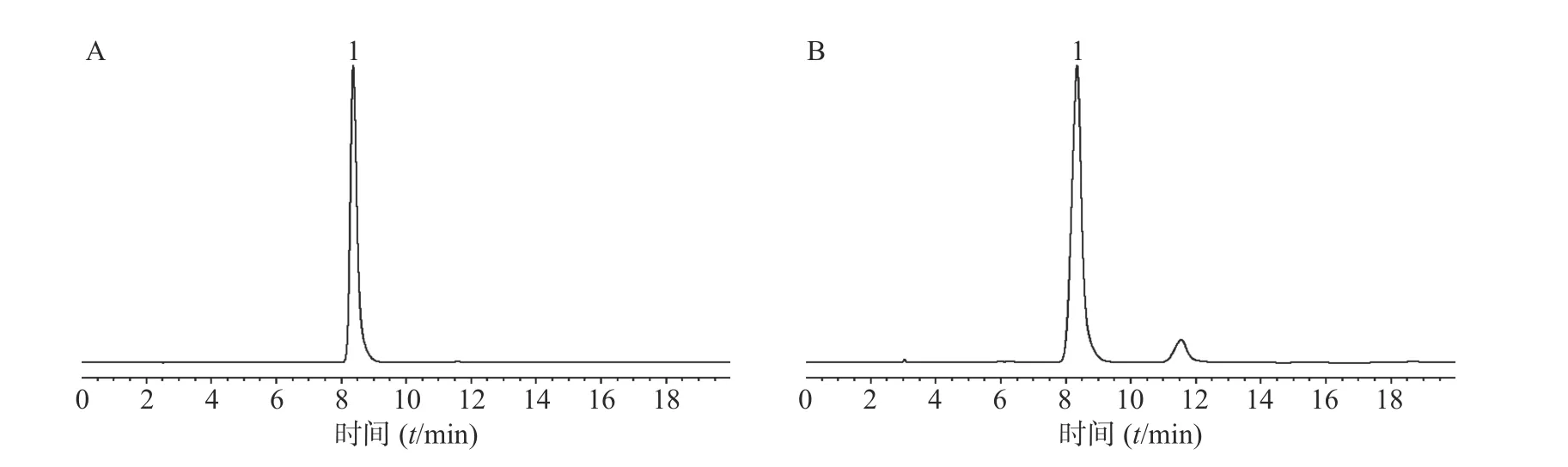
图1 二氢杨梅素对照品(A)及贵州江口梵净山藤茶样品(B)的HPLC 图
2.2 溶液的配制
2.2.1 对照品溶液的制备
精密称定二氢杨梅素对照品12.72 mg,置于10 ml 容量瓶中,以甲醇溶解并稀释至刻度,摇匀,经0.45 μm 滤膜过滤,制得1.272 mg/ml 储备液。
2.2.2 供试品溶液的制备
样品拆袋,混合均匀,粉碎。精密称定样品约0.05 g 于100 ml 容量瓶中,加70 %乙醇,超声提取30 min。取出后冷却至室温,加入70 %乙醇定容至刻度,摇匀,静置。经0.45 μm 微孔滤膜过滤后,供液相色谱分析用。
2.3 方法学考察
2.3.1 线性关系考察
采用逐级稀释法,量取适量二氢杨梅素储备液,至于10 ml 容量瓶中,加70 %乙醇定容,制得浓度分别为0.019 9、0.039 8、0.079 5、0.159、0.318 mg/ml。以进样浓度(mg/ml)为横坐标(X),峰面积为纵坐标(Y),固定进样量为10 μl,绘制标准曲线,回归方程为:Y= 165 202X+ 482.04(r=0.999),表明二氢杨梅素对照品在0.019 9~0.318 mg/ml范围内线性关系良好。
2.3.2 仪器精密度考察
精密吸取二氢杨梅素系列对照品溶液0.079 5 mg/ml,按规定色谱条件重复进样6 次,每次进样10 μl,记录二氢杨梅素的峰面积值,重复6 次进样峰面积的RSD 为0.60 %,表明该方法的仪器精密度良好。
2.3.3 方法重复性考察
称取同一样品6 份,按照“2.2.2”项制备供试品溶液进行重复性试验,二氢杨梅素平均含量为14.23%,RSD 为1.24 %,表明该方法重现性良好。
2.3.4 方法稳定性考察
取同一供试品溶液,分别于0、2、4、6、8、12 h进行测定,二氢杨梅素峰面积RSD 为1.41 %,表明供试品溶液在12 h 内基本稳定,该方法稳定性良好。
2.3.5 加样回收率考察
按9 份样品中二氢杨梅素含量的1.2 倍,1.0 倍,0.8 倍,分别准确加入二氢杨梅素对照品。按照“2.2.2”供试品制备方法制备供试液,HPLC 进样检测,计算加样回收率。该样品二氢杨梅素的加样回收率在95.04 %~100.4 %之间,平均回收率为97.53 %,RSD 为2.00 %,表明本方法的准确度良好,具体结果见表1。
综上,方法学考察结果表明本研究建立的提取和分析方法能够满足藤茶中二氢杨梅素定量分析的要求。
2.4 数据处理
2.5 样品含量测定
供试品溶液进样10 μl,通过回归方程计算不同采收点藤茶芽尖部位的二氢杨梅素含量。结果17 批样品中二氢杨梅素含量介于18.60 %~37.69 %之间,含量较高的采样点在湖南省八大公山、贵州省江口县、贵州省罗场乡,较低的采样点多为湖北及福建一带。具体见表2。

表1 藤茶中二氢杨梅素加样回收率的试样结果(n =9)
表2 不同采收点芽尖部位藤茶中二氢杨梅素的含量( ±s, n =6)

表2 不同采收点芽尖部位藤茶中二氢杨梅素的含量( ±s, n =6)
采样点 含量(%) 不同地区含量(%)湖北恩施 20.80±1.2 24.33±8.1湖北来凤1 18.60±1.1湖北来凤2 33.60±1.0福建将乐1 30.30±0.6 29.47±1.2福建将乐2 28.63±0.9湖南八大公 37.69±0.5 31.66±5.0湖南张家界1 33.67±0.3湖南张家界2 29.83±0.9湖南张家界3 30.39±1.2湖南张家界4 30.43±0.6湖南武陵山1 22.83±0.5湖南武陵山2 36.81±0.8贵州江口1 35.50±0.6 32.26±2.9贵州江口2 31.40±0.8贵州江口3 30.60±0.7贵州罗场1 35.11±1.0贵州罗场2 28.69±0.5
相对于湖南省张家界各采收点差异范围(29.83 %~33.67 %),贵州省江口县(30.60 %~35.50 %)、贵州省罗场乡(28.69 %~35.11 %)、湖北省来凤县(18.60 %~33.60 %)、湖南省武陵山地区(22.83 %~36.81 %),藤茶芽尖部位中DMY 含量出现较大浮动。贵州省总体采收藤茶芽尖含量水平最高,其次为湖南省。
2.5.1 不同采收部位及加工方式样品含量测定
自然晒干法指将新鲜采集的样品摊开,于阳光下晒至全干;自然阴干法指新鲜采集的样品摊开,于阴凉干燥通风处晾至全干。选择总体含量较高且含量趋于平稳的贵州省江口县2 号采收地样品,利用人工采收手法收集同一植株的芽尖、嫩叶、粗老叶及茶梗样品,同时利用机器采收同一植株样本。而后利用不同干燥方式进行加工处理,含测结果如表3 所示。
表3 同一采收地点不同部位及加工方式二氢杨梅素含量( ±s ,n =6)
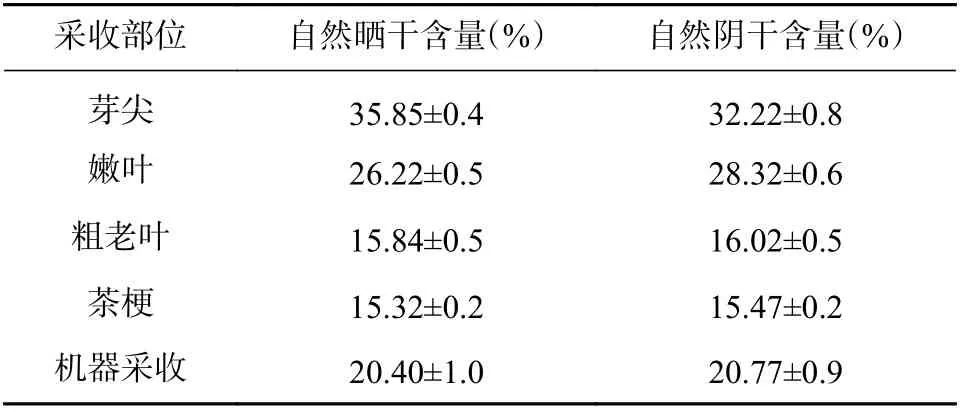
表3 同一采收地点不同部位及加工方式二氢杨梅素含量( ±s ,n =6)
注:1.采收地点为贵州省江口县2号点。2.芽尖部位用自然晒干加工方式其二氢杨梅素含量最高,平均含量为35.85 %。
采收部位 自然晒干含量(%) 自然阴干含量(%)芽尖 35.85±0.4 32.22±0.8嫩叶 26.22±0.5 28.32±0.6粗老叶 15.84±0.5 16.02±0.5茶梗 15.32±0.2 15.47±0.2机器采收 20.40±1.0 20.77±0.9
2.6 样品清咽功效考察
2.6.1 对受试动物一般状态和体重的影响
受试动物精神状态、行为活动、摄食摄水等均未见明显异常。给予复配样品前后,各剂量组大鼠、小鼠的体重与空白对照组比较均无显著性差异。
2.6.2 大鼠棉球植入致炎模型
大鼠低、中、高剂量组分别给予0.38、0.75、2.25 g/kg 复配样品原药材折算浓缩液灌胃,同时设空白对照组0 g/kg。经口给予大鼠复配样品36 d,实验结束前8 d,用脱毛器脱去大鼠两侧腹股沟处的毛,乙醚麻醉大鼠,碘伏消毒,在无菌条件下切开大鼠两侧腹股沟皮肤,植入经高压灭菌并烘干、称重的棉球,缝合切口,继续给予复配样品。实验结束当天,给予复配样品1 h 后,断颈处死大鼠,在原缝合处剪开皮肤,剥离并取出棉球肉芽组织,置于已称重的洁净平皿中,恒温干燥箱60 ℃开盖干燥1 h 后称重,计算肉芽肿净重量。
由表4 可见,经口给予大鼠复配样品36 d 后,与空白对照组比较,中剂量组(0.75 g/kg)和高剂量组(2.25 g/kg)大鼠肉芽肿净量降低,其中,中剂量组具有显著性差异,高剂量组具有极显著性差异,说明该剂量下的复配样品可显著改善大鼠棉球植入致炎率。
2.6.3 小鼠耳肿胀致炎模型
小鼠低、中、高剂量组分别给予0.75、1.50、*P< 0.05,**P< 0.01,与空白对照组比较。4.50 g/kg 复配样品原药材折算浓缩液灌胃,同时设空白对照组0 g/kg。经口给予大鼠复配样品36 d,实验结束当天,吸取二甲苯20 μl,滴加在小鼠右耳外侧面耳郭的中央,让其自由扩散,30 min 后,将小鼠脱颈椎处死,剪下双耳,用9 mm 直径打孔器在两耳相同部位打下耳片并称重,以两耳重量之差为耳郭肿胀值,计算耳郭肿胀率。
表4 大鼠棉球植入实验肉芽肿净量( ±s ,n =12)

表4 大鼠棉球植入实验肉芽肿净量( ±s ,n =12)
组别 给药剂量(g/kg) 肉芽肿(m/mg)空白对照组 0.00 428.2±65.4低剂量组 0.38 392.3±45.3中剂量组 0.75 372.6±58.9*高剂量组 2.25 347.3±20.9**
由表5 可见,经口给予小鼠复配样品36 d 后,各剂量组小鼠耳郭肿胀率与空白对照组比较均有降低,且差异具有统计学意义。
表5 小鼠耳肿胀实验耳郭肿胀率( ±s, n =15)
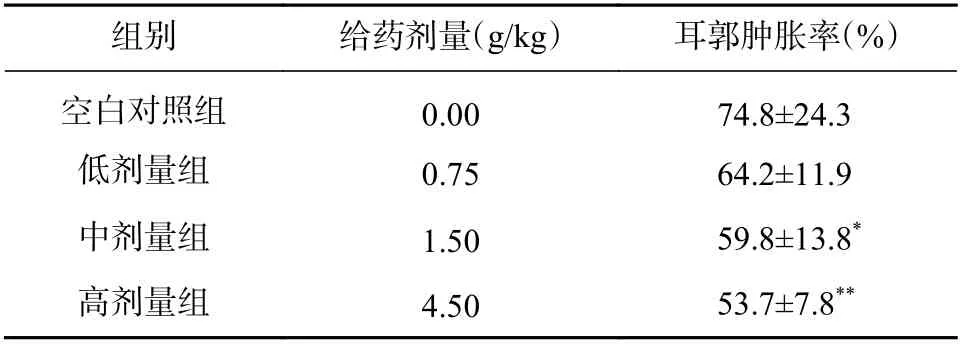
表5 小鼠耳肿胀实验耳郭肿胀率( ±s, n =15)
*P < 0.05,**P < 0.01,与空白对照组比较。
组别 给药剂量(g/kg) 耳郭肿胀率(%)空白对照组 0.00 74.8±24.3低剂量组 0.75 64.2±11.9中剂量组 1.50 59.8±13.8*高剂量组 4.50 53.7±7.8**
3 讨论
本研究考察了湖北、湖南、贵州、福建等不同产地藤茶有效成分二氢杨梅素的含量,采样点所在地为显齿蛇葡萄主产区[8-9],其中种植于贵州省江口县的藤茶无论在不同产地功效成分含量还是同一产地不同植株含量稳定性上都相对较好。藤茶以芽尖嫩叶多为佳,粗老叶、茶梗较多会影响藤茶整体品质和功效。该研究数据可作为企业收购原料参考指标,用于判定藤茶产品中二氢杨梅素的含量情况,为生产及研发提供依据。
经口给予本配伍样品36 d 后,高剂量组大鼠肉芽肿净量及小鼠耳郭肿胀率均显著低于空白对照组。该复配样品对大、小鼠体重增长均无不良影响。据结果判定大鼠棉球植入结果及小鼠耳肿胀治疗效果均呈阳性,可认定该配伍样品具有清咽功能。综上所述,该藤茶及牛蒡子配伍样品在动物致炎模型中发挥了消炎作用。
吸烟、饮酒等不良习惯加大群众患急慢性咽炎的概率,具有清咽功能保健食品的开发需求迫在眉睫[10],本着中医药主张未病先治的理论,笔者将继续对本配伍药效及安全性进行深入研究。

