斑点叉尾鮰病毒实时荧光LAMP检测方法的建立
郝 凯 刘洪岩 陈校辉 袁军法 李莉娟 边文冀 赵 哲
(1. 河海大学海洋学院, 南京 210098; 2. 江苏省淡水水产研究所, 南京 210017; 3. 华中农业大学水产学院, 武汉 430070)
斑点叉尾鮰(Letalurus punetaus), 原产于北美,是一种温水性的淡水养殖鱼类, 1984年引入中国后,养殖面积和总产量不断增加, 目前已在我国20多个省份养殖, 2016年总产量达28.5×107kg, 我国已经成为世界最主要的斑点叉尾鮰养殖国家之一[1]。斑点叉尾鮰病毒(Channel catfish virus, CCV)是一种有囊膜的双链DNA病毒, 又称鮰疱疹病毒Ⅰ型(Ictalurid herpesvirus Ⅰ), 该病毒是鱼类异疱疹病毒科(Alloherpesviridae)中重要的一员, 能够对斑点叉尾鮰鱼苗和鱼种造成致死性感染[2—4]。随着斑点叉尾鮰养殖规模的不断扩大, 集约化程度日益提高,养殖环境恶化, 斑点叉尾鮰病害日趋严重, 特别是由斑点叉尾鮰病毒(CCV)引起的斑点叉尾鮰疱疹病毒病(Channel catfish virus disease, CCVD)危害最大[5,6], 给斑点叉尾鮰养殖业造成严重的经济损失。但是, 目前对其所引起疾病尚无有效的治疗方法, 因此加强对该病早起快速的诊断和筛查, 防止该病在我国的发生、传播和大规模流行十分必要。
目前, 参照世界动物卫生组织(OIE)《水生动物疫病诊断手册》及我国的出入境检验检疫行业标准, CCVD的确诊是基于细胞培养的病毒分离,然后用中和试验、免疫荧光、酶联免疫吸附(ELISA)或PCR鉴定[7—9]。以上方法虽然准确可靠,在实验室检测中广泛应用, 但这些方法存在操作相对复杂、检测成本高及对检测人员较高的技术要求等问题, 限制了它们在斑点叉尾鮰养殖现场推广使用。
环介导等温扩增技术(Loop-mediated isothermal Amplification, LAMP)是一种新型核酸扩增技术, 该技术在保持传统PCR技术优点的基础上, 进一步增强了反应的特异性和缩短了检测时间[10];由于LAMP反应具有简单、快速、高效和经济等特点, 已广泛应用于多种病原微生物的现场化检测[11,12]。对于应用LAMP技术检测CCV, 2015年Liu等[13]的实验室报道了利用凝胶电泳建立了CCV的LAMP检测方法。本研究以CCV磷酸激酶蛋白编码基因ORF77为检测靶标设计特异性的环介导等温扩增引物, 通过实时荧光PCR对CCV进行检测, 建立一种用于CCV快速检测的实时荧光LAMP方法。
1 材料与方法
1.1 材料
CCV感染阳性斑点叉尾鮰样品由江苏省淡水水产研究所提供, 于–80℃保存。白斑综合症病毒(White spot syndrome virus, WSSV)、传染性皮下及造血组织坏死病毒(Infectious hypodermal and hematopoietic necrosis virus, IHHNV)、锦鲤疱疹病毒(Kio herpesvirus, KHV)、真鲷虹彩病毒(Red sea bream iridovirus, RSIV)、传染性脾肾坏死病毒(Infectious spleen and kidney necrosis virus, ISKNV)和新加坡石斑鱼虹彩病毒(Singapore grouper iridovirus, SGIV)的基因组DNA由河海大学大学海洋科学实验中心保存。
1.2 方法
LAMP引物设计: 参照CCV基因组及相关文献资料, 以病毒磷酸激酶蛋白编码基因ORF77保守区域为检测靶位点, 利用在线软件Primer Explorer version4(http://primerexplorer.jp/e)设计6条LAMP引物(表 1)。引物由生工生物工程(上海)股份有限公司合成。
基因组DNA提取: 取CCV感染阳性斑点叉尾鮰的肾脏组织材料置于灭菌后的研钵中, 加入液氮研磨后, 将样品转入含有500 μL PBS无菌离心管中,然后12000 r/min离心5min收集上清用于DNA提取。DNA提取利用海洋动物组织基因组DNA提取试剂盒进行(TIANGEN, 北京), 具体操作步骤参照试剂盒提供的说明书进行。使用微量紫外分光光度计对提取的DNA进行浓度测定。
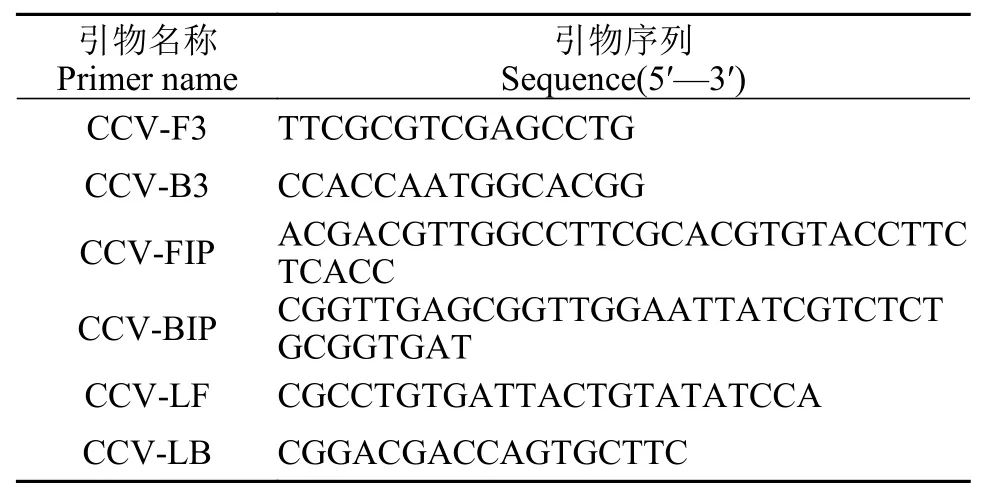
表 1 CCV ORF77实时荧光LAMP扩增引物序列Tab. 1 Primers used for real-time LAMP targeted on ORF77 gene of CCV
重组质粒的构建: 以上述提取的CCV感染阳性DNA为模板, 使用CCV-F3和CCV-B3进行PCR反应, 回收扩增片段与pMD18-T载体连接, 转化DH5α感受态细胞, 构建含有ORF77目的片段的pMD18-T-ORF77重组质粒。用微量紫外分光光度计测定质粒浓度, 计算质粒拷贝数。
实时荧光LAMP反应体系和反应条件: 25 μL的反应体系包括: CCV-F3 0.2 μmol/L、CCV-B3 0.2 μmol/L、CCV-FIP 1.6 μmol/L、CCV-BIP 1.6 μmol/L、CCV-LF 0.8 μmol/L和CCV-LB 0.8 μmol/L,LAMP反应液(10 mmol/L dNTP、10×ThermoPol反应缓冲液和150 mmol/L MgSO4, 三者的体积比为8∶5∶2)12.5 μL, Bst DNA聚合酶10U, 10×SYTO-9 0.5 μL, DNA模板 1—100 ng, ddH2O补齐到25 μL。
实时荧光LAMP反应条件: 63℃ 1min, 共45个循环。利用LightCycler96荧光定量PCR仪(Roche公司)收集荧光信号。
实时荧光LAMP检测的灵敏度试验: 将构建和制备的pMD18-T-ORF77质粒进行8个梯度稀释(108、107、106、105、104、103、102和101copies/μL),每个稀释度样品取1 μL作为模板, 进行实时荧光LAMP检测的灵敏度试验。
实时荧光LAMP检测的特异性试验: 以白斑综合症病毒(WSSV)、传染性皮下及造血组织坏死病毒(IHHNV)、锦鲤疱疹病毒(KHV)、真鲷虹彩病毒(RSIV)、传染性脾肾坏死病毒(ISKNV)和新加坡石斑鱼虹彩病毒(SGIV)的基因组DNA为检测模板进行实时荧光LAMP扩增, 对本研究建立的CCV实时荧光LAMP检测方法的特异性进行测试。
实时荧光LAMP检测的重复性试验: 将构建和制备的pMD18-T-ORF77质粒进行2个梯度稀释, 其浓度分别为105和102copies/μL, 每个稀释度样品取1 μL作为模板, 不同稀释度样品进行20次重复, 对实时荧光LAMP检测的重复性进行测试。
实际样品检测: 用所建立的实时荧光LAMP检测方法对病毒感染的斑点叉尾鮰肾脏组织样品进行检测, 评价建立的实时荧光LAMP检测方法的实际应用性。
2 结果
2.1 实时荧光LAMP检测CCV的灵敏度
将实时荧光LAMP扩增靶位点克隆到pMD18-T载体中, 构建pMD18-T-ORF77质粒, 使用微量紫外分光光度计测定质粒浓度, 计算质粒拷贝数, 并将质粒稀释到108、107、106、105、104、103、102和101copies/μL, 分别以此为模板进行实时荧光LAMP扩增, 在反应大约12min后出现明显的峰值,随着扩增模板的稀释浓度的降低, 出峰时间逐渐延后, 最低能检测到的质粒浓度为102copies/μL, 最晚出峰时间大约在35min(图 1)。
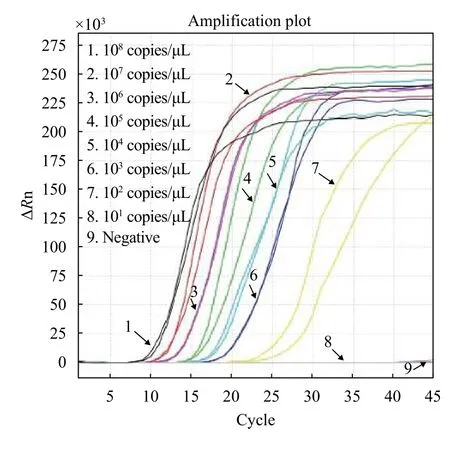
图 1 实时荧光LAMP检测灵敏性Fig. 1 Sensitivity of real-time fluorescent LAMP
2.2 实时荧光LAMP检测CCV的特异性
分别以斑点叉尾鮰疱疹病毒(CCV)、白斑综合症病毒(WSSV)、传染性皮下及造血组织坏死病毒(IHHNV)、锦鲤疱疹病毒(KHV)、真鲷虹彩病毒(RSIV)、传染性脾肾坏死病毒(ISKNV)和新加坡石斑鱼虹彩病毒(SGIV)的基因组DNA为LAMP检测模板, 进行实时荧光LAMP扩增, 检测本研究建立的CCV实时荧光LAMP检测方法的特异性。结果显示本研究建立的实时荧光LAMP检测方法只对CCV阳性基因组出现明显的“S”形扩增曲线, 但对其他6种水生动物病毒DNA均为阴性反应(图 2)。
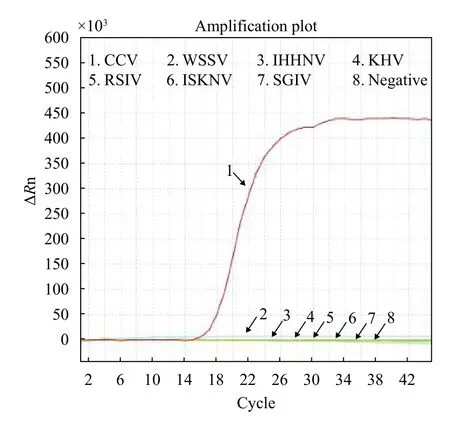
图 2 实时荧光LAMP检测特异性Fig. 2 Specificity of real-time fluorescent LAMP
2.3 实时荧光LAMP检测CCV的重复性
将构建的pMD18-T-ORF77质粒稀释到105和102copies/μL, 分别以此为模板进行实时荧光LAMP扩增, 结果如图 3所示, 在同一次实验内, 同一质粒浓度下, 20个平行样品的扩增曲线基本重合, 分别在反应大约20min和35min出现明显的峰值。

图 3 实时荧光LAMP检测重复性Fig. 3 Repeatability of real-time fluorescent LAMP
2.4 实际样品检测结果
通过对待检实际样品肾脏组织检测结果显示(图 4), 本研究建立的实时荧光LAMP方法对CCV感染的实际样品基因组出现明显的“S”形扩增曲线,对产物进行扩增测序, 显示本研究建立的实时荧光LAMP方法外引物扩增出的产物为靶基因目的片段。
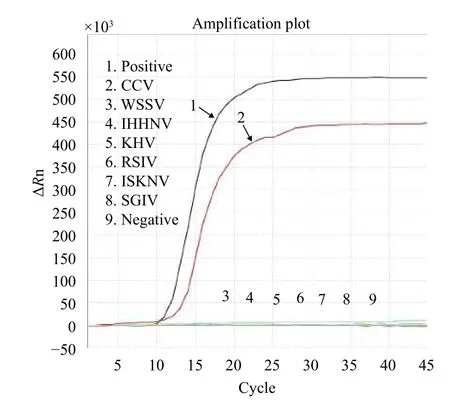
图 4 实际样品实时荧光LAMP检测Fig. 4 Actual samples detection of real-time fluorescent LAMP
3 讨论
由斑点叉尾鮰病毒引起的斑点叉尾鮰疱疹病毒病传染快, 鱼苗、鱼种死亡率可达90%以上。目前对本病尚无有效的药物治疗, 因此加强斑点叉尾鮰苗种和成鱼类检疫对防止该病大规模爆发具有重要意义。PCR方法能对病原微生物的靶基因进行特异性扩增, 因而是对病原物感染进行早期诊断的重要手段之一。目前已有以实时荧光定量PCR技术为依托的CCV检测方法的报道, 因其灵敏度高、特异性好等优点, 在病原体定性及定量检测等方面有着广泛的应用前景[14]。但荧光定量PCR存在检测耗时、操作相对复杂及依赖PCR仪等问题,造成其难以在基层及现场快速诊断中大规模推广应用[15,16]。LAMP是由日本荣研化学株式会社Notomi等[17]在2000年研发出的一种新型的能够在体外进行恒温扩增核酸片段的技术, 该技术根据靶基因序列的6个或8个位置区域, 设计出4种或6种具有特异性的引物, 然后在DNA聚合酶(Bst DNA polymerase)催化作用下恒温持续数10 min, 完成核酸的扩增检测, 不需要复杂的温度循环过程, 与PCR法相比节省了大量的时间、降低了检测成本, 适合于病原微生物的现场快速检测和基层普及应用[18,19]。
CCV基因组中磷酸激酶蛋白编码基因(ORF77)序列与其他鱼类疱疹病毒基因序列相似性较低,本研究建立的实时荧光LAMP检测CCV的方法针对ORF77靶基因保守区域设计了6条引物, 能特异性识别靶基因上的8个独立区域, 在恒温反应35min后即可完成靶基因检测, 最低检测线可达100个DNA拷贝(图 1)。Liu等[13]利用凝胶电泳进行LAMP反应产物的检测, 结果显示其能够检测到10−9稀释的病毒DNA; 本研究建立的实时荧光LAMP检测方法与6种常见水生动物病原DNA均无交叉反应(图 2和图 4); 同一样品于组内或组间重复性试验发现, 在同一DNA浓度下, 20个平行样品的扩增曲线基本重合, 分别在反应大约20min和35min出现明显的峰值(图 3)。因此, 本研究建立的方法具有反应时间短、特异性强、灵敏度高和重复性好的特点。
目前国内外常用的鉴定LAMP反应产物的方法为染料法、浊度法和凝胶电泳法[13,20,21]。本研究建立的实时荧光LAMP方法, 通过实时采集荧光信号对扩增过程进行及时判断, 在保证高敏感性的同时, 使结果形象化和数据化, 不需要繁琐的电泳和紫外观察等过程, 又能避免开盖而导致的污染,比传统的利用染料法、浊度法和凝胶电泳法判断反应终点更加客观可靠[22,23]。同时, 本研究使用SYTO-9作为LAMP反应荧光显色剂, 可以有效避免使用SYBR Green Ⅰ 作为LAMP反应荧光显色剂过于灵敏, 从而造成阴性反应孔出现非特异性扩增曲线, 影响结果判断[13,24]。此外, 本研究建立的方法摆脱了传统检测方法对昂贵仪器设备的依赖, 可使用便携式仪器, 如ESE-Quant tube scanner等进行操作。由于其价格相对便宜, 体积较小, 便于携带, 节约了大量成本, 非常适合水产养殖现场检测使用。
综上所述, 本研究建立的CCV实时荧光LAMP检测方法操作简单、检测快速、特异性好、灵敏度高、结果可靠, 能为斑点叉尾鮰养殖现场和实验室的斑点叉尾鮰疱疹病毒病病原的快速诊断和实时监测方面提供技术支撑。

