miR-133b表达在肝癌发生、发展中作用研究
曹永成, 曹瑞雪, 房 磊, 陈 鑫, 姜贝贝, 张建平, 刘晓红
中国人民解放军联勤保障部队第九六〇医院1.病理科;2.肝胆外科,山东 济南 250031;3.山东第一医科大学第一附属医院 病理科,山东 济南 250014
肝癌是临床较常见的癌症之一,其预后较差,5年存活率极低[1]。结缔组织生长因子(connective tissue growth factor,CTGF)是一种富含半胱氨酸的细胞基质蛋白,具有促进细胞有丝分裂、增殖、粘附、迁移和促进细胞外基质(extracellar matrix,ECM)合成等多种生物学功能,参与体内血管再生、疤痕形成、器官纤维化及肿瘤生长等多种病理生理过程[2-4]。有研究表明,CTGF在肝癌组织中呈高表达,其可促进肝癌实质细胞增殖、迁移、浸润,在肝癌发生、发展中起重要作用[5-6]。miR-133b是miRNA家族成员之一,在胃癌、非小细胞肺癌、结直肠癌中均呈异常低表达状态,参与调控肿瘤发生、发展进程,但其在肝癌中的表达变化情况尚不清楚[7-9]。有研究显示,CTGF是miR-133b靶基因之一,推测miR-133b可能通过调节CTGF表达变化影响肝癌发生、发展[10]。因此,本研究通过分析肝癌组织及细胞中miR-133b表达情况,旨在探讨miR-133b在肝癌发生、发展中的作用。现报道如下。
1 材料与方法
1.1 材料、试剂及仪器 收集2016—2018年经病理证实为肝癌病变组织标本106例纳入肝癌组织组,同时收集其相应癌旁组织(距离癌灶边缘>2 cm)标本纳入癌旁组织组。本研究经医院伦理委员会审批通过,所有标本采集均经患者签署知情同意。细胞株:永生化人正常肝细胞系LO2;人肝癌细胞系HB-611、BEL-7402、Hep3b、SMMC-7721和HepG2细胞。上述细胞株均购自中国科学院上海生命科学研究院细胞资源中心。胎牛血清(美国Gibco公司);DMEM培养基(美国Gibco公司);青霉素(美国HyClone公司);链霉素(美国HyClone公司);miScript Plant PT Kit逆转录试剂盒(德国QIAGEN公司);实时定量聚合酶链式反应(polymerase chain reaction,PCR)反应试剂盒(北京天根公司);CTGF抗体(1∶500稀释,美国Proteintech公司),GAPDH抗体(1∶1 000稀释,美国Proteintech公司);lip2000转染试剂(美国Invitrogen公司);mimic-133b(上海吉玛公司);CCK-8细胞增殖检测试剂盒(北京索莱宝公司);结晶紫染色液(北京索莱宝公司)。ABI PRISM 7500定量PCR扩增仪(美国ABI公司);奥德赛扫膜成像仪(美国Licor公司);酶标仪(美国Bio-rad公司)。
1.2 研究方法
1.2.1 实时定量PCR检测miR-133b表达 四氯化碳法提取肝癌、癌旁组织或肝癌细胞及正常肝细胞的总RNA,检测RNA纯度及完整性。应用miScript Plant PT Kit试剂盒进行miRNA逆转录得到cDNA,然后进行实时定量PCR反应,U6为内参,反应模式为预变性95℃ 5 min;变性95℃ 15 s;退火60℃ 20 s;延伸95℃ 5 s,共40个循环。每个样本和基因同时做3个复孔,输出数据为复孔Ct值的平均值,统计分析时采用2-△△Ct计算法检测miR-133b的相对表达水平。miR-133b的上游引物序列为5′-CTTTGGTCCCCTTCAACCA-3′,下游引物序列为5′-GTGCAGGGTCCGAGGT-3′。U6上游引物序列为5′-CTCGCTTCGGCAGCACA-3′,下游引物序列为5′-ACGCTTCACGAATTTGCGT-3′。引物由Invitrogen公司合成。
1.2.2 免疫印迹法检测CTGF蛋白表达 RIPA组织裂解液提取研磨组织蛋白或RIPA裂解细胞提取细胞总蛋白。采用BCA法进行蛋白定量,每个上样孔的上样量为25 μg,配制电泳凝胶,蛋白变性,十二脘基磺酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrohoresis,SDS PAGE),湿法转膜,PVDF膜于5%牛奶封闭1 h,4℃下一抗(CTGF抗体)孵育过夜,洗膜,荧光二抗室温孵育2 h,洗膜,扫膜成像,取GAPDH为内参。应用Image-Pro Plus 6软件,对图像进行灰度测定,计算各条带与对应GAPDH的灰度比。
1.2.3 细胞培养 于37℃水浴锅中融化冻存管中肝癌细胞,加入适量细胞生长液(5%FBS,0.1 mg/ml链霉素,100 U/ml青霉素,DMEM培养基)悬浮细胞并接种于细胞培养瓶中。于37℃、5%CO2培养箱中培养48 h,细胞融合度为90%时弃去细胞液,加入0.25%胰蛋白酶将贴壁细胞消化为单个细胞,含胎牛血清的DMEM终止消化。加入细胞生长液混匀细胞,以1∶3传代接种于细胞培养板中,37℃、5%CO2培养箱中培养。
1.2.4 细胞转染 体外培养SMMC-7721、HepG2细胞,将处于对数生长期的肝癌细胞接种至细胞培养板,并将其分别随机分为mimic-133b转染组(细胞转染mimic-133b)和mimic-NC转染组(细胞转染mimic-NC)。细胞融合度70%~80%时,换全无DMEM培养基并进行转染。转染后培养4~6 h,更换完全DMEM培养基,培养24 h后收集细胞,进行实时定量PCR检测;培养48 h后收集细胞进行免疫印迹检测。
1.2.5 CCK-8法检测细胞增殖能力 用含10%胎牛血清DMEM培养基调整肝癌细胞浓度为5×104个/ml,按每孔0.1 ml接种至96孔板,并设置调零孔(仅加入细胞生长液,不加细胞),mimic-133b转染组和mimic-NC转染组分别设6个复孔,于37℃,5%CO2培养箱中培养,每2 d换1次液。每孵育24 h后,取出96孔板,显微镜下观察,加入CCK-8试剂,继续孵育1 h后,酶标仪检测A450值,连续测定96 h并记录结果。以培养时间为横坐标,A450值为纵坐标绘制细胞生长曲线。
1.2.6 创伤愈合法检测细胞迁移能力 将肝癌细胞接种于6孔板,分为mimic-133b转染组和mimic-NC转染组,全无DMEM培养基培养4~6 h后,更换完全DMEM培养基。用灭菌后200 μl枪头在孔板中垂直划痕,细胞培养48 h,显微镜下观察划痕愈合情况并拍照。
1.2.7 transwell小室法检测细胞侵袭能力 取对数生长期的肝癌细胞,制备单细胞悬液,应用不含血清的细胞培养基稀释Matrigel基质胶,包被transwell小室上室表面,100 μl无血清培养基稀释细胞悬液并接种于小室下层,加入含10%血清完全培养基后置于含5%CO2的37℃恒温培养箱培养24 h,湿棉签拭去上层小室内的基质胶和细胞,4%多聚甲醛固定,结晶紫染色,晾干,显微镜下观察,选取5个视野计数细胞数目。
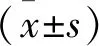
2 结果
2.1 miR-133b在肝癌组织及细胞中表达下降 实时定量PCR检测肝癌及正常癌旁组织中miR-133b的表达情况。结果显示,106例肝癌患者组织中,82例肝癌组织内miR-133b表达水平明显低于正常癌旁组织(P<0.05)。见图1。实时定量PCR检测体外培养HB-611、BEL-7402、Hep3b、SMMC-7721和HepG2等肝癌细胞和LO2正常肝细胞中miR-133b的表达情况。结果显示,HB-611、Hep3b、SMMC-7721和HepG2细胞中miR-133b表达水平较LO2细胞明显降低(P<0.05),BEL-7402细胞中miR-133b表达水平与LO2细胞比较,差异无统计学意义(P>0.05)。见图2。
2.2 mimic-133b可上调肝癌细胞中miR-133b的表达 实时定量PCR检测细胞中miR-133b表达情况。结果显示,mimic-133b转染组细胞miR-133b表达水平显著高于mimic-NC转染组,差异有统计学意义(P<0.05)。见图3。

图1 肝癌与癌旁组织中miR-133b表达情况 图2 多种肝癌细胞株中miR-133b表达情况
2.3 上调miR-133b表达可抑制肝癌细胞增殖 应用CCK-8法检测细胞增殖能力。结果显示,mimic-133b转染组细胞的增殖能力明显低于mimic-NC转染组,差异有统计学意义(P<0.05)。见图4。

图3 肝癌细胞中miR-133b表达情况(a.SMMC-7721细胞;b.HepG2细胞)

图4 上调mimic-133b表达后肝癌细胞增殖情况(a.SMMC-7721细胞;b.HepG2细胞)
2.4 上调miR-133b表达可抑制肝癌细胞迁移 行创伤愈合法检测细胞迁移能力。结果显示,mimic-133b转染组细胞的迁移能力明显弱于mimic-NC转染组,差异有统计学意义(P<0.05)。见图5。

图5 上调miR-133b表达后肝癌细胞的迁移能力(a.SMMC-7721细胞;b.HepG2细胞)
2.5 上调miR-133b表达可抑制肝癌细胞侵袭 采用transwell小室法检测细胞侵袭能力。结果显示,mimic-133b转染组细胞的侵袭能力明显弱于mimic-NC转染组,差异有统计学意义(P<0.05)。见图6。
2.6 上调miR-133b表达可下调肝癌细胞中CTGF表达 应用免疫印迹法检测细胞中CTGF表达情况。结果显示,mimic-133b转染组细胞中CTGF表达水平明显低于mimic-NC转染组,差异有统计学意义(P<0.05)。见图7。

图6 上调miR-133b表达后,肝癌细胞的侵袭能力(a.SMMC-7721细胞;b.HepG2细胞)

图7 上调miR-133b表达后,肝癌细胞中CTGF蛋白表达情况(a.SMMC-7721细胞;b.HepG2细胞)
3 讨论
miR-133b是miRNA家族成员之一,Wong等[11]研究发现,miR-133b在舌癌中表达下调。Crawford等[12]研究发现,miR-133b可通过调控MCL-1和BCL2L2基因表达抑制肺癌细胞增殖,并具有细胞周期阻滞作用。有研究发现,miR-133b可通过靶向调节FSCN1基因抑制肿瘤细胞的生长和侵袭[13]。由此可见,miR-133b参与多种肿瘤性疾病的发生、发展。此外,有研究表明,miR-133b下游靶基因之一为CTGF,而CTGF在肝癌发生、发展过程中发挥重要作用[14-15]。Makino等[6]研究发现,CTGF可激活肝癌细胞附近的肝星状细胞,使其向肝癌细胞传输促增长信号,在肝癌微环境形成中发挥重要作用。Song等[16]研究发现,CTGF可促进Ⅰ型胶原纤维表达,并使其形成球形结构包裹肝癌细胞,降低抗癌治疗效果。miR-133b可否通过影响CTGF表达而参与肝癌的发生发展,目前尚无相关报道。
本研究通过临床收集肝癌和癌旁组织,分析其miR-133b表达差异,发现肝癌组织中miR-133b表达明显低于癌旁组织。BEL-7402细胞中miR-133b表达较正常肝细胞LO2无明显差异,这可能由于在细胞系构建过程中存在某些影响因素。但多数肝癌细胞株,如HB-611、Hep3b、SMMC-7721及HepG2细胞中miR-133b表达均明显低于正常肝细胞LO2。这提示,miR-133b可能参与肝癌发生、发展过程。本研究发现,miR-133b在肝癌组织及细胞中表达下降,提示其可能参与肝癌的发生、发展。进一步上调肝癌细胞系SMMC-7721及HepG2细胞内miR-133b表达后,SMMC-7721及HepG2细胞的增殖、迁移及侵袭能力减弱。这表明,miR-133b可通过影响肝癌细胞的增殖、迁移、侵袭等生物学行为调控肝癌的发生、发展。随后上调SMMC-7721及HepG2细胞中miR-133b表达观察CTGF表达情况,发现miR-133b表达上调后,SMMC-7721及HepG2细胞中CTGF表达下降。这提示,miR-133b可能通过调控CTGF表达影响肝癌细胞生物学行为。
综上所述,miR-133b可能通过下调CTGF表达来抑制肝癌细胞的增殖、迁移、侵袭等,进而抑制肝癌的发生、发展。miR-133b有望成为临床上治疗肝癌的分子靶点之一。

