糖尿病肾病患者血清人巨细胞病毒miR-US4-3p水平变化及价值*
王萍萍,王成,王静,张明超,张春妮,张辰宇,汪俊军(.南方医科大学第一临床医学院&东部战区总医院临床检验科,南京000;.东部战区总医院国家肾脏疾病临床医学研究中心全军肾脏病研究所,南京000;.南京大学生命科学学院,南京0046)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetic mellitus,DM)晚期主要微血管并发症,也是终末期肾病的主要病因[1],但其发病机制尚不明确。人巨细胞病毒(human cytomegalovirus,HCMV)是一种具有囊膜包被的线性双链DNA病毒,其基因组大小为220~240 kb,可在新生儿和免疫功能低下的个体中引起较高的发病率和死亡率,是目前发现的唯一可产生miRNA的β疱疹病毒,HCMV能够编码26个成熟miRNA[2]。越来越多的证据显示,HCMV编码的miRNA可调节各种生物过程,包括病毒复制、潜伏感染、免疫逃逸和宿主细胞周期[3-5]。有报道显示,原发性高血压患者血浆中hcmv-miR-UL112表达较健康对照者明显上调,提示HCMV编码miRNA可能是介导HCMV感染导致血管损伤和血压升高的关键因子[6]。在2型糖尿病(T2DM)、胶质母细胞瘤及口腔扁平苔藓患者外周血中也观察到HCMV miRNA的高表达[7-8],提示循环中HCMV编码miRNA是一类潜在的新型疾病生物标志物。研究证实,HCMV miR-US4-3p靶向内质网氨肽酶ERAP1,ERAP1功能的变化或丧失会改变组织相容性复合体(MHC)Ⅰ分子呈递的抗原组成从而影响NK细胞和CD8+T细胞的激活,导致免疫应答缺陷和疾病的发生[9-10]。DN的发生发展与炎症和免疫反应有关[11],我们推测miR-US4-3p与DN之间可能存在关联,目前关于miR-US4-3p在DN患者中的表达变化及其临床价值研究未见报道。因此,本研究通过qRT-PCR方法检测DN患者、单纯DM患者和健康对照者中血清miR-US4-3p的表达,以探讨其在DN中的潜在临床价值。
1 资料与方法
1.1 一般资料 收集2019年4月至2020年1月于中国人民解放军东部战区总医院(原南京军区总医院)确诊的T2DM患者128例,所有患者均符合T2DM诊断标准[12]。其中T2DM患者(DM组)64例,DN患者(DN组)64例。DM组男性48例,女性16例,年龄(55.92±17.46)岁,DM病程[3(0.08,7)]年;DN组男性42例,女性22例,年龄(55.78±11.88)岁,DM病程[10(5,16)]年。DN诊断标准患者符合下列任何一项者:①大量清蛋白尿;②糖尿病视网膜病变伴微量蛋白尿;③肾脏穿刺活检符合DN病理表现,即诊断为DN[13]。选取同期健康体检者64例作为对照组,男性42例,女性22例,平均年龄(53.20±10.74)岁。排除标准为:其他急慢性肾病、继发性糖尿病、心脏与肝脏等全身疾病引发的肾脏疾病、创伤、急性感染、恶性肿瘤和自身免疫病者。各组性别、年龄差异无统计学意义(P>0.05)。本研究获中国人民解放军东部战区总医院伦理委员会批准许可(批准文号:2018NZGKJ-096),研究对象均签署了知情同意书。
1.2 主要仪器与试剂 D10糖化血红蛋白检测仪(美国Bio-Rad公司);7600型全自动生化分析仪(日本Hitachi公司);Cobas e601型全自动电化学发光免疫分析仪(瑞士Roche公司);5418型高速冷冻离心机(德国Eppendorf公司);SAS67120型超纯水仪(美国Millipore公司);2720型PCR仪(美国ABI公司);LightCycler®96实时荧光定量PCR仪(瑞士Roche公司)。
RNA提取试剂即酸性水饱和酚(北京索莱宝公司);分析纯级氯仿、异丙醇、无水乙醇(上海国药集团试剂公司);人工合成的peu-MIR2911成熟体(上海Invitrogen公司);miRNA逆转录引物及Taq-Man探针(美国ABI公司)(peu-miR2911货号:242025_mat;hcmv-miR-US4-3p货号:469699_mat);逆转录体系和qRT-PCR体系所用试剂(大连TaKa-Ra公司);总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)试剂及校准品购自英国Randox公司;低密度脂蛋白胆固醇(low density lipoproteincholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)试剂及校准品购自日本第一化学株式会社;糖化血红蛋白(Hemoglobin A1c,HbA1c)检测试剂盒购自美国Bio-Rad公司;半胱氨酸蛋白酶抑制剂C(Cystatin C,Cys C)检测试剂盒购自宁波普瑞柏生物技术公司;空腹血糖(FPG)检测试剂盒购自富士胶片和光纯耀(上海)化学公司;肌酐(creatinine,Cr)检测试剂盒购自四川maccura生物公司;甲状旁腺激素(parathyroid hormone,PTH)试剂及校准品购自瑞士Roche公司。
1.3 实验方法
1.3.1 标本采集与处理 采集研究对象清晨空腹状态下静脉血3~5 mL,离心后获取上层血清液,于-80℃保存,用于miRNA和生化指标的检测。
1.3.2 血清HCMV miRNA表达的检测 基于Taq-Man探针的qRT-PCR方法检测血清miR-US4-3p(5′-UGACAGCCCGCUACACCUCU-3′)的 水 平。首先,取单个血清样本100μL,总RNA提取采用酸性苯酚-氯仿一步法进行抽提[14],每个血清样品在提取过程中均加入20μL人工合成的浓度为107fmol/L的植物MIR2911(5′-GGCCGGGGGACGGGC UGGGA-3′)成熟体作为外源性参照,用于校正RNA提取效率和误差,提取后的总RNA溶于22μL DEPC水。
血清RNA逆转录PCR反应体系为10μL:DEPC水3.5μL、5×AMV缓冲液2μL、dNTPs 1 μL、逆转录引物1μL、AMV逆转录酶0.5μL、RNA样品2.0μL。反应条件参数为:16℃30 min;42℃30 min;85℃5 min,每个反应均为1个循环。逆转录所得cDNA冻存于-20℃。
qRT-PCR反应体系为20μL:ddH2O 14.77μL、10×PCR缓冲液2μL、25 mmol/L MgCl21.2μL、dNTPs 0.4μL、Taq聚合酶0.3μL、miRNA检测探针0.33μL、cDNA 1μL。反应条件参数为:95℃5 min,1个循环;95℃15 s,60℃1 min,共40个循环。
实验结果采用2-ΔCt方式计算miR-US4-3p的相对表达量,ΔCt=Ct目的miRNA-CtMIR2911。每个Ct值为相应样品重复测定3次后所得均值,同时以不含RNA的模板的ddH2O水作为阴性对照。
1.4 统计学分析 采用SPSS20.0软件对数据进行统计学分析。计量资料采用单样本Kolmogorov-Smirnov检验数据分布的正态性。正态分布资料采用均数±标准差(±s)表示,两组间比较采用两独立样本的t检验;多组间比较采用单因素方差分析,方差齐性时组间两两比较采用LSD-t检验,方差非齐性时采用Tamhane′s T2检验。非正态分布资料采用中位数(第25百分位数,第75百分位数)[M(P25,P75)]表示,两组间比较采用Mann-Whitney U检验,多组间比较采用Kruskal-wallis H秩和检验。计数资料采用百分比表示,两组间比较采用χ2检验。变量间相关性分析采用Spearman相关分析。采用ROC曲线和Logistic回归分析血清miR-US4-3p水平对DN预测和区分价值。以P<0.05为差异有统计学意义。
2 结果
2.1 研究对象的一般资料 对DN、DM和对照组患者的一般资料进行单因素方差分析,结果显示,3组患者的DM病程、HbA1c、FPG、TG、LDL-C、HDL-C、Cr和Cys C差异均有统计学意义(P均<0.05)。对差异有统计学意义的指标进行两两比较,结果显示DN组和对照组间,HbA1c、FPG、TG、LDL-C、HDL-C和Cre差异均有统计学意义(P均<0.05)。DN组与DM组相比,糖尿病病程、HbA1c、LDL-C、Cre和Cys C差异均有统计学意义(P均<0.05)。DM组与对照组相比,HbA1c、FPG、TG、HDL-C差异均有统计学意义(P均<0.05)。而各组研究对象性别、年龄等比较差异均无统计学意义(P均>0.05)。见表1。

表1 3组研究对象临床基本资料比较
2.2 各组血清miR-US4-3p表达水平比较 qRT- PCR结果显示,与对照组及DM组相比,DN组患者血清miR-US4-3p的表达水平升高(P<0.001),而DM组与对照组比较差异无统计学意义(P>0.05)。见表2。

表2 各组血清miR-US4-3p表达水平比较
2.3 血清miR-US4-3p与DN患者临床指标之间的相关性分析 Spearman相关性分析显示,DN患者血清miR-US4-3p与Cys C(r=0.288,P=0.023)、PTH(r=0.493,P=0.045)呈正相关,与eGFR呈负相关(r=-0.280,P=0.026),而与HbA1c(r=-0.127,P=0.342)、FPG(r=0.028,P=0.826)、TG(r=0.032,P=0.803)、TC(r=0.135,P=0.288)、LDL-C(r=0.062,P=0.629)、HDL-C(r=-0.103,P=0.468)、Cr(r=0.245,P=0.053)、糖尿病病程(r=-0.053,P=0.699)不相关。
2.4 血清miR-US4-3p对DN的预测及区分价值 ROC曲线分析显示,miR-US4-3p能够较好区分DN患者和健康对照者,其ROC曲线下面积(areas under the ROC curve,AUC)为0.792(95%CI:0.715~0.869),见图1A。当cut-off值为0.011时,miR-US4-3p诊断DN的敏感性为71.9%,特异性为73.4%。此外,miR-US4-3p在鉴别DM和DN的AUC为0.748(95%CI:0.664~0.832),见图1B。在cut-off值为0.012时,其敏感性为71.9%,特异性为64.1%。

图1 miR-US4-3p对DN预测和区分的ROC曲线
Logistic回归单因素模型中仅纳入血清miRUS4-3p分析,结果显示:以对照组为参考类别,高血清miR-US4-3p水平与DN的发生相关(OR=7.065,95%CI=3.247~15.376,P<0.001);以DM组为参考类别,血清miR-US4-3p水平的升高还可区分DN和DM(OR=4.879,95%CI=2.304~10.332,P<0.001)。多因素模型中除了纳入血清miR-US4-3p外,还同时纳入年龄、性别及血脂指标(TG、TC、LDL-C、HDL-C),结果显示,在校正年龄、性别及其他血脂水平影响后,血清miR-US4-3p水平的升高仍与DN的发生密切相关(OR=7.236,95%CI=2.633~19.889,P<0.001),对DN和DM的区分仍具有统计学意义(OR=6.466,95%CI=2.778~15.052,P<0.001)。见表3。
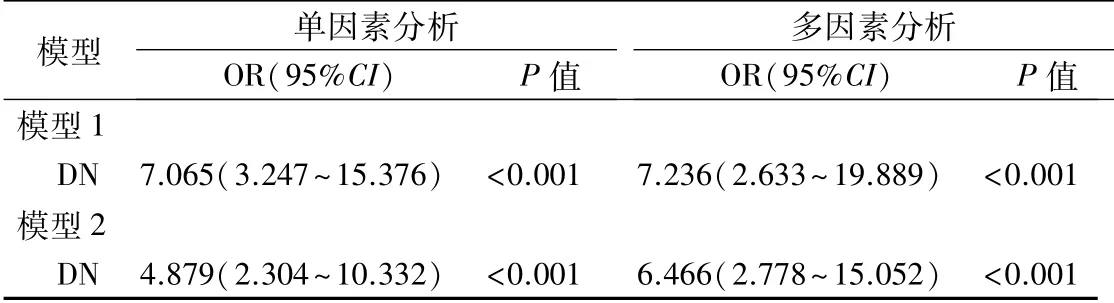
表3 多因素Logistic回归分析血清miR-US4-3p水平对DN的预测及区分价值
3 讨论
DN约占DM患者的40%,但其发病机制尚未明确。既往研究已证实,多种miRNAs参与肾小管上皮细胞氧化应激反应、糖代谢紊乱、肾纤维化、系膜细胞肥大的病理过程[15]。病原微生物与人类疾病的关系日益受到重视,诸多证据表明HCMV感染与炎症反应激活、血管重塑相关,HCMV利用自身编码的miRNAs调节自身及宿主细胞的基因差异表达可进一步完成免疫逃避、细胞进程调节、病毒DNA复制以及对细胞凋亡的调节功能。HCMV miRNAs的研究可为进一步了解病毒致病机制和宿主防御机制提供线索。Pan等[16]研究表明,血清HCMV miR-US4-1可作为预测干扰素α治疗慢性乙型肝炎患者疗效新的生物标志物,提示检测HCMV miRNA的变化在疾病中具有重要意义。然而,HCMV miRNA与DN之间的联系尚未得到阐明。本研究发现,DN患者血清HCMV miR-US4-3p的表达显著高于健康人群和DM患者,而DM患者与健康人群间的表达差异无统计学意义,进一步多因素Logistic回归分析显示,在校正了年龄、性别、其他血脂指标影响后,血清高miR-US4-3p是DN发生的危险指标,且对DN和DM患者的鉴别具有意义,提示血清miR-US4-3p有望成为DN发病的辅助诊断指标及DN与DM间潜在的鉴别指标。
研究显示,免疫及炎症反应在DN发病机制中发 挥 重 要 作 用[11]。Kim 等[9]报 道,HCMV miR-US4-1可调控ERAP1 mRNA的翻译水平,从而极大地降低抗原的呈递,逃逸宿主对其的监控和免疫。Huang等[5]研究表明,hcmv-miR-UL112通过下调Ⅰ型IFN信号传导抑制NK细胞的细胞毒性来破坏先天免疫,表明HCMV可以利用基于miRNA的免疫逃逸机制。既往研究证实,HCMV感染导致细胞转录因子NF-κB的激活[17],而高血糖导致糖基化终产物增多,可通过NF-κB信号通路诱导巨噬细胞迁移并释放炎症细胞因子TNF-α及IL-1β,NF-κB活化可刺激趋化因子和黏附分子的转录。近年来研究证实内皮功能障碍对肾小球疾病的发生、发展有着重要影响,肾小球内皮细胞通过与系膜细胞及足细胞的交流可进一步促进DN发展。Shen等[18]研究发现,HCMV miR-UL112可通过丝裂原活化蛋白激酶信号通路、细胞黏附分子、趋化因子信号通路、细胞因子-细胞因子受体相互作用等途径诱导血管细胞(如内皮细胞、平滑肌细胞)功能障碍,导致血管损伤;miR-UL112还可通过调控ACE2基因在肾脏中的表达,影响肾素血管紧张素系统从而调控机体血压水平[19]。因此,我们推测miR-US4-3p可能参与调节DN的免疫逃避及炎症反应进程,并通过诱导血管内皮功能障碍,使足细胞、系膜细胞发生改变,进一步加重DN发展。本研究中相关分析证实血清miR-US4-3p的表达与Cys C、PTH显著正相关,Cys C不受性别、年龄等因素影响,并且肾脏是其唯一清除器官,能够灵敏反映肾脏损伤程度[20];DN时由于患者肾小球通透性增强,血钙丢失刺激PTH分泌增多,因此PTH的检测也可作为判定早期肾脏损伤的预警指标之一。以上研究均提示miR-US4-3p参与DN发展进程。
研究发现,细胞外囊泡(EVs)中富含miRNA,并能保护其不被降解[21]。越来越多的证据表明,EVs通过细胞与细胞之间的交流在病毒感染中起着重要作用。已经发现病毒感染可以改变宿主细胞中EVs miRNA的表达,Zhang等[2]通过深度测序分析人类胚胎肺成纤维细胞(HELF)中EVs miRNA发现,EVs中miR-US25-1-5p和miR-UL112-3p在感染后6 h水平升高,HCMV感染婴儿血清EVs miR-US25-1-5p和miR-UL112-3p的水平与肝损害密切相关。从Zhang等[2]结果中发现,感染细胞可释放更多的EVs,HCMV miRNA可以通过EVs转运至受体细胞发挥作用。Ding等[22]发现,在HCMV潜伏期,口腔扁平苔藓病患者血浆样本中hcmv-miR-UL59大多数以外泌体形式存在。因此,可以推测HCMV miRNA的变化也可能是由病毒感染或炎症细胞分泌的EVs引起。但是,各种疾病中HCMV miRNA的存在形式仍需进一步验证,HCMV感染与EVs miRNA之间的具体机制仍然未知。
综上所述,血清HCMV miR-US4-3p在DN中高表达,其可能是DM患者肾脏损伤的重要生物学标志物,但血清miR-US4-3p与微量尿蛋白指标的比较以及其在DN发生发展过程中的具体病理生理机制仍需深入研究。鉴于本研究例数有限,仍需要进一步扩大样本量、开展前瞻性研究及临床随访再次验证和确定血清HCMV miR-US4-3p对DN患者的临床价值。

