GADD45A与肿瘤治疗
胡晓红,杨力芳,李 丹*
(1.湖南大学生物学院,中国湖南长沙410082;2.中南大学肿瘤研究所,中国湖南长沙410008)
美国癌症学会在线发表的《2018年全球癌症统计数据》指出,我国癌症发病率、死亡率均居全球第一[1]。显然,癌症已成为威胁我国国民生命健康的一大因素。肿瘤的发生发展是一个复杂的过程,其中DNA损伤修复机制的缺陷与之密切相关。肿瘤抑制因子P53及其调控的DNA损伤修复蛋白,在多种生物学功能中发挥关键作用。
生长阻滞和DNA损伤基因45A(growth arrest and DNA damage-inducible 45A,GADD45A)是第1个被发现的经由P53激活的应激诱导基因,又名GADD45或DDIT1,位于人染色体1p31.1~31.2[2],共有3个转录本,大小分别为135 2 bp、125 0 bp和111 4 bp。其编码的生长阻滞与DNA损伤诱导蛋白GADD45α的相对分子质量为18.4 kD,主要定位于细胞核,与 GADD45β、GADD45γ、GADD34、GADD153共同构成GADD家族[3]。大量研究表明,GADD45A可以诱导DNA损伤修复[4~5]、细胞接触抑制[6]、细胞周期阻滞[7]、细胞凋亡和衰老[8],抑制肿瘤转移[9]、血管形成[10]和自噬[11]。GADD45A 不仅与基因组的稳定性有关,而且与肿瘤的发生发展关系密切,并在肿瘤治疗中发挥着不同甚至相反的作用。
1 GADD45A在肿瘤发生发展中的作用机制
文献显示,与正常组织相比,GADD45A在多种肿瘤(结直肠癌[5,12]、乳腺癌[13]、膀胱癌[14]、宫颈癌[15]等)中的表达水平均有不同程度的下调。相反,GADD45A表达高的食道癌病人的整体生存率明显升高[16]。
研究表明,GADD45A响应紫外线辐射信号从而调节核苷酸切除DNA修复,是保护表皮免受紫外线诱导形成皮肤肿瘤的关键因素[4]。P53蛋白与DNA聚合酶β作用可激活GADD45A的转录,增强其与增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)的相互作用,形成无嘧啶核酸内切酶1/氧化还原因子1(apyrimidinic endonuclease 1/redox factor 1,APE1/Ref1)-GADD45α-PCNA蛋白复合物并定位于人结肠癌细胞的细胞核,从而促进碱基切除修复[5]。在P53功能正常的情况下,GADD45α减少细胞周期蛋白cyclin B1的核水平,并通过改变亚细胞定位来抑制Cdc2激酶活性,诱导细胞周期G2/M阻滞和生长抑制[7]。已有研究报道,GADD45A通过增强β连环素(βcatenin)与小窝蛋白1(caveolin-1)的相互作用,诱导β-catenin从胞核和胞质易位至细胞膜而增强其稳定性,以维持细胞间黏附/接触抑制,抑制肿瘤的发生[6,17]。在Ras蛋白驱动的乳腺癌中,GADD45A可以激活c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)通路,促进癌细胞的凋亡;同时,其也可以激活P38,促进乳腺癌细胞的衰老[8]。在髓母细胞瘤细胞中过表达GADD45A,可上调P53的表达,进而经基质金属蛋白酶-9(matrix metallopeptidase-9,MMP-9)抑制肿瘤细胞转移[9]。过表达GADD45A可以破坏哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)与信号转导及转录活化因子3(signal transducer and activator of transcription 3,STAT3)的联系,抑制STAT3的磷酸化,并导致血管内皮生长因子α(vascular endothelial growth factor alpha,VEGFα)的表达下调,进而抑制宫颈癌细胞血管形成[10]。此外,GADD45A通过与Beclin1相互作用,破坏Beclin1-PIK3C3(phosphatidylinositol 3-kinase,catalytic subunit type 3)复合物,损坏自噬起始复合物的形成,进而抑制食管癌细胞自噬[11]。GADD45A在上述恶性肿瘤中涉及的主要生物学功能如表1所示,发挥这些生物学功能所涉及的信号通路如图1所示。
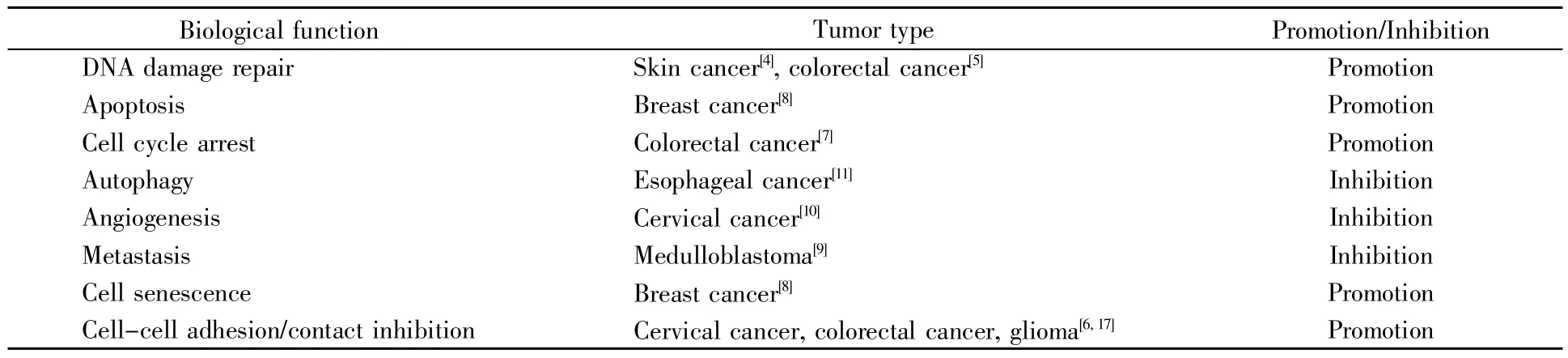
表1 GADD45A在肿瘤进展中的作用Table 1 The role of GADD45A in tumor progression
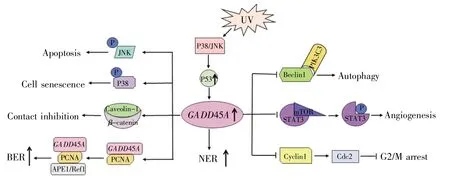
图1 GADD45A在肿瘤发生发展中的作用机制NER:核苷酸切除修复;BER:碱基切除修复。Fig.1 Mechanism of GADD45A in tumorigenesisNER:Nucleotide excision repair;BER:Base excision repair.
2 GADD45A在肿瘤化学治疗中的作用
2.1 GADD45A与化疗药物
化疗药物主要通过影响肿瘤细胞的基因表达或者信号通路,使肿瘤细胞受到抑制或致死,以达到治疗肿瘤的效果。研究表明,GADD45A可能是多种化疗药物的作用靶点之一。非甾体类抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)能够诱导黑色素瘤、卵巢癌、血癌细胞表达黑色素瘤分化相关基因-7/白细胞介素-24(melanoma differentiation associated gene-7/interleukin-24,MDA-7/IL-24),激活GADD45A及下游促分裂原活化的蛋白激酶(mitogen-activated protein kinase,M-APK)/JNK以促发凋亡,同时抑制Cdc2-cyclin B检查点激酶以激发生长阻滞[18~20]。5-氟尿嘧啶(5-fluorouracil,5-FU)治疗可使结肠癌细胞S期阻滞,P53积累,同时上调GADD45A并通过FAS途径诱导凋亡[21~22]。在人结肠癌细胞中,黄芩素诱导孕酮和GADD45A的上调,促进MAPK的激活,并在GADD45A和JNK/P38之间形成正反馈环,从而引起肿瘤细胞明显的凋亡反应[12]。黄连素激活P53及其与线粒体Bax和Bim相互作用的下游靶标GADD45α,诱导B细胞淋巴瘤细胞凋亡[23]。穿心莲中分离出的14-脱氧-11,12-二脱氢穿心莲内酯(14-deoxy-11,12-didehydroandrographolide,14-DDA)可诱导内质网液泡和自噬体的形成,激活GADD45A,并通过GADD45A/P38 MAPK/DDIT3通路诱导乳腺癌细胞发生自噬而死亡[24]。
在一些优化的化疗药物中,GADD45A也显示出其作为治疗靶点的潜在可能性。顺铂类似物PN149可有效规避顺铂耐药性,提高P53水平,上调GADD45A,诱导凋亡和细胞周期阻滞,提高肿瘤治疗效果[25]。滔罗定(taurolidine,TRD)能够降低肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor related apoptosis-inducing ligand,TRAIL)的毒性和剂量,上调GADD45A,触发食道癌细胞凋亡[26]。具有抗癌作用的绿茶儿茶素与抗癌药物(如他莫昔芬、COX-2抑制剂和维甲酸等)联用,可以增加GADD45α的表达,诱导癌细胞凋亡[27]。拓扑异构酶Ⅱα抑制剂视黄酸B(retigeric acid B,RB)可激活 ATM(ataxia telangiectasia mutated)、ATR(ataxia telangiectasia and RAD3),并进一步通过激活其下游P53的表达上调GADD45A,最终诱导细胞凋亡[28]。砷(As)作为一种用于急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)和多发性骨髓瘤(multiple myeloma,MM)的有效化学治疗剂,在肝癌中可通过触发GADD45A活化JNKs/AP-1细胞死亡途径,有效诱导癌细胞凋亡,而对于正常肝细胞的毒害作用很小[29]。庆大霉素是常用的抗微生物剂,其可通过上调GADD45A抑制胃癌细胞增殖,诱发细胞凋亡[30]。
2.2 GADD45A与肿瘤细胞耐药性
化学疗法是治疗癌症的有效手段之一,但癌细胞可以同时对多种药物产生抗药性,甚至是对新的药物都有耐药性,这严重阻碍了化学疗法的有效性[31]。现有研究显示,GADD45A基因同样展现出了其在肿瘤耐药性中的作用,有望为癌症化疗耐药的预防提供新靶标。
在肺鳞癌患者中,顺铂治疗导致lncRNA SFTA1P呈现高表达,并通过上调hnRNP U-GADD-45A轴来增强凋亡,进而增高癌细胞的药物敏感性[32]。Chk1抑制剂可通过抑制ATR/Chk1诱导GADD45A的表达,从而有效地触发高危髓母细胞瘤(c-Myc高表达)的死亡,因此靶向ATR/Chk1可有效地增强顺铂的抗癌功效,并且在非癌性神经元细胞中具有良好的耐受性[33]。在胆管癌细胞中敲除高表达的S100P基因可上调GADD45A,抑制细胞的增殖,促进细胞周期阻滞,增加化疗药物敏感性[34]。在淋巴瘤细胞中沉默PKCη基因可诱导GADD45A表达升高,激活P38,进而促进细胞周期阻滞,使细胞对化疗药物敏感[35]。雌二醇通过激活长期雌激素剥夺(long-term estrogen deprivation,LTED)乳腺癌细胞的AMP活化蛋白激酶(AMP activated protein kinase,AMPK),上调FOXO3的靶基因Bim、FasL和GADD45A,介导凋亡和G2/M期阻滞;相反,雌二醇抑制野生型乳腺癌细胞AMPK的激活,并阻止细胞的凋亡,最终提高雌激素依赖的乳腺癌细胞对雌二醇的敏感性[36]。分泌簇蛋白(secretory clusterin,sCLU)在肝癌组织中过表达导致总生存率差、耐药性高,而过表达GADD45A可通过影响Akt激酶的磷酸化水平调控线粒体凋亡,克服细胞耐药性[37]。尽管在多种癌症中过表达GADD45A可以明显提高细胞的药物敏感性,但也有研究显示GADD45A可以保护黑色素瘤细胞和胶质瘤细胞免受化疗药物毒性[38~39],这体现了GADD45A功能的复杂性。
2.3 GADD45A与靶向表观遗传的小分子药物
肿瘤细胞的致癌作用不仅与遗传改变有关,还涉及表观遗传修饰改变,例如DNA甲基化、组蛋白修饰和非编码RNA表达,从而使其逃避化学疗法和宿主免疫监视。越来越多的证据表明,由表观遗传变化控制的基因表达对癌症的发生和进展也至关重要[40~41],因而可以使用小分子药物靶向表观遗传酶和调节蛋白,使其成为肿瘤治疗干预的良好靶标[42~44]。
研究表明,GADD45α是一种参与维持基因组稳定性、DNA修复和抑制细胞生长的核蛋白[45~46],通过促进DNA修复来缓解表观遗传基因沉默,从而使整体DNA脱甲基[47]。葡萄糖剥夺可以上调DNA甲基化沉默的GADD45A的表达,为癌症治疗提供了新的策略[48]。DNA甲基化酶(DNA methylase,DNMT)抑制剂地西他滨处理细胞能够激活GADD45A的表达,诱导基因组DNA脱甲基[49~50],而PRIMA-1(P53 reactivation and induction of massive apoptosis)通过抑制DNMT及上调GADD45A的表达,诱导P53突变型癌细胞发生整体DNA的脱甲基[51],最终诱导癌细胞对抗肿瘤药物的敏化作用[49~51]。相关研究报道,地西他滨联合相应小分子抑制剂能够调控细胞周期相关基因GADD45A和CDKIN1A的表达,上调MEK/ERK、JAK-STAT和NF-κB,增加脱甲基效率,抑制霍奇金淋巴瘤细胞生长,提高地西他滨的治疗效果[52]。
此外,GADD45A也被证明在一些靶向组蛋白修饰酶的小分子药物的作用通路中发挥作用。组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)PCI-24781处理骨肿瘤细胞使乙酰化组蛋白积累,诱导GADD45A表达,激发凋亡,逆转细胞耐药性,使其对化疗药物更加敏感[53~54]。曲古菌素(trichostatin A,TSA)是一种特异的组蛋白去乙酰化酶类型Ⅰ和Ⅱ抑制剂,通过ATM介导的通路诱导GADD45A表达,导致肿瘤细胞凋亡[55~56]。小分子药物LBH589则通过组蛋白(H3K9和H4K8)的乙酰化上调GADD45A,诱导细胞周期停滞和凋亡[57]。我们课题组也发现,新型组蛋白去乙酰化酶抑制剂PXD101能够显著抑制胶质瘤细胞的增殖、转移,促进凋亡,而进一步的机制研究显示GADD45A是其发挥抑瘤作用的重要靶标(数据尚未发表)。
3 GADD45A在肿瘤放射治疗中的作用
电离辐射(ionizing radiation,IR)治疗也是癌症患者常用的治疗方法之一[58],不仅有助于局部控制目标病灶,而且还可以控制远端的转移灶[59]。IR治疗的临床功效归因于其诱导DNA损伤导致直接的肿瘤细胞死亡[60]。无论放射敏感还是放射抵抗的肿瘤,探究使肿瘤细胞对IR敏感的分子和机制可以为癌症治疗提供新的分子靶标。
众所周知,正常细胞通过葡萄糖氧化提供能量,而癌细胞则通过瓦博格效应(Warburg effect)改变自身的遗传和表观状态,从而促进癌细胞的生长和侵袭[61]。研究发现,用糖酵解抑制剂2-脱氧-D-葡萄糖(2-deoxy-D-glucose,2-DG)预处理癌细胞,经IR处理后可激活GADD45A的表达,诱发细胞死亡[62]。在人舌鳞状细胞癌中,IR可以诱导癌细胞表达GADD45A,增加癌细胞对IR的敏感性[63]。对于髓母细胞瘤,IR处理可以激发肿瘤细胞GADD45A的表达,促进细胞周期的阻滞,还可以下调MMP-9,抑制肿瘤转移,使髓母细胞瘤细胞对放射治疗敏感[9]。在宫颈癌细胞中,GADD45A通过抑制内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS),进一步抑制NO调节APE1的胞质定位,从而增强宫颈癌细胞的放射敏感性;相反,GADD45A表达的降低显著促进放射抵抗的发展[15]。对于一些具有放射抵抗的癌症,例如胰腺癌,放射增敏剂DPS(darinaparsin)结合放射线治疗能激发GADD45A表达,同时保护正常肠隐窝上皮细胞,诱导癌细胞在G1/S和G2/M发生细胞周期阻滞[64]。胶毒素(gliotoxin)结合放射治疗可抑制GADD45A-P38-NF-κB介导的生存途径,激发肝癌细胞凋亡,从而提高放疗效果[65]。此外,肿瘤周围微环境中的癌症相关成纤维细胞及癌细胞之间的串扰可降低GADD45α水平,进而抵抗放射治疗[66]。
4 总结与展望
综上所述,作为一个细胞生长阻滞和DNA损伤调节基因,GADD45A参与了调控细胞周期、细胞凋亡、DNA损伤修复、自噬、信号转导等多种生物学过程,在维持基因组稳定性和抑制肿瘤发生发展的过程中发挥重要的作用。正如表2和图2所示,GADD45A在癌症治疗中具有两面性,其作为抑癌基因还是促癌基因发挥作用,可能与肿瘤类型、涉及的信号通路以及其所处的肿瘤微环境密不可分。目前的研究对GADD45A的了解还比较有限,因此,未来亟需从基础研究与临床转化的角度,寻找GADD45A上、下游新的调控分子,筛选和鉴定其新的互作蛋白质或RNA分子,挖掘其与肿瘤微环境(如外泌体、肿瘤相关成纤维细胞、免疫细胞等)的联系,以及其在表观遗传修饰(甲基化、组蛋白修饰等)中扮演的角色。总的来讲,深入研究GADD45A在重要生理与病理发生中的机制,可为肿瘤临床治疗提供新靶标及相关治疗策略,在抗肿瘤中具有重要价值。
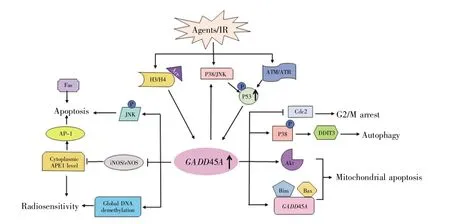
图2 GADD45A在肿瘤治疗中的作用机制Fig.2 The roles of GADD45A in tumor therapy

表2 GADD45A在肿瘤治疗中的作用Table 2 The roles of GADD45A in tumor therapy