培养液充气时间对小鼠4细胞胚胎密闭培养效果的影响
刘 洁,王丹丹,陈 芳,谷建锋,王 兆,赵晓娥,马保华
(西北农林科技大学 动物医学院,农业部动物生物技术重点实验室,陕西 杨凌 712100)
近年来,随着一系列太空探测计划的实施和发展,空间科学研究成为各国竞争日趋激烈的领域。随着载人飞行器的诞生,空间飞行对机体的影响,尤其是对生殖系统、胚胎发育的影响是值得关注和研究的课题[1-2]。在空间胚胎发育研究中,由于空间的微重力条件,胚胎培养必须采用密闭培养的方式进行[3]。密闭培养体系须在培养前对培养液进行一次性充气,胚胎发育的氧气来源完全依赖于密闭培养体系[4]。因此,适宜的充气时间对密闭胚胎的培养至关重要。
本试验在前期对小鼠4细胞胚胎研究的基础上[5],使用气体为体积分数5% O2、5% CO2、90% N2的标准气对胚胎培养液持续充气不同时间后,进行小鼠4细胞胚胎密闭培养,通过检测密闭培养过程中胚胎过氧化物产生和缺氧诱导因子-1α (hypoxia inducible factors-1α,HIF-1α)累积的情况,以及对囊胚发育率、孵化率及囊胚总细胞数进行统计,确定适宜于小鼠早期胚胎密闭培养的培养液标准气充气时间,为空间环境下哺乳动物的早期胚胎发育研究奠定基础。
1 材料与方法
1.1 材 料
1.1.1 试验动物 健康普通级昆明系小鼠(Musmusculus),购自第四军医大学实验动物中心,饲养室温度18~22 ℃,07:00-20:00日光灯人工光照,20:00-07:00黑暗,自由采食、饮水。在雌鼠体质量达到25 g左右、雄鼠体质量达到35 g左右时用于试验。
1.1.2 主要试剂和仪器 孕马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(hCG),宁波第二激素厂产品;胎牛血清(fetal bovine serum,FBS),美国Invitrogen公司产品;兔源多克隆HIF-1α抗体和2′7′-二氯二氢荧光素二乙酯(2′7′-Dichlorofluorescin diacetate,DCFDA),英国Abcam公司产品;生物素标记的羊抗兔IgG、链霉菌抗生物素过氧化物酶、DAB显色试剂盒,福州迈新生物技术开发有限公司产品;免疫染色固定液、免疫染色封闭液、免疫染色一抗稀释液、免疫染色二抗稀释液、抗荧光淬灭封片剂,碧云天生物技术研究所产品;高纯标准气(气体组成为体积分数5% O2、5% CO2、90% N2),北京龙辉京城气体有限公司产品;体视显微镜(SZ61)和数码倒置荧光显微镜(IX71-FL/RC),日本Olympus公司产品;超净工作台(HD-1360),北京东联哈尔滨仪器公司产品;CO2培养箱(FORMA 3111),美国Thermo Scientific公司产品;超纯水仪(UPT-1),成都超纯水科技有限公司产品。
1.1.3 液体配制 胚胎操作液:添加体积分数5% FBS的改良杜氏磷酸盐缓冲液(modified Dulbecco’s phosphate buffer solution,mDPBS)。胚胎培养液:添加体积分数10% FBS的CZB液。
1.2 方 法
1.2.1 小鼠超数排卵处理及胚胎采集 小鼠超数排卵处理及胚胎采集参照刘洁[3]的方法进行,具体操作如下:选择阴道口黏膜轻微红肿,阴道口紧闭、洁净,阴道内壁为粉红色且湿润的雌性小鼠,于超数排卵当天(第0天)16:00每只小鼠腹腔注射PMSG 10 IU,48 h后(第2天)腹腔注射hCG 10 IU,随即将雌鼠与单笼饲养的雄鼠合笼(雌雄比例1∶1),次日(第3天)上午07:00观察其阴门栓形成情况,有阴门栓形成者为假定受孕母鼠,用于胚胎采集。第4天晚23:00,颈椎脱臼法处死假定受孕母鼠,无菌采集输卵管,在盛有胚胎操作液的表面皿内,用无菌注射针头撕裂输卵管,收集4细胞胚胎,用新鲜胚胎操作液进行胚胎净化处理和形态质量鉴定后,挑选形态质量合格者用于体外培养试验。
1.2.2 胚胎培养 胚胎培养参照谷建锋等[5]的方法进行,具体操作如下。
(1)胚胎常规微滴培养。每个培养液微滴体积为100 μL,于胚胎培养前在35 mm培养皿内用胚胎培养液制作微滴,上覆矿物油,置入CO2培养箱中预平衡2 h,培养前将50枚胚胎移入微滴,置入饱和湿度、37 ℃、体积分数5% CO2培养箱中进行培养,在胚胎培养的12,36,60和84 h取样,备检。
(2)胚胎密闭培养。在胚胎密闭培养前,用100 mL无菌玻璃瓶装40 mL培养液,将高纯标准气通入胚胎培养液底部进行缓慢充气,减压气体与培养液之间的连接管道上用气体细菌滤器二次过滤除菌,充气速度以每分钟形成180~200个连续小气泡为度。各密闭培养组培养液充气时间分别为30,60,90,120,150,180和240 min,充气后的培养液立即用于胚胎密闭培养。使用200 μL PCR管(Axygen)作为胚胎培养容器,培养时先用充气胚胎培养液将PCR管润洗3次,随即加入200 μL充气培养液,并立刻移入100枚小鼠4细胞胚胎,盖紧PCR管盖并快速翻转PCR管使管口向下、浸入熔化的石蜡中并迅速离开和翻转,对PCR管进行石蜡封口,以保证胚胎培养环境的气密和液密。将密封好的PCR管放入饱和湿度、温度37 ℃的隔水式恒温培养箱中进行培养,于培养的12,36,60和84 h取样,备检。
1.2.3 胚胎内氧自由基产生情况的检测 利用DCFDA染色技术检测培养胚胎中过氧化物的产生和积累水平。首先对各充气时间组密闭培养12 h的胚胎过氧化物产生和累积情况进行检测,结果为阳性者在下一个时间点继续检测,依次向后直至检测结果呈阴性,每个培养管检测9~13枚胚胎。检测方法参照刘洁[2]的方法进行。操作时,打开PCR管盖,加入含0.5% DCFDA的PBS,使DCFDA的质量浓度为25 μg/mL,并轻轻吹打混匀,盖上管盖,在37 ℃培养箱中孵育30 min,取出后避光,用细胞核染液(含10 μg/mL Hoechst 33342的PBS)染核3 min,用PBS洗涤3次,在荧光显微镜下观察,通过比较各组胚胎中绿色荧光的强弱,判断胚胎中氧自由基产生和积累的情况。
1.2.4 HIF-1α蛋白表达的检测 首先对各组培养84 h的胚胎HIF-1α蛋白水平进行检测,结果为阳性者继续检测上一个时间点的样品,直至检测结果呈阴性时为止,每个培养管检测9~13枚胚胎。检测方法参照刘洁[3]的方法进行。检测时,对停止培养的胚胎室温固定1 h,免疫染色封闭液中封闭1 h,兔源多克隆HIF-1α抗体中(1∶1 000倍稀释)4 ℃孵育16 h,生物素标记的羊抗兔IgG室温孵育10 min,链霉素抗生物素过氧化物酶室温处理10 min,最后用DAB显色试剂盒进行显色处理,进行上述每一步操作前均需使用PBS清洗胚胎3次。将显色处理后的胚胎逐个置于载玻片上,用梯度酒精(体积分数依次为70%,80%,95%,100%)脱水干燥,二甲苯透明,封片。于显微镜下观察胚胎的着色情况,有明显的棕色着色即表示其为HIF-1α蛋白表达阳性胚胎。
1.2.5 囊胚细胞计数 各组胚胎培养至84 h停止培养,观察胚胎发育情况并拍照。计算各组囊胚发育率和孵化率,并进行囊胚细胞计数。计数时,先将各组囊胚在室温条件下固定30 min,然后随机选取9~13枚胚胎,将胚胎移入细胞核染液中处理5 min,PBS洗3次×5 min后,置于载玻片上,滴加抗荧光淬灭封片剂;加盖盖玻片并用指甲油封片,压片置于倒置荧光显微镜下观察并拍照,统计胚胎总细胞数。
1.2.6 数据统计与分析 为减小试验误差,各组试验均重复3次。试验所得数据用SPSS 20.0软件进行组间差异显著性的单因素方差分析,结果用“平均值(Mean)±标准误(SE)”表示。
2 结果与分析
2.1 小鼠胚胎培养过程中过氧化物的检测
常规微滴培养小鼠胚胎各个时间节点的过氧化物检测结果均为阴性。密闭培养小鼠胚胎过氧化物的检测结果(图1)显示,培养液充气30,60,90,120,150 min的密闭培养组胚胎,体外培养12 h时过氧化物检测为阴性(未见绿色荧光);充气180 min组和240 min组胚胎密闭培养12 h时,经DCFDA处理后,在荧光显微镜下可见绿色荧光,且充气240 min组更为明显,继续培养至36 h时两组均未观察到绿色荧光。
2.2 小鼠胚胎培养过程中HIF-1α蛋白表达的检测
充气培养液密闭培养胚胎和常规微滴培养胚胎免疫组化染色结果见图2。
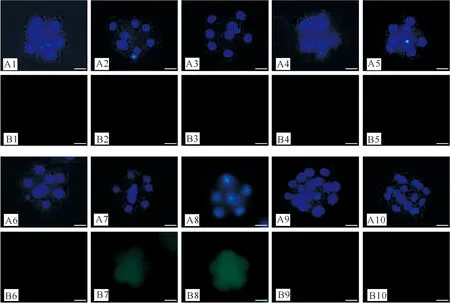
A.蓝色亮点为Hoechst 33342所染的细胞核;B.DCFDA染色结果,更强的绿色荧光代表更多过氧化物在胚胎内产生1.在微滴中培养12 h的胚胎(对照组); 2~8.分别为培养液充气30,60,90,120,150,180,240 min 组密闭培养12 h的胚胎;9,10.分别为培养液充气180和240 min组密闭培养36 h的胚胎。标尺=20 μmA.Bluish fluorescence shows nucleus stained by Hoechst 33342;B.Peroxide is labeled with DCFDA,stronger green fluorescence means more ROS was produced in embryo.1.Embryos cultured for 12 h in microdrop (control);2-8.Embryos cultured for 12 h in sealed-culture groups pretreated with reference gas for 30,60,90,120,150,180 and 240 min,respectively;9 and 10.Embryos cultured for 36 h in sealed-culture groups pretreated with reference gas for 180 and 240 min.Scale bar=20 μm图1 体外充气密闭培养和微滴培养小鼠早期胚胎中过氧化物水平的检测结果Fig.1 ROS levels of early-stage embryos cultured in microdrop or sealed-culture groups in vitro
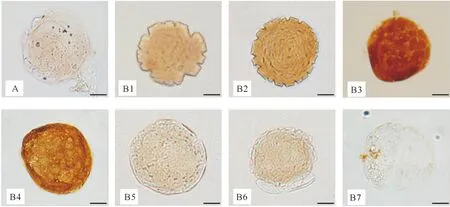
A.常规微滴培养84 h的胚胎(对照组);B1.充气30 min密闭培养12 h的胚胎;B2.充气60 min密闭培养36 h的胚胎;B3.充气90 min密闭培养60 h的胚胎;B4-B7.分别为充气120,150,180,240 min密闭培养84 h的胚胎HIF-1α检测阳性的胚胎细胞显棕色,阴性胚胎无特异性着色;标尺=20 μmA.Embryo cultured for 84 h in microdrop group (control);B1.Embryo cultured for 12 h in the sealed-culture group pretreated with reference gas for 30 min;B2.Embryo cultured for 36 h in the sealed-culture group pretreated with reference gas for 60 min;B3.Embryo cultured for 60 h in the sealed-culture group pretreated with reference gas for 90 min;B4-B7.Embryos cultured for 84 h in the groups pretreated reference gas for 120,150,180,and 240 min,respectively.Embryos that tested positive for HIF-1α were brown,and those negative had no obvious staining;scale bar=20 μm图2 体外充气密闭培养和微滴培养小鼠早期胚胎中HIF-1α蛋白累积情况的检测结果(DAB显色)Fig.2 Accumulation of HIF-1α protein in early-stage embryos cultured in microdrop or sealed-culture groups in vitro (staining by DAB)
如图2-A所示,常规微滴培养组小鼠胚胎在培养过程中均未检测到HIF-1α蛋白累积。用充气30 min的培养液进行密闭培养的小鼠胚胎,在培养到12 h时胚胎细胞即表现明显的浅棕色团块状着色,表明HIF-1α已经开始出现积累(图2-B1);充气60 min组的胚胎在密闭培养36 h时检测到HIF-1α的积累(图2-B2);充气90 min组的胚胎在培养60 h时检测到HIF-1α的积累(图2-B3);充气120 min组的胚胎在培养84 h时检测到HIF-1α的积累(图2-B4);充气150,180,240 min组的胚胎,直至培养结束时都未检测到HIF-1α的积累。
体外培养12和36 h的胚胎,由于细胞数较少,免疫组化染色处理后,胚胎呈不规则凹多边形(图2-B1,B2)。
2.3 小鼠胚胎体外发育情况及囊胚细胞计数结果
充气密闭培养及常规微滴培养84 h后,小鼠胚胎体外发育及囊胚细胞计数结果(图3,表1)显示,充气30和60 min密闭培养的小鼠胚胎囊胚发育率很低,有卵裂球碎裂、缩小等现象;充气120 min以上各组均可获得较高的囊胚发育率,且各组间均无显著差异(P>0.05);充气30~90 min密闭培养各组和常规微滴培养组的囊胚孵化率均显著低于充气120~240 min密闭培养各组(P<0.05),其中充气90 min密闭培养组的囊胚发育率亦显著低于充气120~240 min密闭培养各组(P<0.05)。小鼠胚胎细胞计数结果显示,微滴培养组和充气120,150,180 min密闭培养组胚胎的平均总细胞数差异不显著(P>0.05),但显著高于其他组(P<0.05)。

A.常规微滴培养84 h的胚胎对照组;B-H.分别为充气30,60,90,120,150,180,240 min密闭培养组胚胎。标尺=50 μmA.Embryo cultured for 84 h in microdrop (control);B-H.Embryos in sealed-culture groups pretreated with reference gas for 30,60,90,120,150,180,and 240 min,respectively.Scale bar=50 μm图3 小鼠4细胞胚胎体外充气密闭培养和微滴培养84 h后获得的囊胚Fig.3 Blastocysts obtained 84 h after mouse 4 cell stage embryos cultured in microdrop or sealed-culture groups in vitro
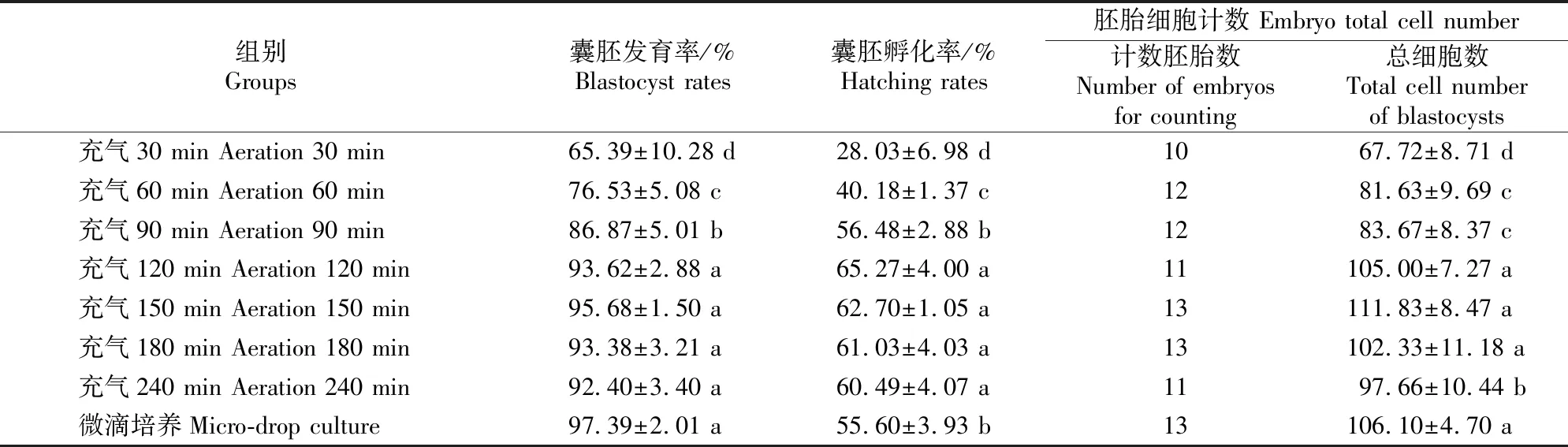
表1 小鼠4细胞胚胎体外密闭培养和微滴培养84 h的发育情况及细胞计数结果Table 1 Developmental rates and total cell numbers of mouse 4 cell embryos cultured in microdrop or sealed-culture groups for 84 h
3 讨 论
前人对仓鼠、家兔、猕猴等动物的研究结果显示,子宫与输卵管腔中的氧气体积分数为2%~9%[6]。研究证明,当胚胎培养体系中的氧气体积分数较低(约5%)时,其囊胚发育率高于在大气氧环境下(约20%)培养的胚胎[7-11],究其原因,可能与氧自由基对胚胎的损伤有关[12-14]。然而,胚胎培养环境中的氧含量过低,又会导致胚胎缺氧,同样对胚胎发育产生不良影响[4]。在进行小鼠胚胎密闭培养时,胚胎发育所需的氧气完全依赖于密闭培养体系,而对培养液进行充气处理的时间直接影响了培养液中的溶氧量。因此,筛选出适宜的培养液充气时间,对于建立和完善小鼠胚胎密闭培养体系十分重要。
本研究中对小鼠胚胎氧自由基产生的检测结果表明,培养液充气时间≤150 min时,胚胎在培养12,36,60,84 h时均未检测到氧自由基的累积;培养液充气180和240 min,胚胎密闭培养12 h时检测到了过氧化物,且充气240 min组更为明显,提示充气时间过长会使培养液的溶氧量超过胚胎正常发育的氧消耗量,导致胚胎在培养过程中积累过量的活性氧基团。在对胚胎质量进行综合评价后发现,尽管充气时间在120~240 min的密闭培养各组在囊胚发育率和孵化率上差异不显著(P>0.05),但培养液充气240 min的密闭培养组囊胚细胞总数显著低于充气120~180 min的密闭培养组。这一结果说明在小鼠胚胎培养初期,胚胎中过多的氧自由基在一定程度上会对胚胎发育产生不利影响。同时,在本研究中,微滴培养组的囊胚孵化率显著低于培养液充气120~240 min的密闭培养组,可能与微滴培养时胚胎始终暴露在相对较高的氧环境中有关。研究者对仓鼠、家兔、猕猴等动物的研究结果显示,子宫腔的氧气浓度略低于输卵管,表明在生理条件下,胚胎发育原本就经历着一个从相对高氧到相对低氧的过程[15]。有研究者认为,将早期胚胎持续暴露于20%的高氧环境下,会出现囊胚发育率降低、胚胎形态差异过大以及植入异常等现象[16]。此外,在微滴培养组的胚胎中并未检测到过氧化物的积累,提示当充气时间超过180 min后,溶解在充气培养液中的氧气总量可能已经超过了在大气环境下液体中的溶氧量。
HIF-1由α和β两个亚基构成,在哺乳动物细胞中能够稳定表达,并在氧充足的环境中快速被泛素化降解。但在缺氧环境下,HIF-1的泛素化降解通路受阻,导致其在细胞中出现累积[17-19]。因此,HIF-1α能够作为检验细胞是否缺氧的指标物。在密闭培养体系中,胚胎发育所需的氧气由充气培养液提供,在培养过程中无法向体系中补充氧气。因此在对培养液充气处理时,需要保证培养液中充入了足够支持细胞发育到囊胚的氧气。在对各组小鼠胚胎HIF-1α蛋白检测后发现,在培养液充气时间为150,180和240 min的密闭培养组中,培养84 h后胚胎中HIF-1α蛋白检测仍呈阴性,提示这3组的胚胎在发育过程中处于不缺氧的状态,因此培养终止时在胚胎中未检测到HIF-1α[20]。培养液充气120 min的密闭培养组胚胎的HIF-1α累积在60 h时检测为阴性,在84 h时检测为阳性,提示在此密闭培养组中,培养液中的溶氧量能支持胚胎发育60 h以上;进一步对该组的囊胚发育率、孵化率和囊胚细胞计数结果进行评定,认为虽然该组胚胎在培养末期发生了缺氧现象,但并未对胚胎发育造成可见的不利影响。培养液充气90,60,30 min组胚胎在密闭培养早期即出现HIF-1α积累,表明胚胎在早期发育过程中即处于缺氧环境,HIF-1翻译后降解受阻[21]。有研究报道,在缺氧条件下,HIF-1α调高p53的表达量并诱导合成p21,以抑制细胞周期依赖激酶的活性,同时使细胞周期停留在G1期,促使细胞凋亡[22],因此导致了培养液充气30,60,90 min组密闭培养的部分胚胎出现发育停滞和退化的现象。
4 结 论
在使用气体组成为体积分数5% O2、5% CO2和90% N2标准气的密闭培养体系中,培养液充气时间为120~150 min时,密闭培养体系中的胚胎在发育早期不会受到过多的活性氧损伤,在发育的后期也可尽量减少缺氧对胚胎发育的不利影响。据此认为,充气120~150 min的胚胎密闭培养条件可较好地支持小鼠4细胞胚胎体外发育至囊胚和孵化囊胚阶段。

