黄瓜白化突变体分析与突变基因al的精细定位
牛玉倩,李 征
(西北农林科技大学 园艺学院,陕西 杨凌712100)
经过长期的栽培与驯化,黄瓜(CucumissativusL.)已经成为最主要的蔬菜作物之一,广泛分布于世界各地。作为第一个进行基因组测序的蔬菜作物,黄瓜基因组较小,约为367 Mb,是研究葫芦科的模式作物,也是研究叶色突变的理想植物。叶色突变在自然界普遍存在,由于叶色突变植株是研究叶绿素合成代谢、叶绿体发育结构及光合作用系统的理想材料,随着分子生物学的进一步发展,对于叶色突变体的研究日渐深入。
植物白化突变体的形成大多是因为叶绿素缺失、叶绿体发育受阻、叶绿体内部结构异常或光合作用受阻而产生的。突变体植株在缺乏叶绿素后不能进行正常的光合作用,导致苗期就表现出致死效应。目前,叶色白化突变体在许多植物中都有发现,如水稻[1-2]、拟南芥[3]等。黄瓜叶色突变体方面的报道甚少,迄今为止发现的叶色突变体的表现也不尽相同,其中已报道的致死突变体有4个:al、cd、gc和p[4],非致死突变体有8个:g、lg-1、lg-2、v、vvi、yc-1、yc-2和yp[5]。随着基因组学及分子育种的发展,我国关于黄瓜叶色突变体的研究也逐渐深入,如国艳梅等[6]和苗晗[7]在黄瓜雌性系9110Gt中发现了能够稳定遗传的黄色突变体。进一步研究发现该突变体中叶绿体发育异常且受温度影响较大,其由位于黄瓜6号染色体(Chr6)上的隐性位点v-1控制,最终将CsaCNGCs确定为候选基因[6-8]。李万青等[9]和Gao等[10]利用EMS诱变获得黄瓜叶绿素缺陷突变体C528,其叶绿素a、叶绿素b、类胡萝卜素及叶绿素总量相对于野生型均显著降低,利用图谱克隆技术最终将CsChlI确定为候选基因。李燕[11]发现的黄瓜黄绿叶色突变体Z3t的子叶表现为黄色,叶绿体结构异常,超氧化物歧化酶活性显著高于对照,并由隐性核基因yl控制。胡亮亮等[12]对黄绿叶突变体C777进行光合特性分析发现,突变体的光合色素质量分数相对于野生型降低,导致其净光合速率显著降低。董翔宇[13]通过BSA法结合分子标记技术将自然突变叶色突变体yf的候选基因定位在第7条染色体Cucsa.099260基因上。
在前期研究中,本研究小组使用黄瓜野生型材料649经EMS诱变后获得携带白化基因的杂合突变个体,在分别与黄瓜材料Gy14和9930构建的2个F2群体中均出现了白化致死突变个体。因其植株不能正常发育真叶,与已报道的黄瓜叶色突变体均不同,因此将其命名为白化albinocotyledons(简称al)突变体。初步观察其表型发现突变植株子叶白化,苗期致死。本试验通过对白化突变体的研究,以期发现调控叶绿素合成和叶绿体建成的关键基因,为进一步阐明影响黄瓜叶绿体发育的重要代谢或调控机制及光合作用机理研究提供参考。
1 材料与方法
1.1 供试材料
黄瓜亲本材料Gy14、9930均来自西北农林科技大学园艺学院黄瓜课题组,黄瓜野生型材料649经EMS诱变后获得携带白化基因的杂合突变材料,与Gy14、9930分别构建F2群体。试验所用Gy14×649、9930×649的F1代种子来自西北农林科技大学园艺学院黄瓜课题组,2017年秋季种植于温室中,用于自交并获得F2分离群体,进行生理和遗传分析。2018年春季扩大F2群体种植,进行基因精细定位研究。
1.2 试验方法
1.2.1 光合色素含量的测定 光合色素含量的测定方法参照《植物生理生化实验原理与技术》(第3版)[14]并略有更改。分别取Gy14×649、9930×649 F2群体子叶展平期5和9 d苗龄的野生型及al植株各3株,各称取新鲜叶片组织0.2 g,加入约5 mL 体积分数80%丙酮充分研磨,避光放置至叶片无色,过滤、定容至10 mL,摇匀备用。以体积分数80%丙酮为空白对照,分别在663和646 nm波长下测定其OD值,重复3次。按下式对植株子叶所含光合色素含量进行计算[15-16]:
Ca=(12.21A663-2.81A646)×V×N÷
(W×1 000);
Cb=(20.13A646-5.03A663)×V×N÷
(W×1 000);
Ca+b=Ca+Cb。
式中:A663、A646分别为植物叶绿体色素提取液在663和646 nm波长下的OD值,Ca、Cb分别为叶绿素a、叶绿素b的含量(mg/g),Ca+b为总叶绿素含量(mg/g),V为提取液体积(mL),N为稀释倍数,W为样品鲜质量(g)。
1.2.2 叶绿体结构的观察 分别选取9930×649 F2群体野生型及突变体的子叶和真叶(突变体因无法长出真叶,故选取同时期生长点处新生嫩芽),切取条状、截面约1 mm×1 mm且体积不大于1 mm3的叶片组织,放置于预冷固定液(2.5%戊二醛磷酸缓冲液,4 ℃冰箱保存)中,抽真空30 min,4 ℃保存备用。每组材料重复3次,固定6 h后可送制样。制样试剂和样品制备方法参考Leica公司提供的 《常规生物透射电镜样品制备概要》 (http://www.leica-microsystems.com)。用透射电镜对细胞中的叶绿体进行观察,透射电镜的操作方法由西北农林科技大学北校区公共实验平台提供。
1.2.3 黄瓜白化表型的遗传分析与精细定位 随机选取Gy14×649、9930×649 F2群体扩繁的种子,统计白化个体和野生型个体数,并对统计结果进行χ2分析。用BSA法对目标突变基因进行初步定位,在Gy14×649、9930×649 F2分离群体中分别随机选取野生型和突变体表型植株各10株,用CTAB法提取DNA后稀释至50 ng/μL,构建野生型基因池和突变体基因池,利用这两个池进行黄瓜白化突变基因的初定位,同时对这两个基因池进行全基因组Bulk-seq测序,测序由诺禾致源生物科技有限公司完成。初定位所用黄瓜染色体引物由西北农林科技大学园艺学院黄瓜课题组提供。黄瓜染色体基因组SSR标记引物[17-19]由生工生物工程(上海)股份有限公司合成。PCR反应体系为:2×Dining Mix(北京,Dining)5 μL,ddH2O 3 μL,上、下游引物(10 ng/μL)各0.5 μL, DNA模板(50 ng/μL)1 μL。PCR反应程序为:94 ℃预变性5 min;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸20 s,28个循环;72 ℃终延伸 5 min,终止温度10 ℃ 保存。PCR产物经聚丙烯酰胺凝胶电泳银染显色后统计带型,从而进一步筛选多态性引物。
在SSR分子标记的基础上,基于黄瓜基因组数据库网站(http://cucurbitgenomics.org/)信息,结合重测序结果开发了单核苷酸多态性(SNP)和缺失/插入(InDel)标记。标记与目标基因的连锁分析使用MAPMARKER/EXP 3.0程序,应用Kosambi函数将其转化为遗传图距[20]。本研究中使用的PCR引物信息见表1。

表1 本研究用到的黄瓜基因定位PCR引物Table 1 Cucumber gene mapping related primers used in this study
2 结果与分析
2.1 黄瓜al突变体的表型观察与分析
由于al突变体具有苗期致死性,因此最初该突变体是从Gy14×649和9930×649 F2分离群体中鉴定获得的。对黄瓜al突变体表型进行观察发现,与野生型相比,al突变体刚出土时子叶颜色浅黄,之后逐渐白化(图1-A,B)。突变体在子叶期正常生长,在野生型进入真叶期的相同时段,突变体慢慢枯萎死亡(图1-C)。对al突变体的观察表明,该突变为致死突变性状。

A,B.分别为9930×649、Gy14×649 F2群体al突变体与野生型植株;C.同时播种后野生型长出真叶时,al突变体逐渐萎蔫死亡。WT.野生型;M.al突变植株A,B.al mutant plants and wild type in two F2 populations of 9930×649,Gy14×649,respectively;B.At the first-leaf period,the al mutant wilted and died.WT.Wild-type plants;M.al mutant图1 黄瓜al突变体与野生型植株的表型观察Fig.1 Observation of phenotypes of cucumber al mutant and wild type
2.2 黄瓜白化突变体光合色素含量的测定
与野生型相比,Gy14×649和9930×649两个F2分离群体中的al突变体叶色呈浅黄或白色。分别对5和9 d苗龄的野生型及al突变体子叶的叶绿素含量进行测定,结果表明,9930×649 F2群体中,al突变体的总叶绿素含量极显著低于野生型植株(图2-A)。相较于野生型, 5 d苗龄(即子叶展平期)时,al突变体叶绿素a含量降低了94.18%,叶绿素b含量降低了90.44%;9 d苗龄时,al突变体叶绿素a含量降低了97.65%,叶绿素b含量降低了92.01%(图2-B和图2-C)。
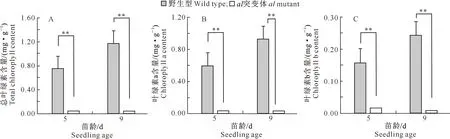
**表示同一苗龄野生型与al突变体间差异极显著(P<0.01)。下同** indicates significant difference between al mutant and wild type at same seedling age (P<0.01).The same below图2 不同苗龄下黄瓜9930×649 F2群体中al突变体子叶光合色素含量的变化Fig.2 Changes in photosynthetic pigment content in cotyledon of cucumber al mutant in 9930×649 F2 populations at different seedling ages
在Gy14×649 F2群体中,al突变体的总叶绿素含量均极显著低于野生型植株(图3-A)。与野生型相比, 5 d苗龄时al突变体叶绿素a含量降低了92.31%,叶绿素b含量降低了88.13%;9 d苗龄时al突变体叶绿素a含量降低了98.93%,而叶绿素b含量几乎无法测到(图3-B和图3-C)。
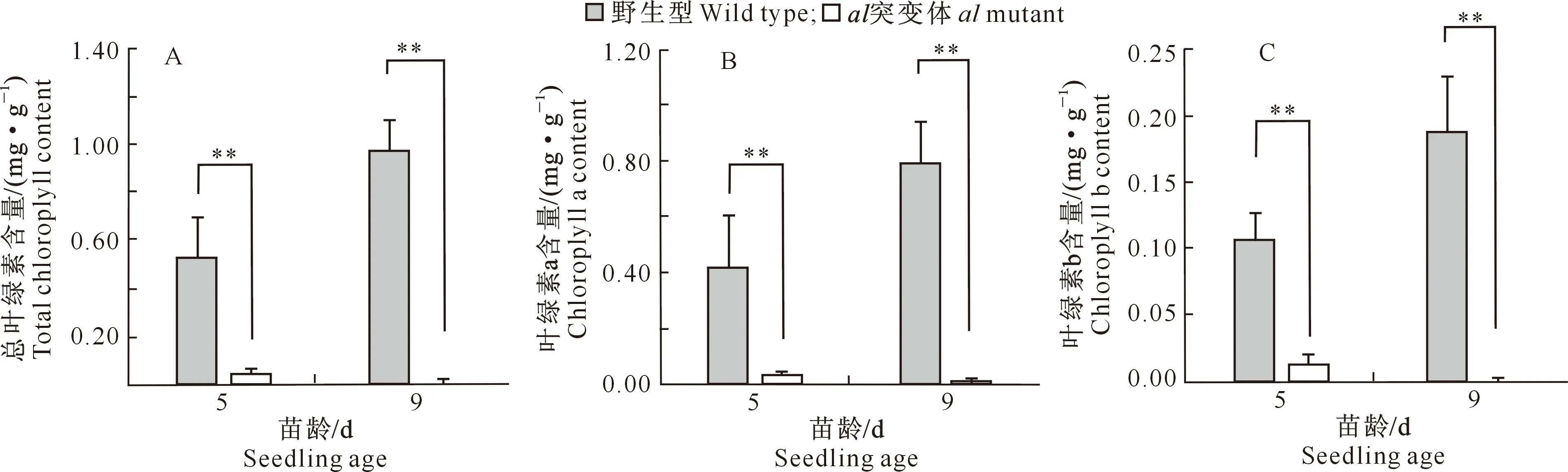
图3 不同苗龄下黄瓜Gy14×649 F2群体中al突变体子叶光合色素含量的变化Fig.3 Changes in photosynthetic pigment content in cotyledon of cucumber al mutant in Gy14×649 F2 populations at different seedling ages
2.3 黄瓜白化突变体叶绿体结构的观察
利用透射电镜对野生型及al突变体子叶和真叶的叶绿体结构分别进行观察,结果发现野生型子叶中的叶绿体形态正常,呈椭球形,有正常堆叠的基粒片层结构(图4-A,B)。但al突变体子叶叶肉细胞中未观察到规则的叶绿体,偶尔会有几个呈细长条形的异常叶绿体结构(图4-C,D)。野生型真叶中的叶绿体相对于子叶中的叶绿体发育更为完全,形状规则,排布整齐,可观察到正常堆叠的基粒片层、淀粉粒等完整结构(图4-E,F)。在al突变体真叶(即同时期生长点处新生嫩芽)的叶肉细胞中几乎不能观察到叶绿体(图4-G,H)。

A,B.野生型子叶;C,D.al突变体子叶; E,F.野生型真叶;G,H.al突变体真叶。箭头示叶绿体或叶绿体类囊体A,B.Wild-type cotyledon;C,D.al mutant cotyledon;E,F.Wild-type true leaf;G,H.al mutant true leaf.Arrows indicate chloroplasts or chloroplast thylakoids图4 黄瓜野生型和al突变体子叶及真叶的叶绿体形态观察Fig.4 Morphology of cucumber wild-type and al mutant cotyledons and true leaves
2.4 黄瓜白化表型的遗传分析与精细定位
对黄瓜Gy14×649和9930×649两个杂交组合的F1、F2群体进行表型观察发现,F1个体表型均正常。利用Gy14×649、9930×649 F2群体出现的分离表型进行遗传分析,发现Gy14×649、9930×649 F2群体中野生型与突变型植株数的比值分别为76∶25和69∶21,χ2测验结果P>0.05(表2),表明分离群体符合孟德尔遗传定律3∶1分离比,即突变个体的表型是由单基因控制的隐性性状,因此可使用F2群体对al基因进行定位和克隆。
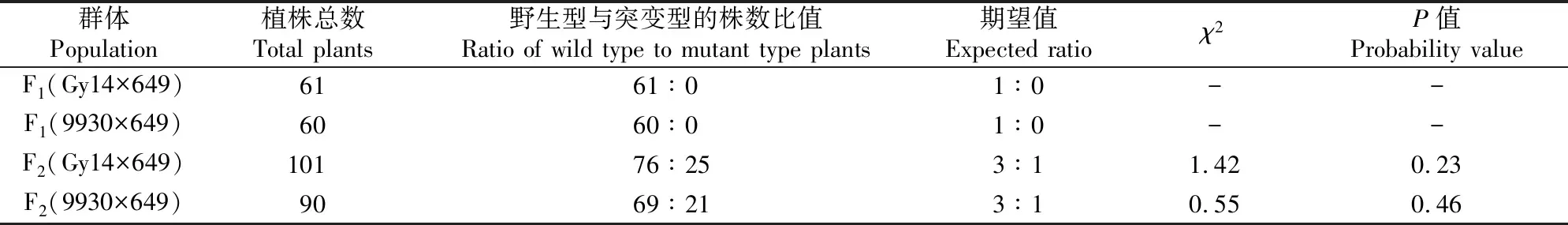
表2 黄瓜al突变体F1和F2群体的遗传分析Table 2 Genetic analysis of cucumber al mutants in F1 and F2 populations
利用课题组原有的7条黄瓜染色体上的SSR分子标记,用Gy14×649、9930×649的F2分离群体分别混合构建的野生型基因池(AL_)和突变型基因池(alal)进行筛选,以每对标记组合均能在两基因池中扩增出相应的清晰主带为准,最终在7号染色体上筛选出连续多态性SSR标记12对(SSR7001、SSR7011、SSR7012、SSR7013、SSR7014、SSR7016、SSR7020、SSR7025、SSR7026、SSR7027、SSR7029、SSR7031),故将目的基因初步定位于7号染色体上。
对Gy14×649、9930×649 F2分离群体中分别混合构建的野生型基因池(AL_)和突变型基因池(alal)进行全基因组Bulk-seq测序。根据池间△SNP index的结果,在黄瓜7号染色体上发现一个潜在的差异连锁区间,与初定位结果相同,可在7号染色体上对目标基因al进行进一步定位。
选用Gy14×649 F2群体中的96个al突变体单株对目的基因进行进一步定位分析发现,SSR7016、SSR7026距离目的基因位点最近,分居al两侧,两标记间距离约为5.7 cM;同时选用9930×649 F2群体中96个al突变体单株进行定位,发现SSR7020、SSR7027距离目的基因位点最近,分居al两侧,两标记间距离约为5.2 cM(图5-A)。综合标记SSR7016、SSR7026、SSR7020、SSR7027在基因组上的位置分布及交换事件数量变化情况,将al基因定位于SSR7020和SSR7026之间,遗传距离约为2.3 cM(图5-A)。
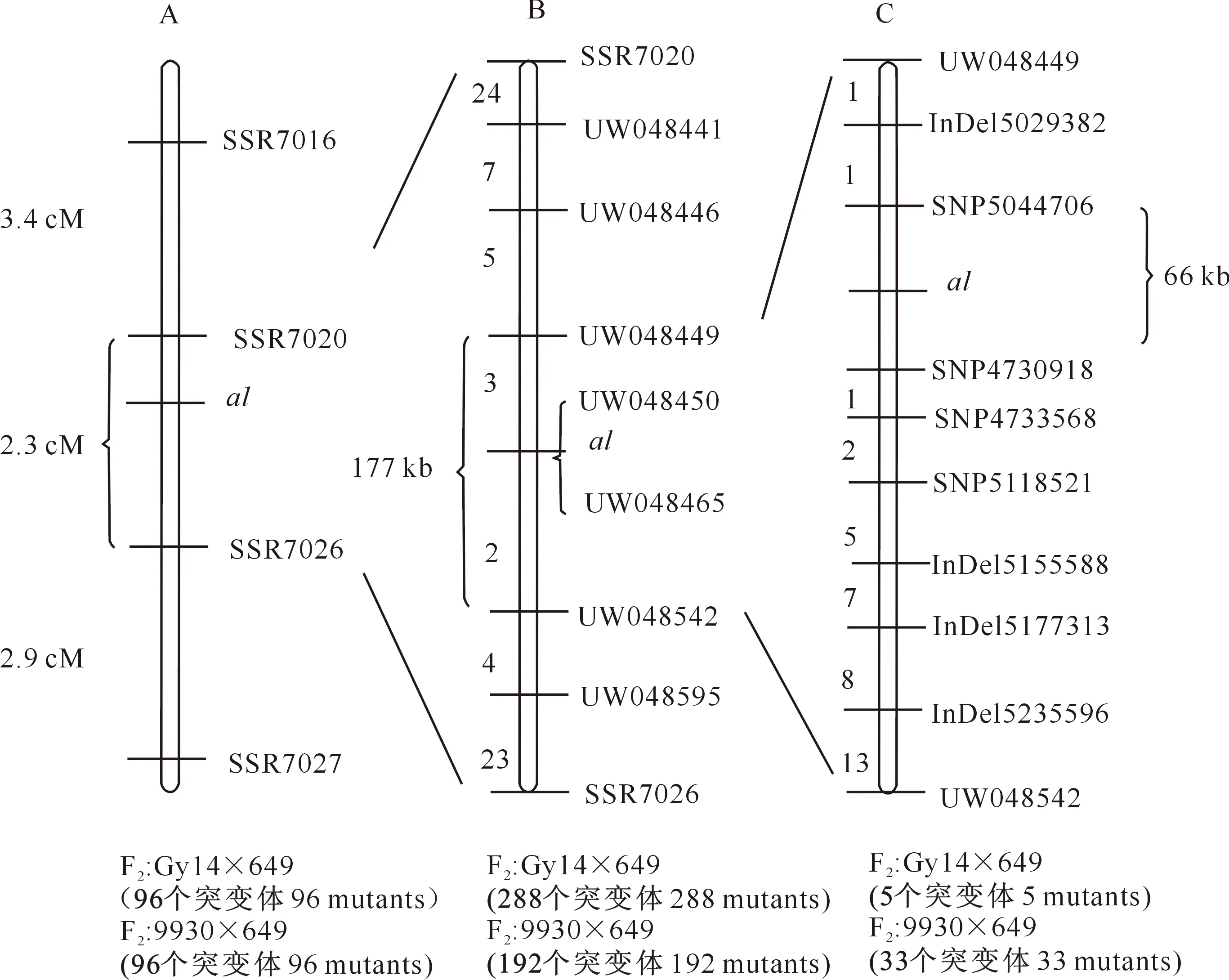
A.利用小群体将突变基因al初步定位于标记SSR7020与SSR7026之间;B.扩大群体将突变基因al定位于标记UW048449与UW048542之间,而UW048450和UW048465与al共分离;C.开发标记,最终将突变基因al定位于标记SNP5044706与SNP4730918之间A.Using primary populations,al gene was mapped between marker SSR7020 and SSR7026;B.Using enlarged populations,al gene was mapped between marker UW048449 and UW048542,and co-segregated with UW048450 and UW048465;C.After developing markers,al gene was finally mapped between marker SNP5044706 and SNP4730918图5 黄瓜白化突变基因al的精细定位Fig.5 Fine mapping of cucumber al gene
在初步定位的多态性标记SSR7020和SSR7026之间继续设计SSR分子标记,利用亲本9930、Gy14及Gy14×649、9930×649的F1杂合个体和F2突变个体的DNA对开发标记进行多态性筛选,发现7个SSR分子标记(UW048441、UW048446、UW048449、UW048450、UW048465、UW048542、UW048595)对Gy14×649 F2群体存在多态性,而9930×649 F2群体只有1个多态性分子标记UW048595。在Gy14×649 F2群体中,使用al基因两侧标记SSR7016和SSR7026筛选出288个交换株,并在上述7个多态性标记中进行分析,结合其表型观察,将包含al基因的物理区间缩小到UW048449与UW048542之间,约177 kb的区间内,包含5个交换单株,而标记UW048450和UW048465与al位点共分离。在9930×649 F2群体中,使用al基因两侧标记SSR7020和SSR7027筛选出192个交换单株,并用多态性标记UW048595分析交换单株,结合其表型最终将目的基因定位于SSR7020与UW048595之间,包含33个交换单株。因该群体定位区间远大于Gy14×649 F2群体定位区间,故以UW048449与UW048542定位区间为准(图5-B)。
根据上述定位结果,由于标记UW048450和UW048465与al位点呈共分离,故根据黄瓜基因组数据库信息和全基因组Bulk-seq测序结果,在UW048449和UW048542两个SSR分子标记间继续开发具有多态性的SNP和InDel标记,用于进一步缩小目的区间。在UW048542侧继续向内开发标记,分别以两个F2分离群体的突变体及F1杂合个体为对照,在标记位置附近设计引物,扩增包含标记在内的序列,测序确定其是否具有多态性。用获得的多态性标记InDel5235596继续筛选9930×649 F2群体的交换单株,将交换事件缩减至13个。以此标记为基础,继续开发多态性标记并对剩余群体的交换单株进行筛选,其中在9930×649 F2群体中筛选出具有多态性的标记为InDel5177313、InDel5155588、SNP5118521、SNP4733568、SNP4730918,在Gy14×649 F2群体中筛选出具有多态性的标记仅有SNP4730918。经过筛选,在9930×649 F2群体中,InDel5177313标记获得8个交换单株,InDel5155588标记筛选到7个交换单株,SNP5118521标记筛选到5个交换单株,SNP4733568标记筛选到2个交换单株;在Gy14×649 F2群体中,SNP4730918标记筛选到1个交换单株。根据标记在基因组上所在位置以及不同标记上交换株的数目变化,可推断目的基因现定位于标记SNP4730918与 UW048449之间。同时在UW048449侧筛选到多态性标记InDel5029382和SNP5044706,以F2群体突变体及F1杂合个体为对照,在2个标记上各得到1个交换单株。根据标记间位置信息及交换数目,最终将al基因定位于SNP5044706与SNP4730918标记之间,区间大小为66 kb(图5-C)。
3 讨 论
已有研究表明,由于控制叶绿素生物合成或叶绿体发育的基因沉默或失活,直接或间接影响叶绿素的合成与降解,从而导致突变体叶片中的各色素含量发生变化,最终形成叶色突变体[21]。除此之外,叶绿体结构发育异常也是形成叶色突变体的重要因素,如水稻[22-23]、小麦[24]等。故对叶色突变体的研究可从叶绿素合成与降解途径、叶绿体结构等方面进行。
本试验对黄瓜al突变体和野生型的光合色素含量及叶绿体结构分别进行了测定与观察,结果表明al突变体的光合色素含量相对于野生型极显著降低,其叶绿体结构形态异常且数量大幅度减少,可以预测其候选基因与控制叶绿素合成或叶绿体结构发育相关。因白化突变体苗期致死,不能进行正常的生长发育,故本试验通过构建Gy14×649、9930×649两个F2群体获得分离群体中的白化突变个体,从而保证了分子标记定位过程中隐性群体的数目。同时统计群体后代野生型与突变体数量进行遗传分析,结果表明该白化突变性状符合孟德尔遗传定律3∶1分离比,证明该性状是由单隐性核基因控制的。本试验将两个分离群体Gy14×649、9930×649通过BSA混池法结合基因组重测序,准确地将黄瓜白化突变基因定位于7号染色体上。之后根据黄瓜基因组数据库预测信息及全基因组重测序结果,进一步开发标记并进行定位,最终将候选基因定位于SNP5044706与SNP4730918标记之间约66 kb的区间内。之后在此区间内继续扩大筛选突变个体数量,但不能筛选出更多的交换单株,可能是突变体基因组在这一区段发生交换重组事件的概率较低所致。
现有黄瓜叶色突变体相关报道表明,控制叶色突变性状的基因多参与编码叶绿素合成途径或与控制叶绿体结构的正常发育相关,如李万青等[9]和Gao等[10]发现,黄瓜叶绿素缺陷突变体C528的最终候选基因CsChlI参与编码Mg-螯合酶的CHLI亚基;朱伟伟等[25]研究认为,黄瓜芽黄突变体的形成与CLpP相关,且CLpP参与调控叶绿体发育、相关蛋白积累及光形态建成。故后期对定位区段内候选基因进行预测时,可以根据该基因功能是否与叶绿素合成、叶绿体结构相关进行分析确定。董翔宇[13]研究发现,黄瓜叶黄突变体yf的形成,同负责编码与类囊体合成途经蛋白的基因Cucsa.099260发生突变相关,该基因与本研究预测基因均位于黄瓜7号染色体上,但经过基因定位区间比对发现,该突变基因并不存在于本研究最终定位的66 kb区间内,说明本研究的目的基因与上述定位基因并非同一基因,后续试验需进一步对区间内候选基因功能进行分析,从而确定目的基因。
本试验利用共同亲本649与不同背景的两个黄瓜测序品种Gy14、9930分别构建群体,同时对同一候选基因进行定位,可观察到在不同背景下获得的多态性标记不尽相同,且即使有相同的多态性标记,两群体在同一位点的交换单株数量也存在差异, 这可能是亲本遗传背景不同导致的遗传效应不同,也有可能是等位基因间存在一定程度的互作效应,具体原因需进一步探究。在结合基因组位置信息的情况下,使用多背景材料进行基因定位,可以提供更多的多态性分子标记,有助于加快基因定位工作,具有较高的应用价值。
4 结 论
本试验对黄瓜白化al突变体进行了光合色素含量测定和叶绿体结构观察,发现al突变体叶绿素含量极显著降低,且叶肉细胞中几乎不能观察到叶绿体。通过构建Gy14×649、9930×649两个F2群体对突变体进行扩繁,同时利用SSR分子标记技术结合重测序结果开发标记对突变基因al进行精细定位,最终将候选基因定位于黄瓜第7号染色体上约66 kb的区间内。

