基于代谢组学的食管鳞癌代谢特征与临床意义研究
黄伟钊,张晶晶,杨 弘,文 静,梁 毅,傅剑华
(1.中山大学肿瘤防治中心胸科//华南肿瘤学国家重点实验室//广东省食管癌研究所,广东广州 510060;2.中山市人民医院心胸外科,广东中山 528403;3.中山市人民医院放疗科,广东中山 528403)
食管癌总体治疗效果欠佳的原因之一,是缺乏早期诊断的简便有效的方法。近年,有作者试图引入基因学和蛋白质的标志物作为早期诊断和预后的评估,但仍然无法有效应用于临床。代谢组学是系统生物学的一个新兴领域,为识别有价值的生物标志物提供了一种强有力的、有前途的方法。代谢组学描述了生物流体或组织中存在的低分子量代谢物的浓度和通量的研究,这些研究提供了有关生物系统及其当前状态的详细信息[1-3]。本研究的目的主要是通过液相色谱-质谱联用(liquid chromatography-mass spectrometry,LC-MS)技术比较一组食管鳞癌和健康志愿者的血清代谢谱,寻找食管鳞癌特有的代谢标志物,为食管鳞癌的早期诊断提供参考,为下一步研究提供实验基础。
1 材料与方法
1.1 病例资料
选择一组明确诊断的食管鳞癌患者作为实验组、一组健康志愿者作为对照组。病例均来自中山大学附属肿瘤医院和中山市人民医院(中山大学附属中山医院),研究经过上述两家医院的伦理委员会同意,所有入组的患者和志愿者均已签署知情同意书。实验组入组标准:①经组织病理学明确诊断;②病理类型为鳞状细胞癌;③年龄在18~70 岁;④检查前均未接受过化疗、放疗等抗肿瘤治疗;⑤临床分期T1-4N1M0/T4N0M0(stage IIIA or IIIB),无远处转移;⑥无合并其他恶性肿瘤;⑦无合并其他代谢性疾病;⑧无合并感染的表现,如发热、血象升高等。对照组入组条件:①年龄在18~70 岁;②无合并恶性肿瘤或代谢性疾病。
1.2 实验方法
1.2.1 血清的采集 清晨空腹,7:00 am 采周围静脉血;用离心管收集血液样本,37 ℃或者室温静置1h 分层;3 000 r/min(r=8 cm)室温离心10 min,取上清转移至干净的离心管中;12 000 r/min(r=8 cm)4 ℃离心10 min,取上清分装到1.5 mL的离心管,每管0.2 mL。-80 ℃冰箱冻存,干冰冷藏转运。
1.2.2 样品前处理 取200 μL血清加入400 μL甲醇,涡旋混合30 s;-20 ℃静置2 h;将样本4 ℃,13 000 r/min(r=8 cm)离心15 min;取上清于EP 管中,真空抽干;加入100 μL 甲醇涡旋30 s 溶解,13 000 r/min(r=8 cm)离心15 min,取上清过0.22 μm 滤头过滤,每个样品取20 μL 混合,制成质控样品。
1.2.3 质谱条件 AB 5600+Triple TOF 质谱仪能够在控制软件(Analyst TF 1.7,AB Sciex)控制下基于IDA 功能进行一级、二级质谱数据采集,一级扫范围m/z(50~1 000),二级扫范围m/z(25~1 000),二级轰击能量:30 eV。ESI 离子源参数设置如下:雾化气压(GS1):55 Pa,辅助气压:55 Pa,气帘气压:40 Pa,温度:550 ℃,喷雾电压:5 500 V(正离子模式)。技术标准参照我国GB/Z 35959-2018 液相色谱-质谱联用分析方法通则。
1.2.4 数据分析 转格式:数据首先使用Analysis-BaseFileConverter 转换为.abf 格式。使用MSDIAL软件对转换后的abf文件进行寻峰、峰对齐、归一化等处理,同时基于一级和二级图谱搜索MassBank、MoNA、Respect、GNPS 数据库,得到鉴定结果。
MSDIAL 软件设置参数:Alignment:MS1 tolerance 0.01 Da;Retention time tolerance 0.3 min;Identification:Accurate mass tolerance(MS1):0.007Da(MS2):0.03 Da
对于MSDIAL 对齐鉴定出来数据,通过质控样品控制样品指标变异系数值小30%,然后删除组内缺失值>50%的离子峰。采用Pareto-scaling 方法进行归一化,应用MetaboAnalyst 软件进行差异分析和富集分析。
2 结果
2.1 入组情况
实验组(G1)20 例,均为食管鳞癌,从2018 年1月至2019年5月收治的经病理学明确诊断的患者。男性18 例,女性2 例;年龄34~67(58.6±7.25)岁。其中T2N1M0 5 例,T3N1M0 14 例,T4N0M0 1 例,分期构成IIIA 期5 例,IIIB 期15 例;肿瘤位于胸上段2例,胸中段10 例,胸下段8 例。对照组(G2)为健康人群,男性17 例,女性3 例;年龄42~69(50.3±9.25)岁。两组均签订实验知情同意书。比较实验组和健康对照组的年龄和性别构成比,差异均无统计学意义(P<0.05)。
2.2 实验质量控制
2.2.1 总离子流图 将10 次分析得到质量控制(quality control,QC)样本的总离子流图,进行谱图重叠比较。(图1)。理论上,QC 样本是一样的,但在物质提取、检测分析过程中会有系统误差,导致QC 样本之间出现差异,这个差异越小,说明系统的稳定性越好,数据的质量也越高。

图1 10次QC样本的总的离子流图Fig.1 Total ion flow diagram of 10 QC samples
2.2.2 主成分分析 从每个样品中提取适量待检测液(常规量为10 μL)进行等量混合作为实验的QC 样品。将QC 样本与测试样本检出的全部峰进行主成分分析(principal component analysis,PCA;图2)。
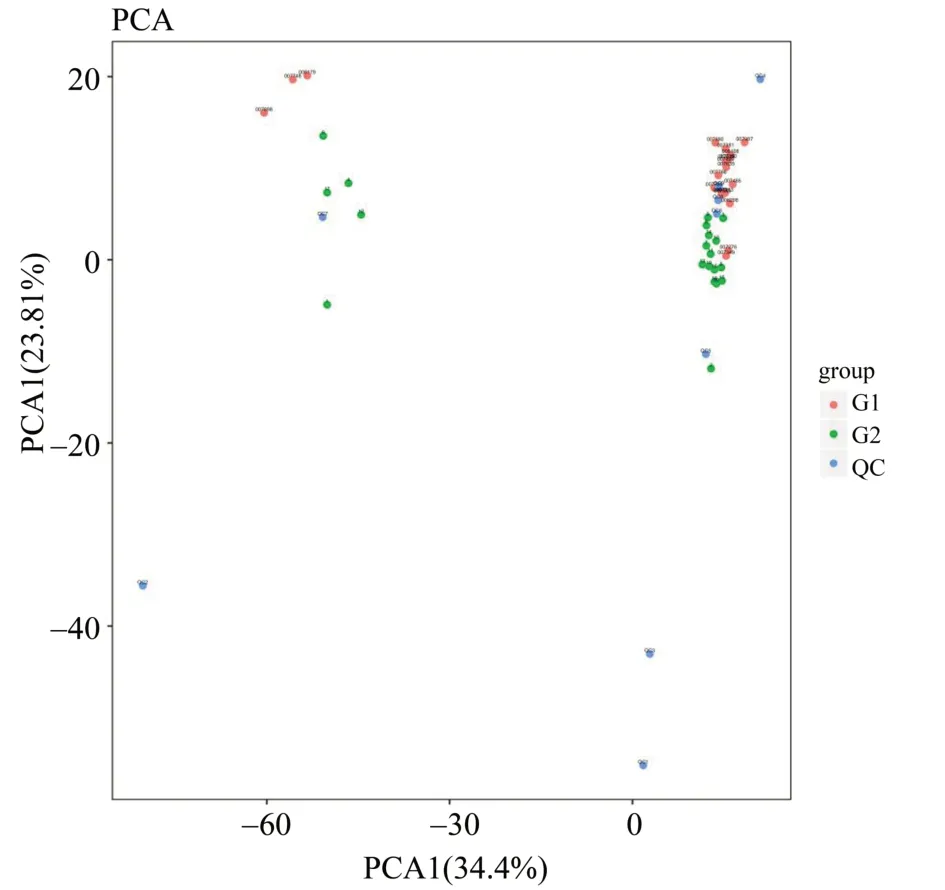
图2 PCA 2D得分图Fig.2 PCA 2-dimensional score chart
2.3 代谢物鉴定结果
通过软件MS_DIAL 进行峰寻找、峰对齐等数据处理,同时基于一级与二级图谱与数据库种化合物图谱进行匹配,得到鉴定结果。对无法与数据库对应的峰另外进行图谱预测,得到预测结果。下图展示每个样品检出的代谢物质及鉴定出物质的多少。本实验检出总物质峰1 849 个,符合二级图谱1 388个,共鉴定出物质402种(图3)。
2.4 样品差异性分析
通过主成分分析(图4)等统计学方法在样品全局代谢物含量的水平比较样品间的差异(均一性)。
2.5 单变量分析
本项目采用变异倍数(Fold Change,FC)分析、t检验对代谢物进行单变量统计分析,并绘制火山图(图5)。显示出样本间代谢物具有显著性变化。单变量分析的差异代谢物,共21种。
2.6 多变量分析
采用偏最小二乘回归分析法(partial least squares regression analysis,PLSDA)分析。图6 可以看出,两组样品分布相距较远,并分别集中在各自区域,表明两组样品含量差异明显。
2.7 差异指标筛选结果
本项目以P<0.05、Fold Change 大于2 倍且VIP值>1作为差异代谢指标的筛选标准(表1,图7)。
3 讨论
恶性肿瘤的本质是基因疾病,也是代谢性疾病,其发生、发展、对放化疗的敏感性和毒副反应也是由基因的异常导致的,但从基因的异常到出现功能表现的差异,当中经历了极其复杂的生化过程,主要是由患者个体、抗肿瘤治疗和肿瘤本身三者的共同作用结果。以代谢组学为基础去研究肿瘤的发生发展,具有客观准确、高效直接的优点。目前对于乳腺癌、肝癌、结直肠癌、胰腺癌等应用代谢组学已进行早期诊断的研究[4-9]。由此看来,食管癌也应该有其本身独特的代谢特点,可以用于揭示其肿瘤内在的生理生化过程,甚至可能进一步上推反证至基因调控的异常。本研究尝试比较食管鳞癌患者和正常人血清代谢组学的差异,寻找食管癌特异性的血清代谢产物,为了解食管鳞癌的发生发展及早期诊断提供线索,也为下一步食管癌放化疗敏感性的评估提供实验基础。
目前食管癌的代谢组学研究已经不少,但研究设计差异大、使用的标本不同、采用的检测方法、条件也不统一,故结果相差甚大,实验重复性差。既往一些基于核磁共振波谱的代谢组学研究[10-11]表明,食管癌患者尿液中的代谢物成分不同于健康对照组,然而筛选的差异代谢成分的一致性差,有研究尝试比较食管癌肿瘤组织和尿液的代谢谱的关联性,评估以尿液作为检验样本的可靠性,结果表明患者肿瘤组织和尿液之间的明显代谢特征和代谢途径紊乱存在一定的关联性,尿液代谢特征的变化是如何反映食管肿瘤组织中代谢情况,当中也可能经历了一系列生化过程,仍需要进一步的研究[12]。由于代谢组学中遇到的生物样品的复杂性,为了尽可能多地检测代谢物,质谱(mass spectrometer,MS)分析通常与分离技术结合使用,常用的分离方法包括气相色谱(gas chromatography,GC)、液相色谱(liqiud chromatography,LC)。气相色谱适合于热稳定性好或具挥发性的化合物分离。液相色谱-质谱联用技术则融合了液相色谱的高效及快速分离效能和质谱的高敏感性及高特异性优点,对于极性、难挥发性或大分子化合物等复杂生物样品来说,是测定分析的理想选择[13]。故本研究仍采用LC-MS 作为主要检测技术。样品制备是代谢组学的关键步骤。因此,一个全面和系统的组织制备方案筛选策略是非常可取的。我国有作者研究开发了一种基于LC-MS 的优化和评估策略,以筛选针对不同类型内源性代谢物(氨基酸、肉碱、胆碱等)的高提取效率和可重复性食管组织制备方案,并特别关注低水平代谢物,建立了一种稳定性、敏感性和重复性都较好的方案,称为“逐步加入溶剂和均匀化湿组织方案”(stepwise addition of solvents and a homogenized wet tissue protocol,SWHW)[14]。由此可见,在实验的样品选择、制备过程至关重要。

表1 物质差异结果综合统计表Table 1 comprehensive statistical table of substance difference

图3 各组样品检出的物质峰数量Fig.3 Number of peaks detected in each group
本研究最终筛选出6 种差异性代谢标记物:肌苷(inosine)、苯丙氨酸二肽(Phe Phe)、羟基吲哚硫酸(indoxylsulfuric acid)、2-顺式二十烯酸(2-cis eicosenoic acid)、硫酸普萘诺酮(pregnanolone sulfate)、δ-戊丙酰胺(delta-valerolactam)。然而进一步通过富集分析发现上述差异性代谢物,与氧化磷酸化、精氨酸的生物合成、钙信号通路、产热效应、醛固酮的合成与分泌、嘌呤代谢。其中可信度较高的是嘌呤代谢途径。尽管上述的代谢物参与的代谢途径不同,但通过富集分析,通路检索发现,各条通路中多数呈能量代谢的异常,其中4 个可见还原型辅酶Ⅰ(nicotinamide adenine dinucleotide,NADH)的下调。NADH是一种化学物质,是烟酰胺腺嘌呤二核苷酸的还原态。因NADH 主要在细胞中参与物质和能量代谢,产生于糖酵解和细胞呼吸作用中的柠檬酸循环,并作为生物氢的载体和电子供体,在线粒体内膜上通过氧化磷酸化过程,转移能量供给三磷酸腺苷(adenosine triphosphate,ATP)合成,所以NADH 又被称为线粒体素。理论上,1分子NADH 释放的能量,可以合成2.5 分子ATP。无氧条件下,葡萄糖代谢所产生的ATP 是十分少的。而有氧条件下,经过糖酵解和三羧酸循环产生的NADH 或还原型黄素二核苷酸(flavine adenine dinucleotide,reduced,FADH2)经由氧化磷酸反应可产生大量的ATP;NADH 的量与产生量直接相关,每个细胞所含的NADH 越多,所产生的能量越多,需要能量越多的器官,其所含的(或所需的)NADH 的量也越高。然而,本研究中的差异代谢的多条代谢通路过程中显示NADH 和肌苷下调,显示食管癌患者的代谢水平高,消耗严重,导致体内NADH 和肌苷明显下调,这可能是长时间能量代谢增强导致储备消耗的结果。但这种消耗是因为肿瘤本身的代谢因素所致还是食管癌患者长期不能进食导致的机体消耗所致的结果,目前难以明确,但NADH 的下调可以作为诊断和筛查的重要参考因素。

图4 代谢物含量均一性主成分分析图Fig.4 principal component analysis of metabolite con⁃tent homogeneity

图5 数据结果的火山图Fig.5 Volcano plot of data results

图6 PLSDA 得分图Fig.6 PLSDA shot chart
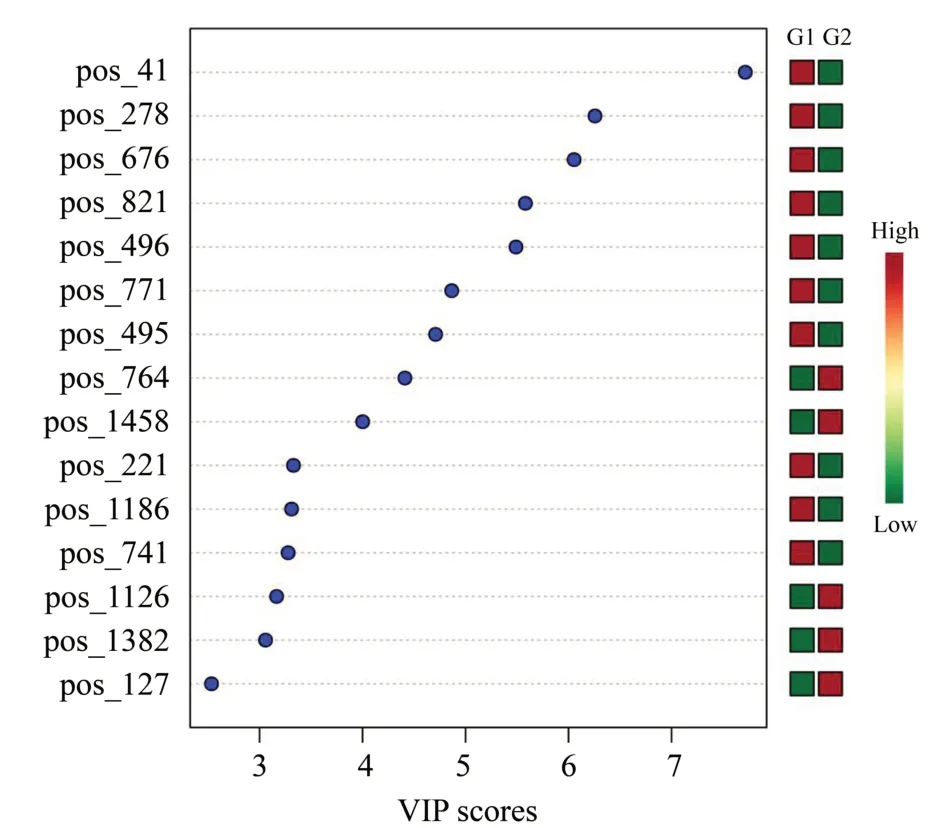
图7 VIP 值分布图表Fig.7 VIP value distribution chart
综上所述,尽管本研究作为小样本的实验研究,具有一定局限性,但结果仍显示食管鳞癌和正常对照组之间的血清代谢谱存在明显差异,主要表现在能量代谢上的过度消耗,值得进一步深入研究。

