泸州市COVID-19肝损伤特征及治疗效果分析
刘 菲,吴 刚,孙长峰,黄富礼,陈远芳
(西南医科大学附属医院感染病科/结核科/感染与免疫实验室,四川泸州 646000)
新型冠状病毒肺炎(COVID-19)是由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)感染引起的一种新发呼吸道传染病[1]。根据临床实践及文献报道,COVID-19可导致患者出现不同程度的肝功能异常[2-3],且病死率随着丙氨酸氨基转移酶(ALT)水平升高而增加[4]。因此,明确COVID-19相关肝损伤的发病机制,了解不同程度肝损伤患者临床特点及保肝药物的治疗效果,对于制订适宜治疗方案具有重要意义。截至2020年3月,泸州市传染病定点医院共收治24例COVID-19确诊患者,20例出现了不同程度的肝功能相关指标异常。本文根据肝功能损伤的不同程度来描述COVID-19患者的临床特征,分析COVID-19患者合并肝功能异常的可能原因,并总结加用异甘草酸镁注射液治疗后患者肝功能相关指标的变化,以为COVID-19肝损伤的机制研究及治疗提供一定的临床依据。
1 资料与方法
1.1 一般资料
纳入2020年1-3月泸州市COVID-19定点医院收治的确诊COVID-19患者24例,诊断标准及临床分型参考《新型冠状病毒感染的肺炎诊疗方案(试行第七版)》[5]。本研究通过医院医学伦理委员会审核批准。根据肝功能相关指标升高的程度将出现肝功能异常的20例COVID-19患者分为肝功能异常轻度、中度、重度组。
1.2 方法
收集24例确诊为COVID-19患者的基本资料及肝功能相关指标:ALT,天门冬氨酸氨基转移酶(AST),碱性磷酸酶(ALP),γ-谷氨酰转肽酶(GGT),清蛋白(ALB),总胆红素(TBIL)。上述指标中任一项升高大于正常值上限(ULN)即诊断为COVID-19相关肝功能异常。并根据上述相关指标升高的不同程度将合并肝功能异常的COVID-19患者分为轻度、中度、重度组:轻度组为ALT或AST<2×ULN,且TBIL<1.5×ULN;中度组为2×ULN≤ALT或AST <3×ULN,和(或)1.5×ULN ≤TBIL<2×ULN;重度组为ALT或AST≥3×ULN,和(或)TBIL≥2×ULN。参考值范围根据本院检验科标准:ALT 7~40 U/L、AST 13~35 U/L、ALP 35~125 μmol/L、GGT 7~50 μmol/L、ALB 40~55 g/L、TBIL 5.1~28 μmol/L。所有确诊COVID-19的治疗方法均参考《新型冠状病毒感染的肺炎诊疗方案(试行第七版)》[5]。病程中出现ALT或AST≥2×ULN,或TBIL ≥ 1.5×ULN,3 d后复查上述指标仍无明显下降,且排除心、肾衰竭患者,加用异甘草酸镁注射液(150 mg,静脉滴注,1次/天)。分析COVID-19患者一般特征和出现不同程度肝功能异常的临床特征,以及部分患者加用异甘草酸镁注射液后肝功能生化指标的变化。
1.3 统计学处理
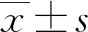
2 结 果
2.1 患者一般临床特征
泸州市定点医院共收治COVID-19确诊患者24例,均有COVID-19确诊患者接触史,年龄5~68岁,男13例(54.17%),女11例(45.83%)。临床症状主要为畏寒、发热、咳嗽、咳痰、气促、咽痛、流涕,少数伴有恶心、呕吐、食欲缺乏等消化道症状。重症肺炎4例,其余患者均为普通型肺炎。全部患者好转或治愈出院。合并糖尿病、陈旧性肺结核、高血压和(或)慢性乙型病毒性肝炎(CHB)等基础疾病患者7例,其中3例CHB患者均为HBeAg阴性患者,乙型肝炎病毒(HBV)DNA<103拷贝/mL,全程未进行抗病毒治疗。24例COVID-19患者病程中出现肝功能相关指标异常的共有20例(83.33%),多数患者肝功能相关指标呈轻微异常,可随病情好转自行恢复至正常范围,其中10例(41.67%)患者肝功能损伤较明显,满足保肝治疗的标准。在满足保肝治疗的10例患者中,1例重型肺炎患者因治疗过程病情加重,ALT短时间内从正常升高至大于3×ULN,予以机械通气、纠正呼吸衰竭,3 d后复查ALT恢复正常,考虑缺氧性肝炎,未加用任何特异性保肝药物;1例普通型肺炎患者因口服洛匹那韦/利脱那韦(200 mg,2次/天)后出现恶心、食欲缺乏等明显消化道症状,TBIL上升至60.58 μmol/L,考虑药物性肝损伤可能,停用抗病毒药物,加用谷胱甘肽注射液(1.2 g,静脉滴注,1次/天),3 d后复查TBIL降至正常;其余8例因3 d后复查肝功能无明显好转,加用异甘草酸镁注射液保肝治疗。
2.2 不同程度肝功能异常患者的临床特征
肝功能异常轻度、中度、重度组患者间的性别、年龄及预后比较,差异均无统计学意义(P>0.05)。合并糖尿病患者更易出现重度肝功能异常(P<0.05),而是否合并高血压、CHB及肺结核与肝损伤程度无明显相关性。重度组中重症肺炎占60.00%,明显高于轻、中度组,且与轻度组比较差异有统计学意义(P<0.05)。在肝功能生物化学的表现上,中、重度组患者的ALT、AST、GGT异常率高于轻度组(P<0.05),但3组患者TBIL、ALP升高水平比较差异无统计学意义(P>0.05),轻度组更多表现为TBIL稍微升高,重度组则多为ALT、AST同时升高,并伴ALB下降。且重度组的住院时间更长,见表1。
2.3 异甘草酸镁注射液治疗前后肝功能比较
8例患者加用异甘草酸镁注射液(150 mg 静脉滴注,每天 1次)保肝治疗,疗程为5~14 d。8例患者治疗后,ALT、AST、GGT水平均明显下降(P<0.05);TBIL水平治疗后稍有改善,但治疗前后比较差异无统计学意义(P>0.05),见表2。

表1 不同程度肝损伤特征分析

表2 患者治疗前后肝功能相关指标比较
3 讨 论
SARS-CoV-2与SARS-CoV及中东呼吸综合征(MERS) 冠状病毒感染的病理特征类似,均通过血管紧张素转换酶2(ACE2)受体感染人体细胞[6],ACE2 属于ACE家族的二肽基羧基二肽酶,广泛表达于动脉、静脉的内皮细胞,平滑肌细胞及胆管上皮细胞。HAMMING等[7]研究发现,ACE2蛋白在肺泡上皮及小肠上皮组织表达最为丰富。因此,SARS-CoV-2主要造成肺损伤,大多患者有咳嗽、咳痰、呼吸困难等典型的呼吸系统症状,8.0%~12.9%的患者会有腹泻表现[6],粪便中也可检测到SARS-CoV-2 RNA,同时也会累及肝、心、肾等器官。根据现有的临床数据,COVID-19患者病程中的肝功能异常率为14.0%~55.0%[4],首例COVID-19患者肝脏活检结果显示,肝细胞呈中度微血管脂肪变性、灶性坏死伴中性粒细胞浸润,肝血窦充血,汇管区见淋巴细胞和单核细胞浸润,微血栓形成,胆囊高度充盈[8]。但其潜在机制尚未明确,目前认为病毒直接作用、全身炎性反应、缺血缺氧再灌注损伤、药物作用均是可能原因[9]。此外,COVID-19患者CD4 T细胞中高度促炎性趋化因子受体(CCR)4、CCR6、辅助性T细胞17(Th17)水平升高,以及CD8 T细胞中高水平的细胞毒性颗粒,提示T细胞处于过度激活状态[8],这说明免疫损伤也可能是造成肝功能异常不可忽略的因素[10]。临床资料显示,COVID-19相关的肝损伤主要表现为ALT和(或)AST的轻度升高,而反映胆管损伤的ALP及GGT无明显异常[11-12],因此,关于病毒通过ACE2阳性的胆管上皮细胞直接损伤肝脏的机制尚存在一定的争议。但本研究中,患者出现TBIL和GGT的异常率较高,因此,本研究更倾向于SARS-CoV-2可直接损伤肝脏胆管上皮细胞,但毒性作用轻微。此外,也可能与SARS-CoV-2感染的非特异性炎症相关。
ALT、AST是肝细胞损伤的主要标志物[13],本研究通过对肝功能异常程度进行分层分析发现,轻度组的患者ALT、AST、GGT异常率不高,且可以随着COVID-19的好转而自行恢复,而中、重度组的患者更多表现为ALT、AST、GGT等多项肝生物化学指标异常,这提示后者可能存在真正的肝损伤,需要密切监测肝功能相关指标变化,及时予以保肝治疗。COVID-19重症患者与肝损伤关系密切[10,14-15]。一项大样本队列研究,通过分析1 099例中国COVID-19确诊病例发现,病程中ALT、AST升高大于ULN的总发生率分别为21.32%、22.20%,而重症患者ALT、AST升高的发生率上升至28.15%、39.43%[11]。本研究从肝生物化学异常程度的角度分析,发现随着肝功能异常程度的增加,重症肺炎的比例也在上升。目前认为重度肝功能异常多是继发于重症肺炎所致,因此,对于这部分患者,治疗上应重点关注原发疾病的处理,在纠正缺氧、抑制炎症风暴、调节免疫的基础上,合理加用保肝药物。
异甘草酸镁注射液是临床常用的甘草酸制剂,主要成分18α异构体草酸,是一种肝细胞保护剂,具有抗炎、保护肝细胞膜、调节免疫的作用[16]。对于以肝细胞损伤为主的COVID-19相关肝损伤,异甘草酸镁注射液理论上具有良好的效果。本研究中8例肝损伤明显的患者均以ALT、AST、GGT升高为主,加用异甘草酸镁注射液保肝治疗后,ALT、AST、GGT均有明显改善,提示该药物对COVID-19肝损伤有较好的效果。因此,对无禁忌证的COVID-19患者,病程中出现以ALT、AST、GGT升高为主要表现的中、重度肝功能异常,可加用异甘草酸镁注射液保肝治疗。
综上所述,COVID-19合并肝损伤发生率较高,病因是多方面的,因此,应根据患者的一般情况及出现肝功能异常的程度,个体化地给予干预。根据本研究的结果推断,异甘草酸镁注射液对于中、重度COVID-19相关的肝功能异常有较好的降酶效果。但本研究样本量较小,且为单中心研究,存在一定的局限性,还需要进一步研究证实。

