走进工艺流程中的“pH的调节”
云南
(作者单位:云南省富源县第一中学)
高中化学工艺流程题得分率较低,尤其是结合试题情境分析并计算最佳pH,学生虽然已掌握知识点,但不会正确运用。所以,除了解基本知识以外更需掌握解题技巧,该类试题考查形式多样,常结合实际应用进行考查,因此同学们觉得题目难度较大。本文中笔者反思总结了化学工艺流程中pH控制的几种情况,并通过典型例子对调节pH的原理、方法及作用进行简单的分析,力求突破该类试题中pH控制的瓶颈,提高学生的化学核心素养。
一、考点整合
1.为什么要调pH?
(1)调节pH中和酸或碱,抑制离子的水解
②盐溶液的配制
配制FeCl3溶液:将FeCl3固体先溶于盐酸中,再用蒸馏水稀释,抑制Fe3+水解。
配制Al2(SO4)3溶液:加入少量的稀硫酸,抑制Al3+水解。
配制Na2S溶液:加入少量的氢氧化钠固体,抑制S2-水解。
③溶液加热蒸干
要从溶液中得到AlCl3、MgCl2、FeCl3晶体,必须在蒸发AlCl3、MgCl2、FeCl3溶液的过程中不断通入HCl气体,以抑制金属离子的水解。
(2)调节pH除去相应的杂质离子
已知常温下,几种氢氧化物开始沉淀和完全沉淀时的pH如表1所示:

表1 常见阳离子开始沉淀及完全沉淀的pH
Cu2+的溶液中含有Fe3+的杂质,若要除尽Fe3+,需要调节溶液的pH在3.7~5.2之间。
Zn2+的溶液中含有Cu2+的杂质,若要除尽Cu2+,需要调节溶液的pH在6.7~8之间。
若要除去Zn2+溶液中含有的Fe2+,由于Fe2+沉淀完全时Zn2+也会沉淀,需先用氧化剂将Fe2+氧化为Fe3+,再调节溶液的pH在3.7~8之间。
(3)调节pH防止发生副反应
制取溴乙烷的原理为
浓硫酸吸收反应中生成的水,平衡正向移动,促进体系内副反应发生,致使目标产物产量降低。
(4)调节pH防止工业污染
一些工业废水含浓度较高的硫酸,需用氢氧化钠去中和硫酸,调节溶液pH呈中性,防止水体污染。
废水中含有磷酸盐,用氢氧化钙调节溶液呈中性,防止污染。
2.怎样调节pH?
调节pH所需的物质一般应满足两点:既能使溶液pH增大或减小,又不引入新的杂质。控制溶液pH的一般方法如下:

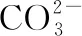
(3)加不溶物。加入物质一般为金属氧化物、氢氧化物、碳酸盐、碳酸酸式盐、碳酸碱式盐等。这些物质能与H+反应且难溶于水,优点为即使过量也不会引入新的杂质离子。
(4)加入某种试剂,使杂质离子变为沉淀除去。调节溶液的酸碱性,使金属离子形成氢氧化物沉淀析出(或抑制水解)不引入新杂质。例如:若要除去Cu2+中混有的Fe3+,可加入CuO、CuCO3、Cu(OH)2、Cu2(OH)2CO3等物质来调节溶液的pH,避免引入新的杂质,一般不用NaOH溶液、氨水等来调节。
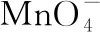
3.调节pH除杂,pH如何计算?
以Fe3+为例,已知,室温下Ksp[Fe(OH)3]=4.0×10-38。
开始沉淀时的pH计算:
假设Fe3+的起始浓度c(Fe3+)=0.1 mol·L-1,先根据Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-)计算出c(OH-),再根据Kw=c(H+)·c(OH-) 得出pH=2.7。
完全沉淀(溶液中该离子的浓度小于10-5mol·L-1)时的pH计算:
假设c(Fe3+)=10-5mol·L-1时沉淀完全,计算方法如上得出pH=3.7。
即Fe3+开始沉淀时的pH=2.7,Fe3+完全沉淀时的pH=3.7。
二、例题赏析
【例1】(2020·全国卷Ⅲ·27节选)某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):

图1
溶液中金属离子开始沉淀和完全沉淀的pH如表2所示:
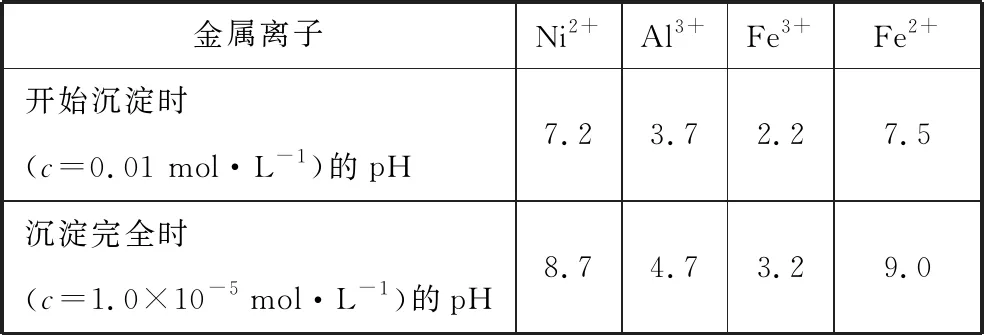
表2
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是________。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式____________________。
(2)“滤液②”中含有的金属离子是________。

(4)利用上述表格数据,计算Ni(OH)2的Ksp=______________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L-1,则“调pH”应控制的pH范围是________。
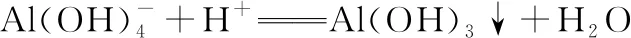
(2)Ni2+、Fe2+、Fe3+
(3)O2或空气 Fe3+
(4)10-5×(108.7-14)23.6~6.2
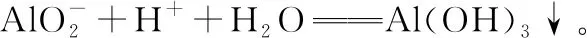
(2)加入稀硫酸酸浸,Ni、Fe及其氧化物溶解,所以“滤液②”中含有的金属离子是Ni2+、Fe2+、Fe3+。
(3)“转化”中H2O2的作用是将Fe2+氧化为Fe3+,可用O2或空气替代;若将工艺流程改为先“调pH”后“转化”,会使调pH过滤后的溶液中含有Fe2+,则滤液③中可能含有转化生成的Fe3+。

【例2】磷酸铁锂电池被广泛应用于各种电动汽车,其正极是通过将磷酸铁锂(LiFePO4)、导电剂、黏结剂和乙炔黑等按比例混合,再涂于铝箔上制成。一种从废旧磷酸铁锂电池正极材料中回收某些金属资源的工艺流程如图2:
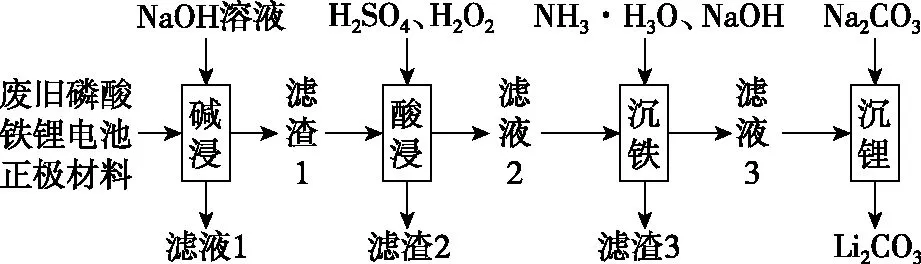
图2
已知:①常温下,Ksp[Fe(OH)3]=10-39;②Li2CO3的溶解度:0℃为1.54 g;100℃为0.72 g。
请回答:
(1)“沉铁”时,溶液的pH与金属元素的沉淀百分率(ω)的关系如表3:
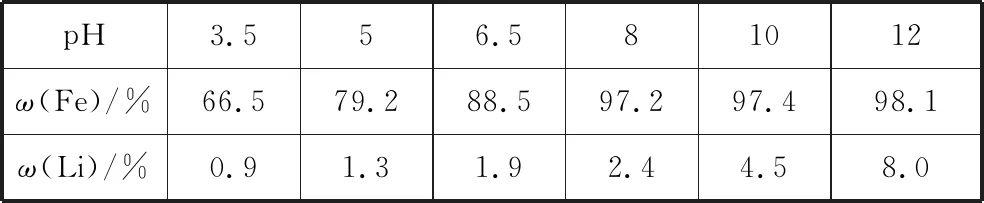
表3
则该过程应调节pH=________,其原因为____________________;假设该过程在常温下进行,则此时溶液中c(Fe3+)=________。
(2)“沉锂”时,所得Li2CO3应选择________(填“冷水”或“热水”)进行洗涤,判断Li2CO3已洗涤干净的操作和现象为____________________。
【答案】(1)8 Fe元素的沉淀百分率较大且Li元素的损失较小 10-21mol·L-1
(2)热水 取最后一次洗涤液少许,向其中滴加盐酸酸化的氯化钡溶液,若无沉淀生成,则证明已洗涤干净
【解析】(1)由题表可知,pH=8时,Fe元素的沉淀百分率较大且Li元素的损失较小,故应调节pH=8;Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-)=c(Fe3+)×(10-6)3=10-39,则c(Fe3+)=10-21mol·L-1。(2)由不同温度下碳酸锂的溶解度数据可知,应选择热水进行洗涤;取最后一次洗涤液少许,向其中滴加盐酸酸化的氯化钡溶液,若无沉淀生成,则证明已洗涤干净。
【例3】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如图3:
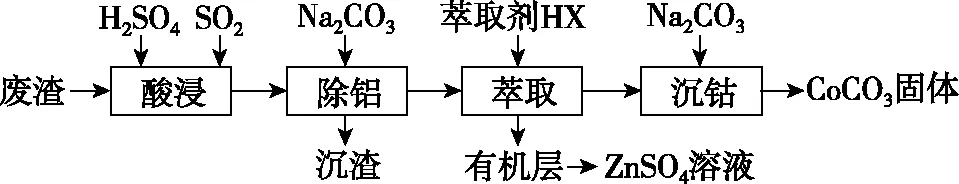
图3
表4是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
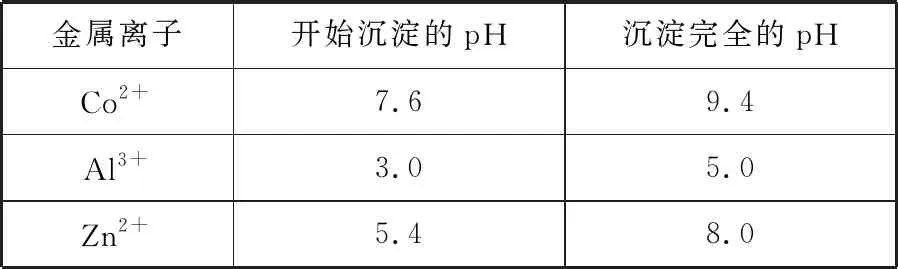
表4
(1)写出“酸溶”时发生氧化还原反应的化学方程式:____________________。
(2)“除铝”过程中需要调节溶液pH的范围为________,形成沉渣时发生反应的离子方程式为_________________________________。
(3)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因___________。

(2)5.0~5.4
(3)若Na2CO3溶液滴加过快会导致局部碱性过强而产生Co(OH)2沉淀,导致产品CoCO3中混有Co(OH)2



