健脾消癌方对缺氧微环境诱导的结肠癌细胞生物学行为影响及抑癌机制研究
宋琳 张利 蒋益兰
〔摘要〕 目的 研究健脾消癌方對缺氧微环境下结肠癌细胞生物学行为的影响,并探讨其抑癌机制。方法 将对数生长期的结肠癌SW620细胞随机分为健脾消癌方组(10%健脾消癌方的含药血清培养)和对照组(10%的空白血清培养),两组同时在缺氧环境下诱导培养14 d。采用Real-time PCR和Western blot检测两组结肠癌细胞低氧诱导因子-1α(HIF-1α)、VEGF、Bcl-2、Caspase-3、MMP-9、Survivin mRNA及蛋白的表达;MTT法检测细胞增殖;Transwell检测细胞迁移能力;流式细胞术检测细胞凋亡。结果 与对照组比较,健脾消癌方组结肠癌SW620细胞HIF-1α、VEGF、Bcl-2 mRNA和蛋白水平降低(P<0.05),Caspase-3 mRNA和蛋白水平升高(P<0.05);健脾消癌方组结肠癌SW620细胞在48、72、96 h时细胞存活率降低(P<0.01),迁移和穿透室膜细胞数降低(P<0.05),细胞凋亡率升高(P<0.05)。结论 健脾消癌方能下调缺氧微环境中结肠癌细胞HIF-1α水平,间接影响其下游靶基因的表达,抑制结肠癌细胞增殖、促进细胞凋亡、减弱细胞的迁移,发挥抗癌作用。
〔关键词〕 结肠癌;健脾消癌方;缺氧;低氧诱导因子-1α;生物学行为;抑癌机制
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.02.010
〔Abstract〕 Objective To investigate the effect of Jianpi Xiaoai Formula on the biological behavior of colon cancer cells in hypoxic microenvironment and to explore its possible mechanism. Methods SW620 colon cancer cells in logarithmic growth phase were randomly divided into the Jianpi Xiaoai Formula group (cultured with 10% Jianpi Xiaoai Formula serum) and the control group (cultured with 10% blank serum), both groups were induced and cultured in hypoxic environment for 14 days at the same time. Real-time PCR and Western blot were used to detect the expressions of hypoxia inducible factor-1α (HIF-1α), VEGF,Bcl-2, Caspase-3, MMP-9, Survivin mRNA in colon cancer cells of the two groups; MTT was used to detect cell proliferation; transwell was used to detect cell migration and invasion ability; flow cytometry was used to detect cell apoptosis. Results Compared with the control group, the mRNA and protein levels of HIF-1α, VEGF and Bcl-2 in SW620 colon cancer cells of the Jianpi Xiaoai Formula group decreased (P<0.05), Caspase-3 increased (P<0.05); the survival rate of SW620 colon cancer cells decreased at 48, 72 and 96 hours (P<0.01), the number of migrating and penetrating ependymal cells decreased (P<0.05), and the cells apoptotic rate increased (P<0.05) in the Jianpi Xiaoai Formula group. Conclusion Jianpi Xiaoai Formula can down-regulate the expression of HIF-1α in colon cancer cells in hypoxic microenvironment, indirectly affect the expression of its downstream target genes, inhibit the proliferation of colon cancer cells, promote cell apoptosis, reduce cell migration, so as to play an anti-cancer role.
〔Keywords〕 colon cancer; Jianpi Xiaoai Formula; hypoxia; hypoxia inducible factor-1α; biological behavior; anti-cancer mechanism
结肠癌是临床上常见的消化系统恶性肿瘤,其发病率和死亡率高居恶性肿瘤的第三位,根据中国癌症中心数据统计,我国结肠癌发病率占全球24.3%,死亡率占全球22.9%,并且呈逐年上升趋势[1]。目前,结肠癌治疗主要为手术辅以放化疗、基因治疗及分子靶向治疗等,其5年总体生存率仍不及50%[2],结肠癌已成为严重威胁人类健康的一类疾病。因此,研究结肠癌发病机制中的关键调控分子以及揭示侵袭转移机制,对结肠癌的防治具有重要的理论价值。研究表明肿瘤的发生发展、复发转移与肿瘤所处的微环境密切相关。由于恶性肿瘤异常的血管形成以及肿瘤细胞无限制的生长导致微环境中氧含量降低,即缺氧微环境。缺氧条件下可导致低氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)的积累,肿瘤细胞在HIF-1α的转录调控下适应低氧环境,并且通过激活靶基因使其在肿瘤发展、侵袭和转移中发挥重要作用[3-4],导致肿瘤常规治疗预后较差。因此,研究HIF-1α信号通道与肿瘤之间的关系尤为重要。
中医药具有多途径、多靶点的特点,可有效改善肿瘤微环境,从而诱导结肠癌细胞凋亡、抑制诱导肿瘤基因表达和癌症细胞迁移[5]。本课题组前期临床研究[6-7]表明,健脾消癌方治疗晚期结直肠癌能稳定瘤体、有效降低肿瘤标志物、提高患者生活质量、延长肠癌患者中位无进展生存期和中位总生存时间。
本文从分子生物学层面探讨健脾消癌方对结肠癌的抗癌机制,研究在缺氧微环境下健脾消癌方对SW620结肠癌细胞HIF-1α水平及下游靶基因VEGF、Bcl-2、Caspase-3、MMP-9、Survivin的影响,揭示其在缺氧微环境下的抗癌机制。
1 材料与方法
1.1 动物及细胞系
SPF级SD大鼠10只,1.5~2个月龄,体质量(200±20) g,雌雄各半,购自上海斯莱克实验动物有限公司,合格证号:SCXK(沪)2007-005。结肠癌SW620细胞系购自中科院上海细胞研究所(批号2018051233577),用RPMI-1640完全培养基(内含10%小牛血清,1%链青霉素),在CO2培养箱中传代培养。缺氧诱导条件:37 ℃,5% CO2,94% N2,培养14 d。
1.2 药物
健脾消癌方(甘草3 g,炒枳壳6 g,莪术10 g,法半夏10 g,党参15 g,白术15 g,茯苓15 g,淫羊藿15 g,郁金15 g,黄芪20 g,薏苡仁30 g,半枝莲30 g,灵芝30 g,重楼30 g,白花蛇舌草30 g)饮片符合2020年版《中华人民共和国药典》[8]规定的标准,购自江苏省中西医结合医院。将以上所有药按5倍量处方,加8倍量水浸泡30 min,煎煮1 h,过滤;再加6倍量水,煎煮1 h,过滤,合并两次滤液静置24 h,12 000 r /min离心15 min后将上清液浓缩至850 mL,4 ℃冷藏48 h,离心冷藏液得到约800 mL上清,灭菌后制成含生药2.1 g/mL的水煎剂备用。
1.3 主要试剂及仪器
胎牛血清(批号:P160704)、二甲亚枫(批号:35605-5G-F)均购自美国Sigma公司;胰酶消化液(批号:824300)、RPMI1640细胞培养液(批号:SA166734)购自美国Gibco公司;青霉素(批号:25465787)、链霉素(批号:5465687)、乙醇(批号:8754187)购自上海国药集团;DEPC、MTT试剂盒购自上海碧云天生物技术有限公司;RNA提取试剂盒(批号:SA1022,AB218110,AB23356)、RNA逆转录试剂盒购自日本TAKARA公司;SYBR GREEN试剂盒(批号:P160704,ST728)、Western blot一抗(批号:ab78334)购自美国ABI公司;Western blot二抗(南京建成生物科技研究所,批号:ab189075);Annexin V-FITC/PI细胞凋亡检测试剂盒(美国BD公司,批号:ab489075);Transwell小室(批号:ab889075)(美国康宁公司)。CKX41倒置显微镜(日本Olympus公司);Multiskan 全波長酶标仪(德国Thermo公司);QuantStudioTM 6 Flex荧光定量PCR系统(美国ABI公司);PowerPAC凝胶电泳仪(美国Bio-Rad公司);FACS AriaⅡ流式细胞仪(美国BD公司)。
1.4 健脾消癌方含药血清制备
参考文献[9]方法制备健脾消癌方药物和空白血清,SD 大鼠10只,雌雄各半,随机分成 2 组,每组5只。健脾消癌方组大鼠灌胃健脾消癌方[10.8 g/kg,相当于70 kg成年人等效量(120 g/d)],对照组按大鼠体质量灌胃等容积的生理盐水。每日1次,连续6 d,于第7天末次灌胃1 h后,10%水合氯醛(3 mL/kg)腹腔麻醉,腹主动脉取血,4 ℃保存,24 h内离心(2 000 r/min,10 min),吸取血清,用0.22 μm微孔滤膜过滤除菌,-20 ℃保存备用。
1.5 细胞分组与处理
将处于对数生长期的结肠癌SW620细胞用胰酶消化后,按1∶3扩大到2个培养皿中继续培养,每组设6个复孔,实验重复 3 次。将2个培养皿的细胞随机分为对照组和健脾消癌方组,其中对照组细胞用缺氧环境诱导培养14 d,同时用10%的空白血清培养,健脾消癌方组细胞用缺氧环境诱导14 d,同时用含10%健脾消癌方的血清培养。
1.6 观察指标及检测方法
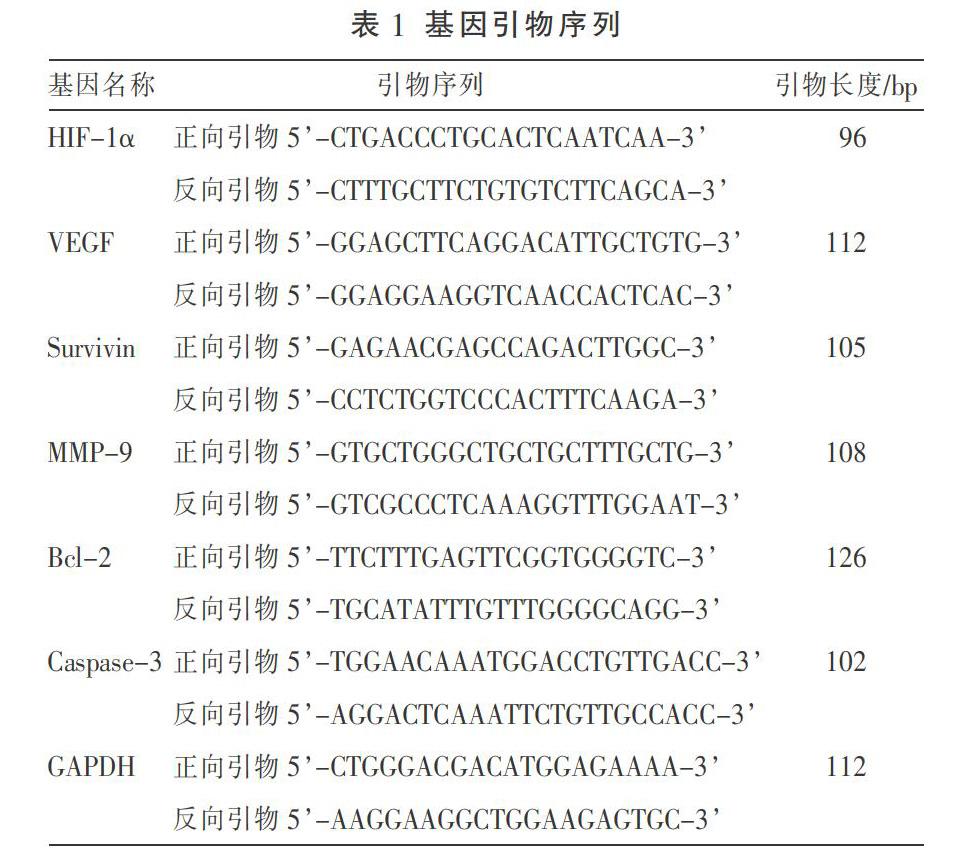
1.6.1 Real-time PCR法检测HIF-1α、VEGF、Bcl-2、Caspase-3、MMP-9及Survivin mRNA水平 收集细胞,Trizol提取各组细胞总RNA,并通过逆转录得到cDNA,设计并合成HIF-1、VEGF、Survivin、MMP-9、Bcl-2、Caspase-3及GAPDH定量引物,引物序列见表1。
1.6.2 Western blot法检测HIF-1α、VEGF、Bcl-2、Caspase-3、MMP-9及Survivin蛋白表达水平 用胰酶消化并收集处于对数生长期的结肠癌SW620细胞系。BCA法测定蛋白浓度,蛋白变性。取30 μg 蛋白经十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)分离蛋白,转膜至PVDF膜,5%(M/V)脱脂奶粉的封闭液中封闭2 h;用TBST洗膜3次后,加入用TBST按1∶500稀释的一抗,置于摇床4 ℃冰箱过夜;用TBST洗膜3次,每次5 min;将二抗用TBST按1∶1 000稀释后室温与膜接触,孵育2 h后,TBST洗膜3次;加ECL显影剂,用自动凝胶成像分析仪检测,用凝胶成像处理系统对目标条带的分子量和光密度值做处理分析。
1.6.3 MTT法检测结肠癌SW620细胞增殖活性 将处于对数生长期的结肠癌SW620细胞随机分为健脾消癌方组和对照组,给予相应干预后,调整细胞浓度按4×103/孔接种于96孔板培养12 h。两组各孔均分别加入含药培养液,培养67 h后,取出96孔板,每孔中加入MTT试剂20 μL,37 ℃ CO2培养箱孵育4 h。小心吸出各孔内液体,每孔加入150 μL DMSO,置摇床上避光孵育20 min,用酶标仪在490 nm波长处检测吸光度(OD)值,以对照组OD值为参数,计算细胞存活率。
1.6.4 Transwell细胞迁移实验检测结肠癌SW620细胞迁移 将处于对数生长期的结肠癌SW620细胞调整浓度后按4×105/孔接种于6孔板,随机分为健脾消癌方组和对照组。将细胞换成不完全培养液饥饿12 h,胰酶消化吸收细胞,PBS缓冲液洗涤3次,用不完全DMEM培养基稀释细胞调整密度为106/mL,在每孔上室加入150 μL细胞悬液,下室加入500 μL 10% DMEM完全培养液,置于37 ℃ CO2培养箱48 h后,从培养板中取出Transwell小室,吸出液体,PBS缓冲液洗涤小室3遍后,加入无水乙醇,放置30 min。将小室反扣于吸水纸上,室温干燥基底膜,用结晶紫染色10 min,流水漂洗3遍,于显微镜下观察,随机选取5个视野观察细胞并拍照,Image J软件计数细胞数值,结果以细胞数表示。
1.6.5 流式细胞术检测结肠癌SW620细胞凋亡 取Falcon管分为健脾消癌方组和对照组,将处于对数生长期的结肠癌细胞用0.25%胰酶消化,离心收集后用预冷的PBS漂洗2次,加1×缓冲液制成1×106/mL细胞悬液;每个Falcon管中加入100 μL细胞悬液,样本管同时加入AV-FITC和PI染料,同步设立阴性管(不加任何荧光抗体)和两只单阳管(分别加入AV-FITC和PI染料)震荡混匀后室温避光孵育20 min。用1×缓冲液洗涤细胞1次,弃上清;用100 μL 1×缓冲液溶解0.5 μg Sav-FITC加入Falcon管中,混匀。加入5 μL PI,室温避光孵育15 min。各管依次加入1×Binding缓冲液400 μL,1 h内用流式细胞仪检测实验结果。
1.7 统计学方法
采用SPSS 19.0 对数据进行分析,计量资料采用“x±s”表示,组间比较采用独立样本t检验,多组间比较用方差分析,P<0.05为差异有统计学意义。
2 结果
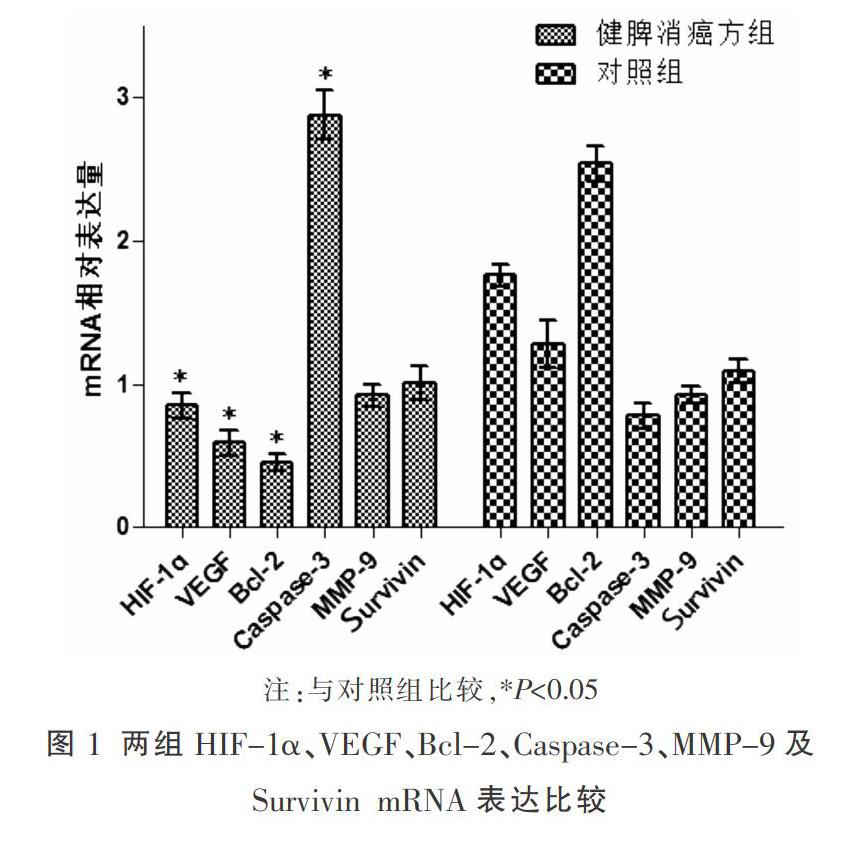
2.1 两组HIF-1α、VEGF、Bcl-2、Caspase-3、MMP-9及Survivin mRNA表达水平比较
与对照组比较,健脾消癌方组HIF-1α、VEGF及Bcl-2 mRNA表达降低(P<0.05),Caspase-3 mRNA表达升高(P<0.05)。见图1。
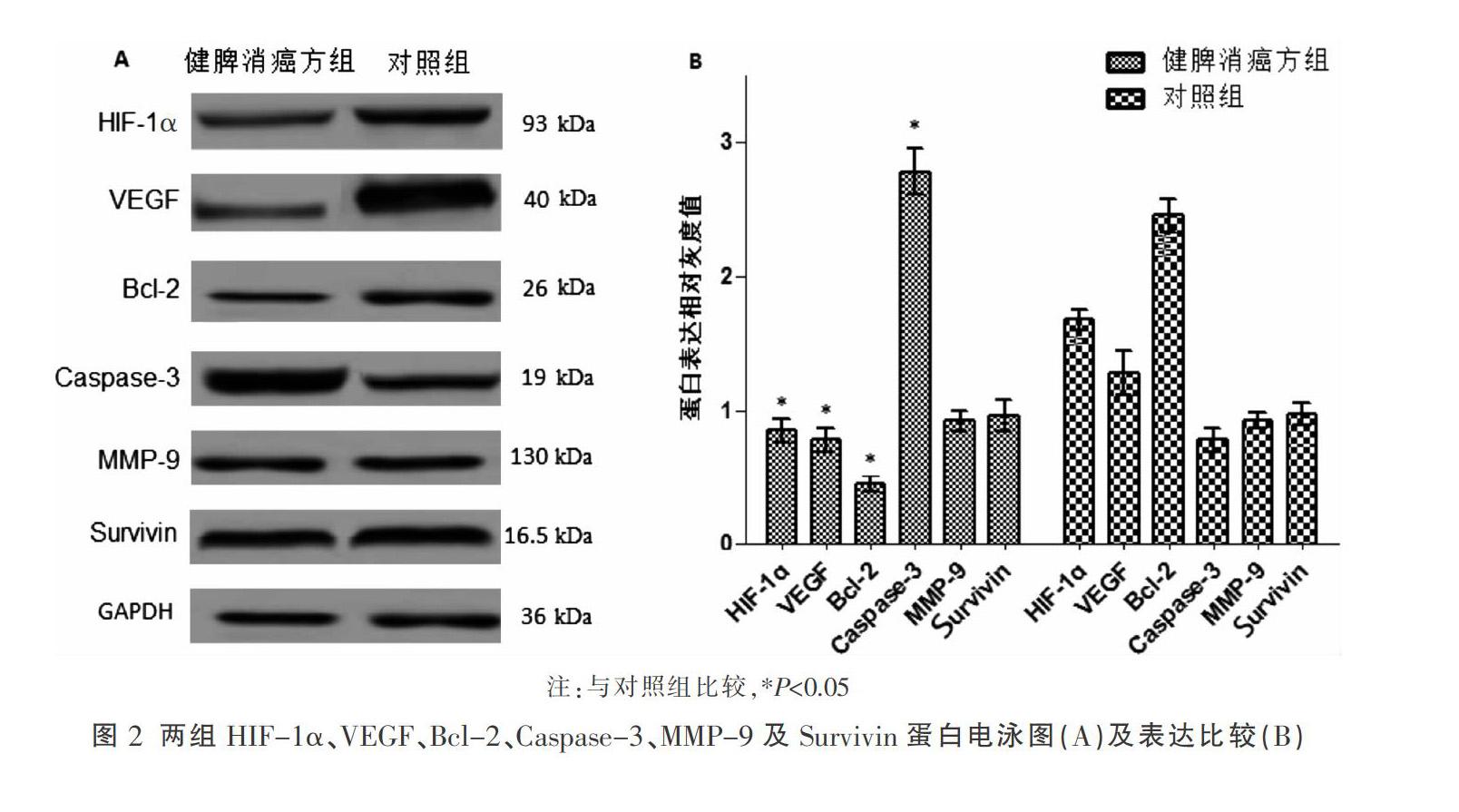
2.2 两组HIF-1α、VEGF、Bcl-2、Caspase-3、MMP-9及Survivin蛋白表达比较
与对照组比较,健脾消癌方组HIF-1α、VEGF及Bcl-2 蛋白表达降低(P<0.05),Caspase-3蛋白表達升高(P<0.05)。见图2。
2.3 两组SW620细胞存活率比较
第0、24、48、72和96时,健脾消癌方组结肠癌细胞的存活率分别为(99%±1%),(107%±2%),(101%±4%),(89%±5%)和(78%±6%),对照组结肠癌细胞存活率分别为(100%±1%),(112%±2%),(148%±8%),(179%±4%)和(203%±6%)。与对照组比较,健脾消癌方组第48、72、96小时SW620细胞存活率降低(P<0.01)。见图3。
2.4 两组SW620细胞迁移能力比较
倒置显微镜下可见对照组细胞数目较多,大小均一,分布均匀,细胞贴壁生长状态,折光性较好,增殖较快;而健脾消癌方组细胞数目较对照组细胞数目明显减少,细胞间连接减少,培养液中可见漂浮的细胞碎片,细胞形态呈皱缩、变小。结果显示健脾消癌方组迁移和穿透室膜的结肠癌细胞数为(72.8±4.3),对照组为(92.3±4.1),与对照组比较,健脾消癌方组迁移和穿透室膜的结肠癌细胞数降低(P<0.05)。见图4-5。
2.5 两组SW620细胞细胞凋亡率比较
健脾消癌方组结肠癌细胞的凋亡率(16.22%± 1.07%),高于对照组(5.17%±0.56%)(P<0.05)。见图6。
3 讨论
《素问·评热病论》曰:“邪之所凑,其气必虚”。《素问·六微旨大论》曰:“物之生从于化,物之极由乎变”,论述了阴阳转化之极致状态。由此,机体产生肿瘤之原因在于环境之变化导致阴阳格拒而成,包括内环境与外环境,中医肿瘤辨证论治的实质就是干预肿瘤微环境[10]。
缺氧是实体瘤客观存在的微环境,贯穿与肿瘤发生发展的全过程。研究表明,肿瘤细胞在缺氧微环境中不但能继续存活,还能通过一系列机制继续生长、逃脱缺氧应急损伤,调控血管生长、能量代谢等使自身适应缺氧环境,这在肿瘤的发生和恶性进展中扮演重要角色[11-13]。HIF-1α是一种缺氧环境中诱导细胞产生应答的转录因子,进入细胞核与特定启动子的反应元件结合后,能调控上百种靶基因的表达,从而对细胞适应缺氧环境起调控作用,其中包括VEGF[14]、MMP-9[15]、Survivin[16]、Caspase-3[17]、Bcl-2[18]等。VEGF是已知最强的血管渗透剂,能提高血管尤其是微小血管的通透能力,为瘤细胞生长和毛细血管网建立提供物质支持,对于预测肿瘤生长增殖、侵袭转移、临床预后等有重要意义[14]。MMPs是一类Zn2+、Ca2+依赖性内肽酶家族,能降解并破坏细胞外基质或基膜,MMPs能调控细胞增殖、凋亡、侵袭和转移、血管生成等[15]。Survivin蛋白是凋亡抑制蛋白家族中分子量最小的成员,定位于人类染色体17q25上,由3个内含子和4个外显子组成,它能通过蛋白酶依赖途径调控细胞凋亡[16]。Caspase是一类在线粒体途径的细胞凋亡过程中起着极其重要的作用的半胱氨酸天冬氨酸特异性蛋白酶,在凋亡诱导信号的作用下结合特异辅因子后激活,进而激活下游效应型Caspase,通过裂解特异性底物及激活内源性核酸酶,最终使细胞呈现典型的凋亡形态和生化特征,发生不可逆的死亡[17]。Caspase和Survivin之间关系密切,Survivin是一种多功能蛋白,能通过Caspase蛋白酶依赖途径调控细胞凋亡[19]。Bcl-2家族蛋白是细胞生长的关键调节因子,其家族成员间通过精准的平衡调控细胞的增殖和凋亡,Bcl-2基因及其编码的蛋白能抑制细胞凋亡,因此又称为凋亡抑制基因[18]。
中医学认为,结肠癌多由于“虚”“毒”“瘀”相互作用、相互影响而形成。健脾消癌方是湖南名医蒋益兰教授根据多年临床经验以“益气健脾,化瘀解毒”为法创制而成,健脾消癌方以黨参、薏苡仁益气健脾,以健生化之源,而疗诸虚不足,从而扶正固本;郁金、莪术活血化瘀,白花蛇舌草、半枝莲清热解毒、散结消痈,全方配伍攻补兼施,共奏益气健脾,化瘀解毒之功。健脾消癌方在降低结肠癌术后复发转移率,延长生存期,改善晚期结肠癌患者临床症状,提高生活质量、稳定瘤体、调节免疫因子CD4+ CD25+调节性T细胞等方面具有明显优势[7,20]。并且前期实验也通过TGF-β/LncRNA-ATB/miR-200a信号通路[21]及Wnt/β-catenin信号通路[22]证实健脾消癌方通过多环节、多靶点起到抗肿瘤的作用。
本实验在缺氧环境下诱导结肠癌SW620细胞,同时用健脾消癌方含药血清培养14 d后,采用定量Real-time PCR检测SW620细胞中HIF-1α mRNA和蛋白表达情况,结果提示健脾消癌方能抑制缺氧诱导的结肠癌细胞高表达HIF-1α;进一步实验发现HIF-1α下游靶基因发生了相应表达变化,其中VEGF、Bcl-2水平较对照组降低,Caspase-3较对照组升高;MMP-9、Survivin水平较对照组略有降低,但在本次实验中表达差异无统计学意义,可能是由于健脾消癌方引起的HIF-1α下调的程度不足以引起其下游靶基因MMP-9、Survivin表达产生统计学差异。本次研究也证实健脾消癌方能抑制缺氧微环境中结肠癌细胞HIF-1α的表达,进而引起下游一些促癌因子VEGF、Bcl-2表达降低,而抑癌因子Caspase-3表达升高,发挥抗癌效应。
本研究观察了健脾消癌方处理的结肠癌细胞生物学行为。健脾消癌方干预下,缺氧微环境中结肠癌SW620细胞在MTT实验的第0、24、48、72、96小时,细胞存活率分别为99%,107%,101%,89%和78%,整体生存曲线在对照组下方,其中在48、72和96 h 3个时间点上,健脾消癌方干预的SW620细胞存活率较对照组降低。并且健脾消癌方干预的SW620细胞凋亡率明显高于对照组,表明健脾消癌方能抑制缺氧微环境中结肠癌细胞增殖,促进细胞凋亡,发挥对结肠癌的治疗作用。Transwell实验证实了健脾消癌方干预的缺氧结肠癌SW620细胞的迁移和穿透小室的能力较对照组降低,说明健脾消癌方能抑制缺氧环境中结肠癌细胞的迁移。
综上所述,健脾消癌方能抑制缺氧环境下结肠癌SW620细胞增殖,促进细胞凋亡,减弱细胞迁移和侵袭能力,从而发挥抗癌作用。
参考文献
[1] CHEN W Q, SUN K X, ZHENG R S, et al. Cancer incidence and mortality in China, 2014[J]. Chinese Journal of Cancer Research, 2018, 30(1): 1-12.
[2] SINGH D, LUN J, LIU X, et al. The long-term survival benefits of high and low ligation of inferior mesenteric artery in colorectal cancer surgery: A review and meta-analysis[J]. Medicine, 2017, 96(47): 85-91.
[3] 马 萌.肿瘤微环境及其中医证本质—中医现代化路径之探索[J]. 中华中医药杂志,2018,33(6):2255-2261.
[4] WANG M, ZHAO X, ZHU D, et al. HIF-1αpromoted vasculogenic mimicry formation in hepatocellular carcinoma through LOXL2 up-regulation in hypoxic tumor microenvironment[J]. Journal of Experimental Clinical Cancer Research, 2017, 36(1): 60-64.
[5] 吴 皞,王瑞平,陈 雪,等. 基于肿瘤微环境学说的中医抗癌策略探讨[J].四川中医,2018,36(6):50-53.
[6] 王容容,王其美,蒋益兰,等.健脾消癌方联合化疗治疗晚期转移性结直肠癌的临床研究[J].中华中医药杂志,2016,31(5):1732-1736.
[7] 蒋益兰,俞天俊,赵 晔.健脾消癌方治疗老年中晚期大肠癌临床观察[J].中国中医信息杂志,2014,21(3):94-96.
[8] 国家药典委员会. 中华人民共和国药典·一部[S].北京:中国医药科技出版社,2020:315-325.
[9] 张 宏,王旭昀,刘美奇,等.中药含药血清实验动物灌胃给药剂量探讨[J].吉林中医药,2015,35(6):623-625.
[10] 沈佳雯,罗 会,宁 倪,等.近年中药治疗结肠癌的药理作用研究进展[J].中华中医药杂志,2017,35(10):2336-2344.
[11] KUMAR R, KIM EJ, HAN J, et al. Hypoxia-directed and activated theranostic agent: Imaging and treatment of solid tumor[J]. Biomaterials, 2016, 104: 119-128.
[12] IKEDA Y, HISANO H, NISHIKAWA Y, et al. Targeting and treatment of tumor hypoxia by newly designed prodrug possessing high permeability in solid tumors[J]. Mol Pharm, 2016, 13(7): 2283-2289.
[13] RAMACHANDRAN S, IENT J, GOTTGENS E L, et al. Epigenetic therapy for solid tumors: highlighting the impact of tumor hypoxia[J]. Genes, 2015, 6(4): 935-956.
[14] GUAEL D, DURSUN A D, FICICILAR H, et al. Effect of intermittent hypoxia on the cardiac HIF-1/VEGF pathway in experimental type 1 diabetes mellitus[J]. Anatolian Journal of Cardiology, 2016, 16(2): 76-83.
[15] GAO P, ZHU Y, LING F, et al. Nonischemic cerebral venous hypertension promotes a proangiogenic stage through HIF-1
downstream genes and leukocyte-derived MMP-9[J]. Journal of Cerebral Blood Flow Metabolism, 2009, 29(8): 1482-1490.
[16] LI Y, XIA ZL, CHEN LB. HIF-1α and survivin involved in the anti-apoptotic effect of 2ME2 after global ischemia in rats[J]. Neurological Research, 2011, 33(6): 583-592.
[17] HOECKE M V, PRIGENT-TESSIER A S, GARNIER P E, et al. Evidence of HIF-1 functional binding activity to caspase-3 promoter after photothrombotic cerebral ischemia[J]. Molecular and Cellular Neuroence, 2007, 34(1): 40-47.
[18] YANG C C, LIN L C, WU M S, et al. Repetitive hypoxic preconditioning attenuates renal ischemia/reperfusion induced oxidative injury via upregulating HIF-1 alpha-dependent bcl-2 signaling[J]. Transplantation, 2009, 88(11): 1251-1260.
[19] WU S, ZHOU Y, YANG G X, et al. Sulforaphane-cysteine induces apoptosis by sustained activation of ERK1/2 and caspase 3 in human glioblastoma U373MG and U87MG cells[J]. Oncology Reports, 2017, 37(5): 2829-2838.
[20] 蔣益兰,潘敏求,蔡 美.健脾消癌饮配合化疗拮抗大肠癌术后复发转移62例总结[J].湖南中医杂志,2007,23(1):1-3.
[21] 罗 吉,罗 燕,李勇敏,等.健脾消癌方对结肠癌TGF-β/LncRNA-ATB /miR-200a信号通路的影响[J].中国实验方剂学杂志,2018,24(6):161-166.
[22] 杨 晓,唐 蔚,蒋益兰,等.健脾消癌方对人结肠癌HCT116细胞周期、凋亡及Wnt/β-catenin信号通路相关因子的影响[J].中国中医药信息杂志,2018,25(6):61-65.

