生根剂GGR-6对紫羊茅和草地早熟禾响应干旱胁迫的影响
王竞红,陈 艾,张 雯,赵 艺,田静瑶,王贞升,徐谷丹,蔺吉祥
(1东北林业大学园林学院,哈尔滨 150040;2北方航空护林总站,哈尔滨 150040)
0 引言
干旱对植物的生长发育以及农业生产具有重要的影响。草坪草在城市生态系统中尤为重要,它们维持体内水分平衡的途径也多种多样,且机制各不相同[1]。一般来说,草坪草的抗旱类型分为避旱性和耐旱性两种[2],避旱性是指草坪草在干旱胁迫下通过根系深层次扎根或在形态、内部生理上低蒸散耗水等来避免组织的损害,呈现出矮生、叶肉质化、表皮层角质化的特征[3]。耐旱性是指草坪草通过生理代谢的过程来忍受干旱的能力[4],耐旱性强的草坪草可以通过渗透调节来维持水分平衡,或者通过改变原生质与细胞膜的状态进而提高抗旱性,还可以通过自身的生理生化调节作用来提高保护酶的活性,从而减轻逆境胁迫对植物细胞的伤害。当草坪草处于干旱初、中期时,上述2种抵御干旱胁迫的方式会同时存在,而伴随着干旱胁迫的进一步加重,草坪草的根系增大、降低蒸散率则成了草坪草抗旱的主要方式[5-11]。
生根剂GGR-6是一种可以调控植物内源激素含量和酶活性的复合型植物生长调节剂,它可以促进生物大分子的合成和植物根系的生长,提高育苗成活率,改善植物根系形态特征,增强植物的抗性[12]。已有研究表明,施加GGR-6后,无忧花(Saracadives)叶片中叶绿素、可溶性糖及游离脯氨酸含量呈现先增加后减小的趋势,超氧化物歧化酶(SOD)活性呈现先下降后增加的趋势[13]。另外,GGR-6还能够显著影响植物体的细胞增殖,并改善生根情况[14-15]。紫羊茅(Festuca rubra)抗寒、耐旱、耐荫和耐贫瘠土壤能力都很强,叶片呈纤细的针状,株丛致密。紫羊茅在逆境胁迫下,通过添加外源物质可缓解其受害程度[16-17]。草坪草早熟禾(Poaannua)是多年生冷季型根茎疏丛型禾草,叶色浓绿、叶形和株型优美,是世界公认的优质草种,因其形成的草皮结实而富有弹性,故广泛应用于城市绿地、公园、庭院等草坪绿化[18-19]。
本试验以紫羊茅和早熟禾为试验材料,分别于不同时期进行浇灌不同浓度的生根剂GGR-6溶液,以期明确GGR-6施用后对草坪草耐旱能力的影响效应,评价3个施用周期下不同浓度GGR-6处理对草坪草在干旱胁迫下的生理指标的影响。从植物生理学角度探讨在干旱胁迫下浇灌生根剂GGR-6后草坪草的生理适应反应,确定紫羊茅和早熟禾的GGR-6最佳浇灌周期和浓度。
1 材料方法
1.1 材料与设计
供试草坪草为哈尔滨碧丰草业有限公司提供的紫羊茅‘梦神’(Festucarubra‘Rubra’),草地早熟禾‘优异’(Poapratensis‘Merit’)。供试药剂为生根剂双吉尔GGR-6号(中国林业科学院生产)。
试验在东北林业大学温室中于2018年进行,选用170×150×125 mm规格的塑料花盆进行育苗培养。培养基质选用全蛭石高温灭菌消毒后,统一称取蛭石重量430 g。实验用草坪草种子经过筛选后,用1%高锰酸钾溶液进行消毒,晾干后,称取种子3.5 g/盆,浸种3 h后进行播种,出苗前的培育期内每隔3天用300 mL水浇灌。每次浇水后称量盆重,保证土壤水分质量相同。生根剂喷施时间于播种后1周[4月2日(W1)]、播种后2周[4月9日(W2)]、播种后3周[4月16日(W3)]分批处理,处理时每隔3天浇生根剂300 mL,渗出液4 h后回倒入盆内。处理3次后正常浇水生长,每周施加1次100 mL Hoagland’s营养液。干旱胁迫实验组各组处理时间见表1,GGR-6浓度梯度设置为0(A)、0.1 g/L(B)、0.2 g/L(C)和0.3 g/L(D),每个处理5次重复。

表1 干旱胁迫实验组各组处理时间
1.2 指标测定方法
干旱结束统一取样,采用硫酸巴比妥酸(TBA)显色法测定丙二醛(MDA)含量,采用氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)活性[20],参照李合生的愈创木酚法[21]测定过氧化物酶(POD)活性,参照李龙等[22]的方法测定游离脯氨酸(Pro)的含量。各处理每次测定重复3次。
1.3 数据分析
用Excel处理实验数据,利用SPSS 20.0统计软件进行方差分析,结果用平均数±标准误差表示,显著水平为P<0.05。
2 结果与分析
2.1 GGR-6对不同干旱胁迫周期下紫羊茅和早熟禾叶片丙二醛(MDA)含量的影响
随着干旱胁迫的进行,紫羊茅和早熟禾叶片MDA含量均呈逐渐上升趋势。紫羊茅、早熟禾叶片的MDA含量在干旱处理6天时与对照组相比出现显著上升(P<0.05)。随干旱胁迫的继续进行,2种草坪草的MDA积累量差异逐步扩大。与对照组相比,干旱胁迫15天时,紫羊茅的MDA含量增幅2.19%,早熟禾的MDA含量增幅1.45%,表明随着干旱胁迫程度的加剧,早熟禾的MDA含量增幅较小。
紫羊茅的MDA含量随干旱的进行呈上升趋势,均显著大于对照(P<0.05),在GGR-6浓度0、0.1、0.2、0.3 g/L下,W1施用周期的MDA含量分别是对照的2.37、1.64、1.63、1.96倍;W2下分别是对照的 2.46、1.94、1.82、2.83倍;W3下分别是对照的 3.26、3.29、2.26、3.17倍。W3时期施用GGR-6产生的MDA积累均大于2倍,紫羊茅需要较早的施用GGR-6。未施加GGR-6时MDA积累量均为对照的2倍以上,表明GGR-6的处理延缓了干旱导致的紫羊茅叶片膜脂的过氧化,在GGR-6浓度为0.1 g/L、0.2 g/L时MDA积累量增幅较小,表明此浓度的GGR-6能较好地缓释干旱造成的紫羊茅代谢紊乱(表2)。早熟禾MDA含量同样随干旱的进行呈上升趋势,均显著大于对照(P<0.05),但相对紫羊茅而言,早熟禾MDA含量相较于对照的上升幅度较低,表明其抗旱性较强。W1、W2下施加低浓度GGR-6(0.1 g/L)有效缓解了早熟禾叶片的膜系统损伤,而W3下,高浓度GGR-6(0.3 g/L)的作用效果更为显著(表3)。
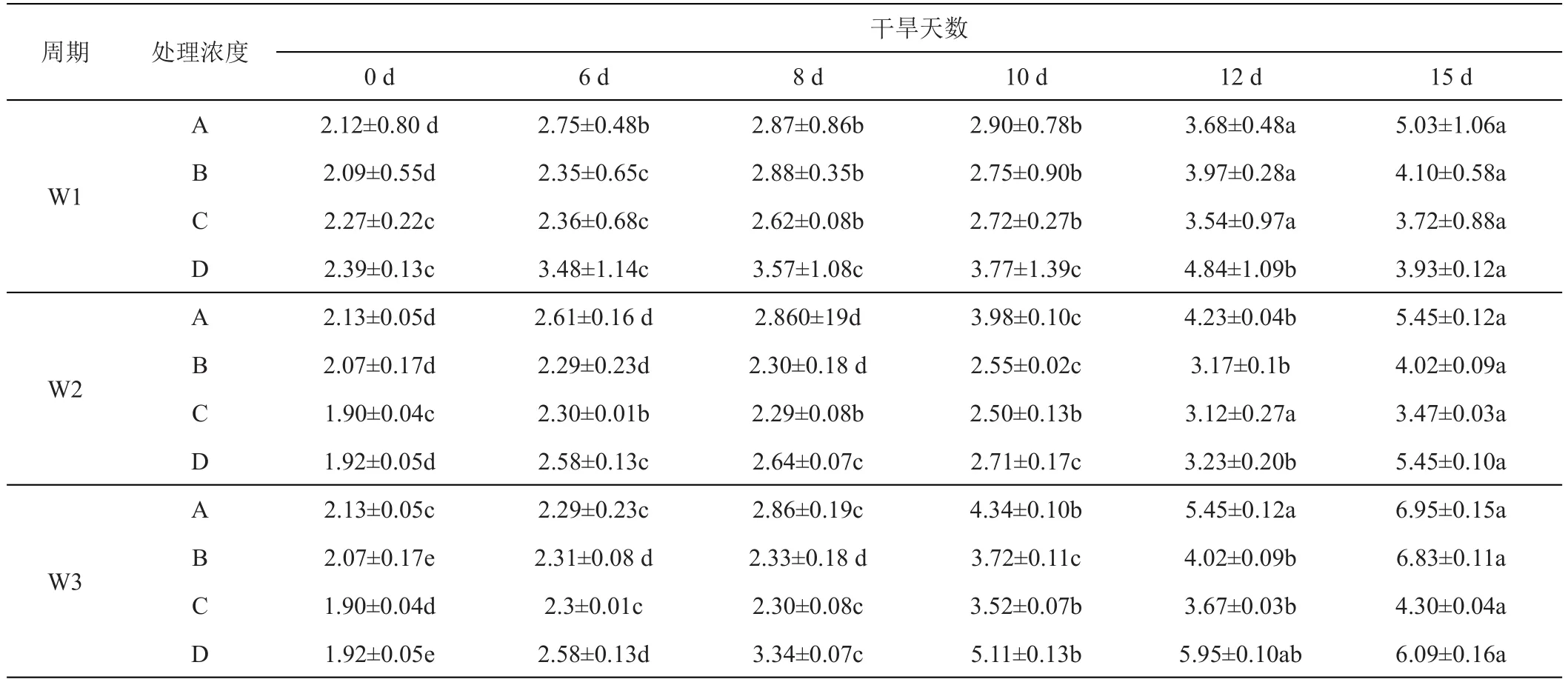
表2 GGR-6和时间变化对紫羊茅‘梦神’不同干旱胁迫时期丙二醛含量的影响
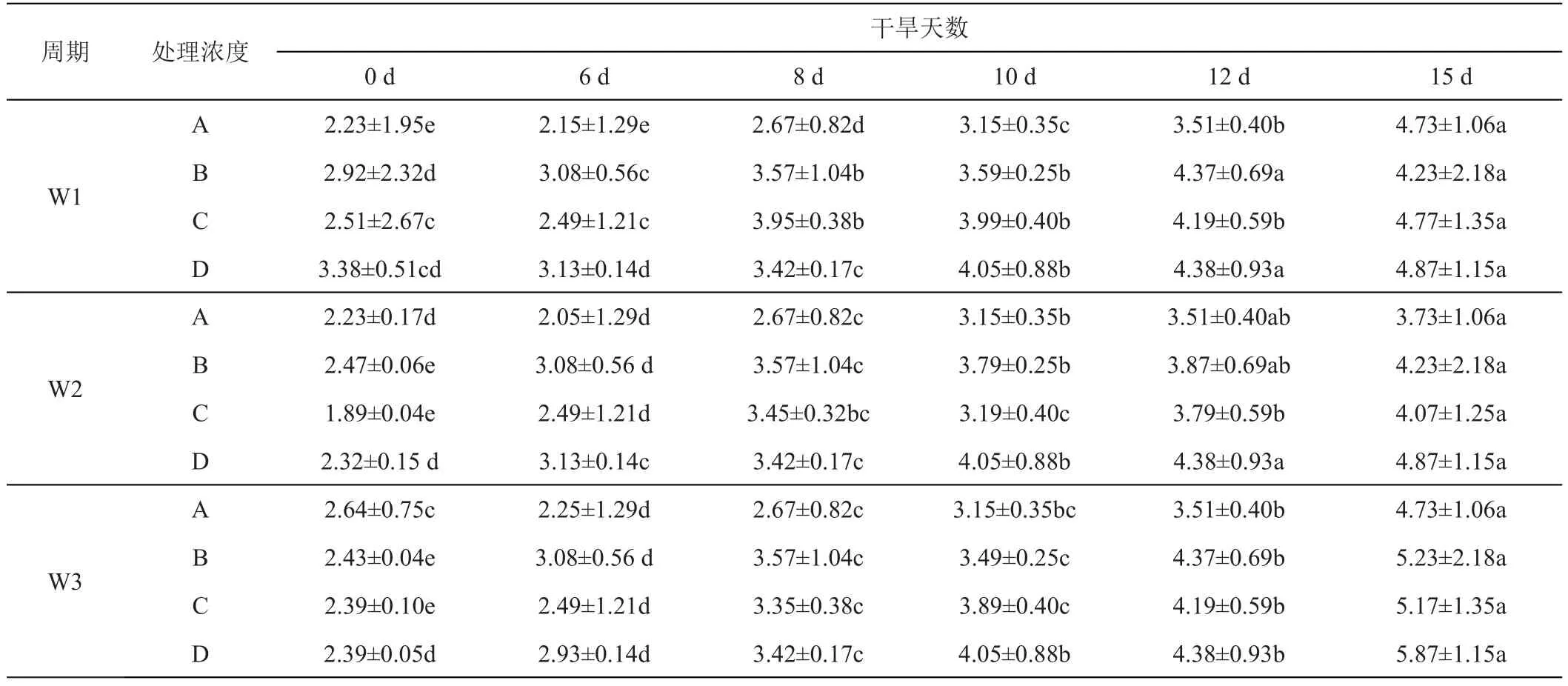
表3 GGR-6和时间变化对早熟禾‘优异’不同干旱胁迫时期丙二醛含量的影响
2.2 不同GGR-6浓度和干旱胁迫周期对紫羊茅和早熟禾叶片游离脯氨酸的影响
干旱胁迫下,紫羊茅和早熟禾叶片游离脯氨酸含量逐渐升高,与对照组相比显著上升(P<0.05)。随干旱胁迫的进行,游离脯氨酸含量差异逐步扩大。与对照组相比,紫羊茅、早熟禾的游离脯氨酸活性分别增加了0.21、0.59倍,其中紫羊茅的游离脯氨酸活性增幅较小。
与对照相比,干旱胁迫下,紫羊茅叶片游离脯氨酸含量显著提升(P<0.05),GGR-6浓度为0、0.1、0.2、0.3 g/L时,W1施用周期的游离脯氨酸含量分别是对照的1.11、1.19、1.52、1.23倍;W2下分别是对照的 1.30、1.36、1.15、1.39倍;W3下分别是对照的 1.43、1.21、1.36、1.42倍;随施用周期的后移,其叶片积累的游离脯氨酸含量不断升高。施用较低浓度GGR-6时(0.1 g/L、0.2 g/L),紫羊茅叶片游离脯氨酸含量积累速率较快,而在0.3 g/L浓度处理下,紫羊茅叶片游离脯氨酸含量仍随着胁迫的增加而持续增大(表4)。
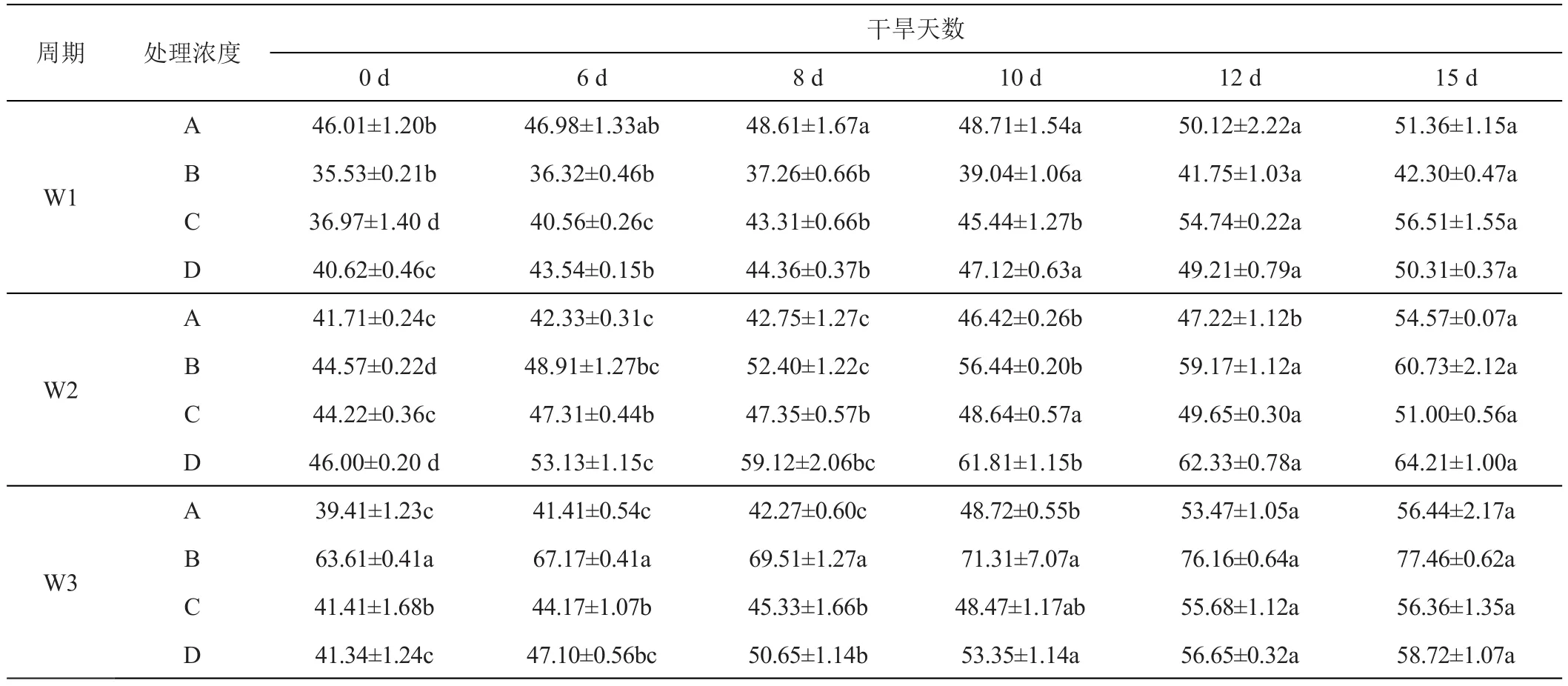
表4 GGR-6和时间变化对紫羊茅‘梦神’不同干旱胁迫时期游离脯氨酸含量的影响
干旱胁迫下,早熟禾叶片游离脯氨酸含量与对照相比显著上升(P<0.05),在W1下,早熟禾叶片游离脯氨酸含量随GGR-6施加浓度的提高而不断升高,且较高浓度(0.3 g/L)的GGR-6并未影响早熟禾叶片游离脯氨酸的积累,而在W2、W3下,高浓度(0.3 g/L)的GGR-6施加使得早熟禾叶片游离脯氨酸积累速度放缓(表5)。
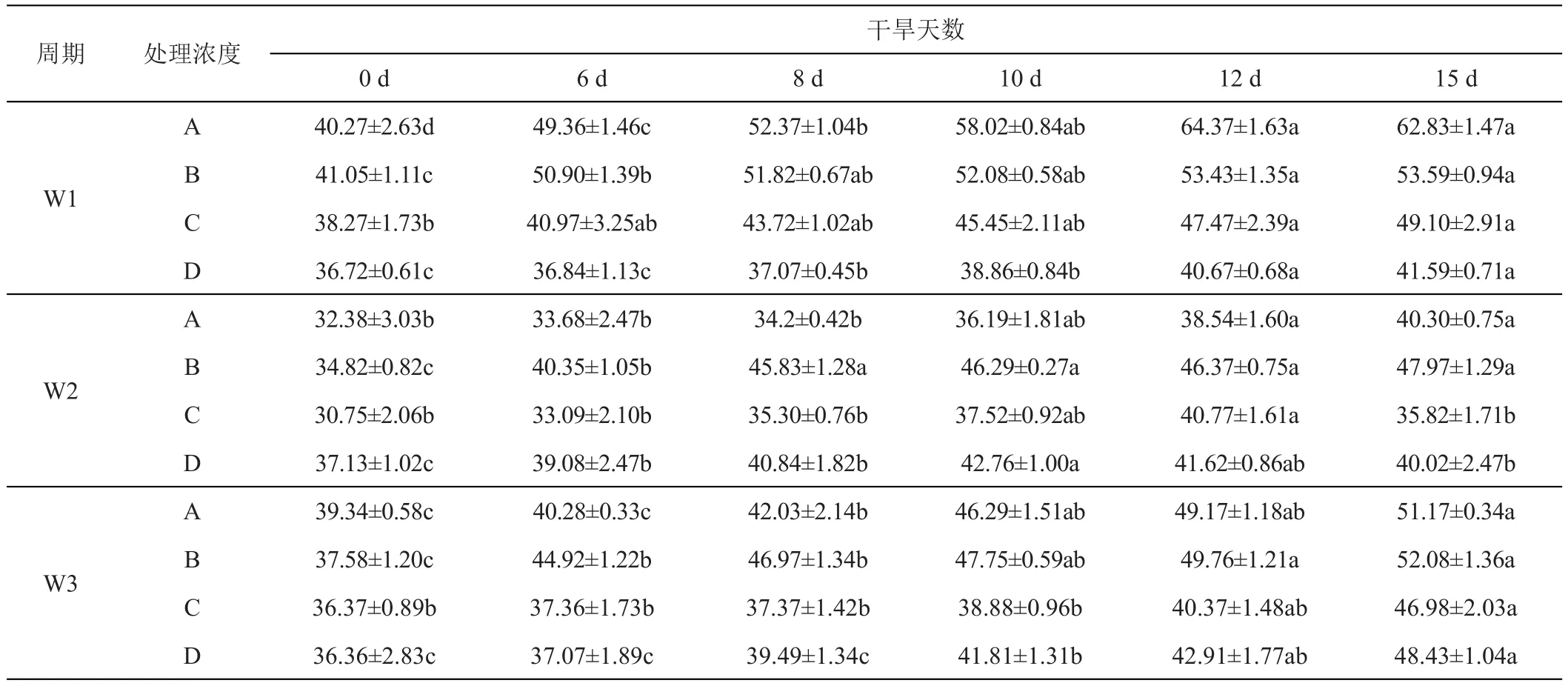
表5 施用GGR-6浓度和时间变化对早熟禾‘优异’不同干旱胁迫时期游离脯氨酸含量的影响
2.3 不同GGR-6浓度和干旱胁迫周期对紫羊茅和早熟禾叶片超氧化物歧化酶含量的影响
与对照相比,在施加GGR-6后,紫羊茅和早熟禾叶片SOD活性均高于对照(P<0.05),叶片的SOD活性随着干旱胁迫的进行,均呈先升后降趋势,早熟禾叶片的SOD活性峰值集中出现在干旱10天,SOD活性是对照的1.44倍,而紫羊茅叶片的SOD活性峰值则在8、10、12天均有分布,其SOD活性的峰值是对照的1.36倍,并未显著高于早熟禾叶片的SOD活性。
紫羊茅叶片在不同处理周期下,施加GGR-6后其SOD活性,均显著高于对照(P<0.05),与对照相比,在W1、W2、W3期施加GGR-6,紫羊茅叶片SOD活性均呈现先升后降趋势,在W1、W2、W3期下,其SOD活性分别增加了1.44、1.25、1.35倍,且其峰值在8、10、12天均有分布,而后呈现下降趋势,在各不同处理周期较低浓度(0.1 g/L、0.2 g/L)的GGR-6的处理紫羊茅叶片SOD活性较高(表6)。
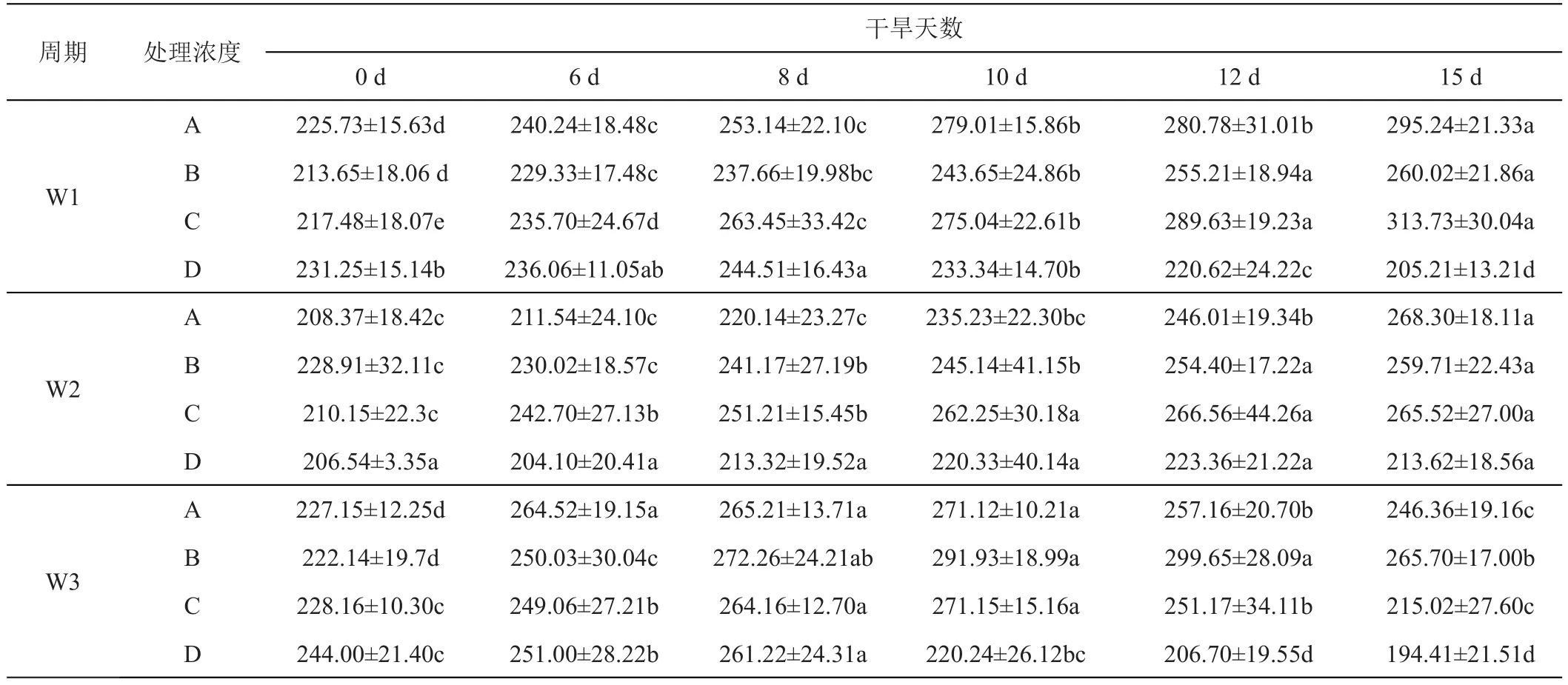
表6 GGR-6浓度和时间变化对紫羊茅‘梦神’不同干旱胁迫时期超氧化物歧化酶含量的影响
与紫羊茅相比,早熟禾叶片对轻度的干旱胁迫有较强的适应性,施加GGR-6后,早熟禾叶片的SOD活性显著高于对照(P<0.05),在 W1、W2、W3 期施加GGR-6,早熟禾叶片SOD活性均呈现先升后降趋势,与对照相比,在W1、W2、W3下SOD活性分别增加了1.36、1.18、1.27倍,其SOD活性峰值出现在10、12天,其后随着干旱胁迫程度的加重,早熟禾叶片受到较重的逆境伤害,SOD活性降低,但仍显著高于对照,在各不同周期处理组间,浓度0.2 g/L的GGR-6的处理下,早熟禾叶片SOD活性高于施加其他浓度的GGR-6处理组(表7)。
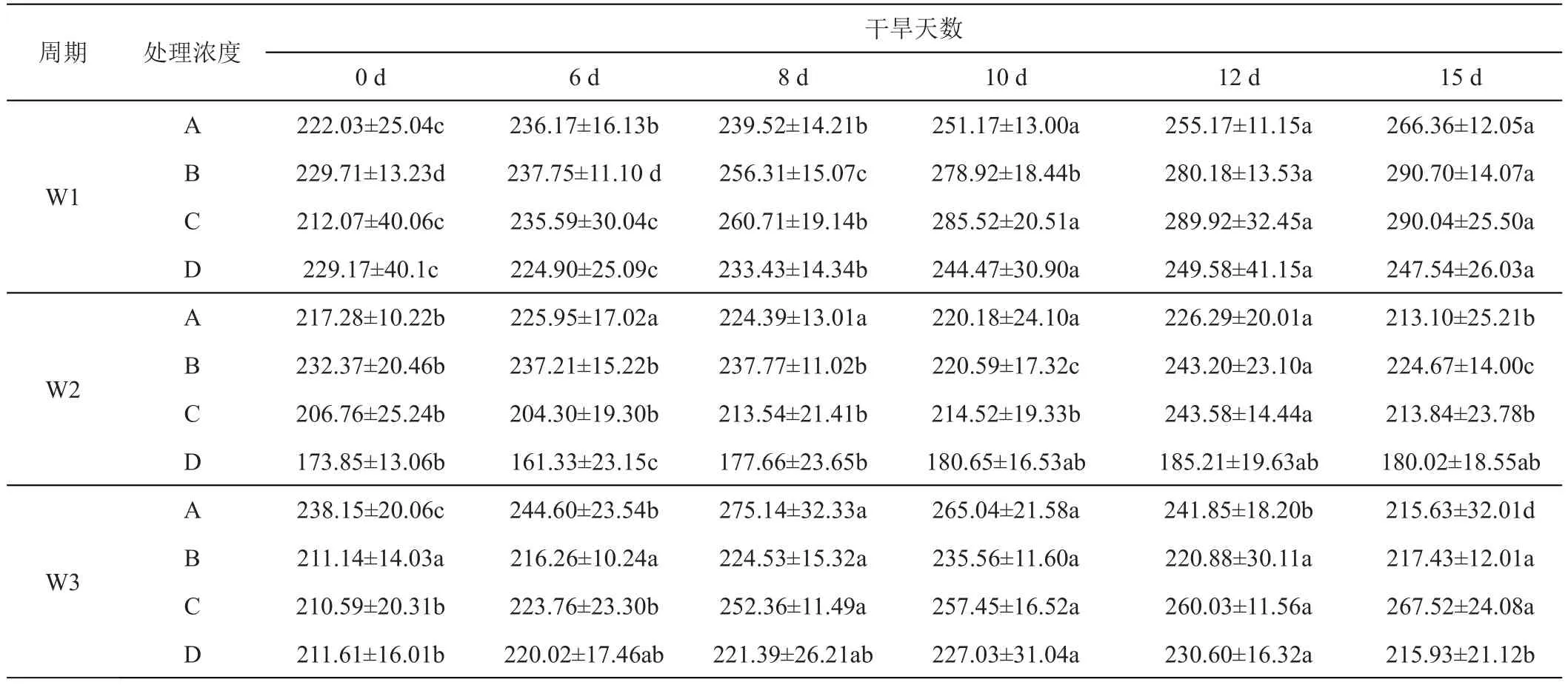
表7 GGR-6和时间变化对早熟禾‘优异’不同干旱胁迫时期超氧化物歧化酶含量的影响
2.4 GGR-6和干旱胁迫周期对紫羊茅和早熟禾叶片过氧化物酶(POD)含量的影响
与对照相比,两种草坪草叶片在施加GGR-6后POD活性均高于对照(P<0.05),随着干旱胁迫的进行,总体均呈先升后降趋势,早熟禾的POD活性峰值集中出现在干旱10天,比对照增加了0.6倍,而紫羊茅的POD活性峰值在8、10、12天均有出现,表明较低程度的干旱即可诱导紫羊茅叶片POD活性的增强,其峰值较对照增加了0.85倍,稍高于早熟禾的POD活性增加程度。
紫羊茅叶片在不同处理周期下,施加GGR-6后其POD活性,显著高于对照(P<0.05),与对照相比,在W1、W2、W3期施加GGR-6,紫羊茅叶片均在0.1 g/L、0.2 g/L浓度下呈现先升后降趋势,在W1、W2、W3期下POD活性分别增加了0.16、0.19、0.84倍,施用GGR-6对紫羊茅叶片POD活性的变化相比早熟禾并不显著,且其峰值在8、10、12天均有分布,而后呈现下降趋势,部分处理组的POD活性并未高于对照(表8)。
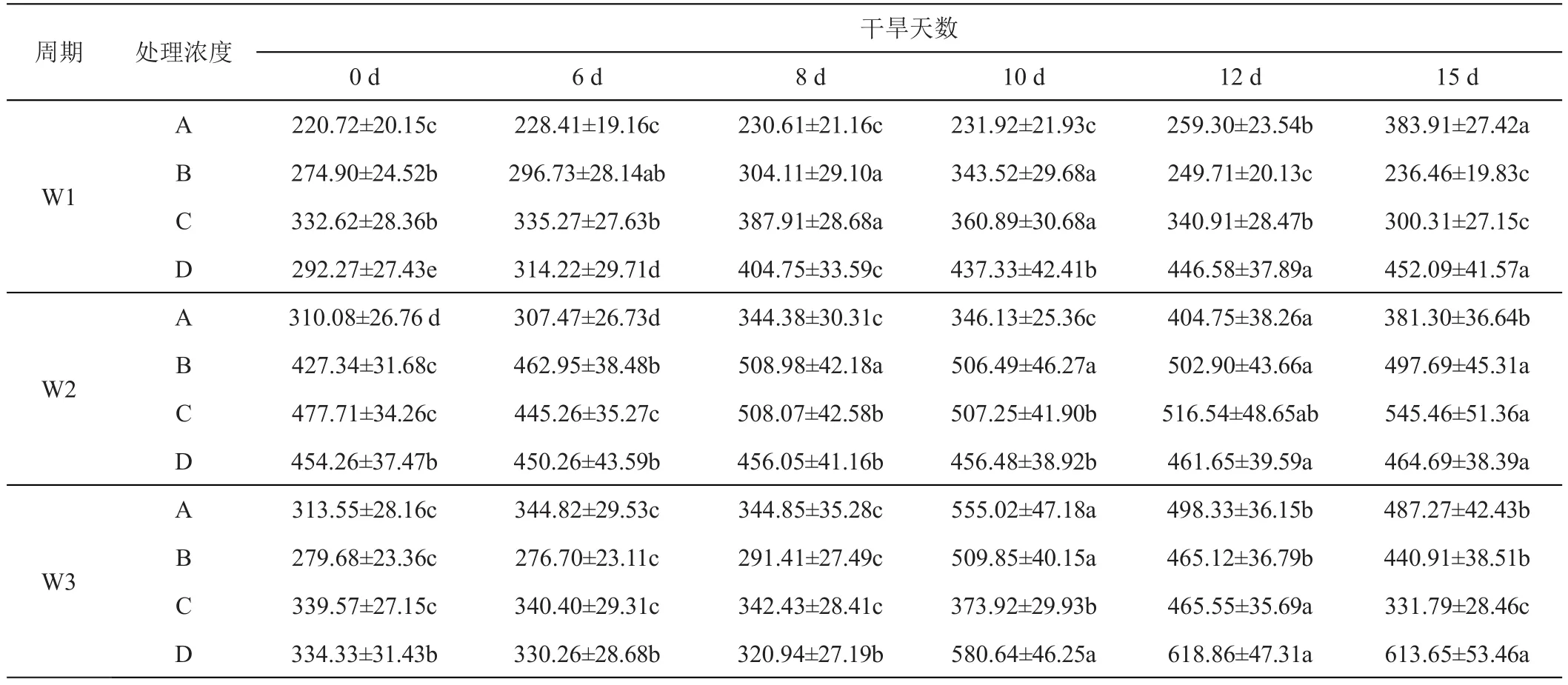
表8 GGR-6和时间变化对紫羊茅‘梦神’不同干旱胁迫时期过氧化物酶含量的影响
与紫羊茅相比,在对照下,早熟禾叶片的POD活性即呈现先升后降趋势,表明早熟禾对轻度的干旱胁迫有较强的适应性。施加GGR-6后,早熟禾叶片的POD活性显著高于对照(P<0.05),在W1、W2、W3期施加GGR-6,早熟禾均在0.1 g/L、0.2 g/L浓度下呈现先升后降趋势,与对照相比,在W1、W2、W3期下POD活性分别增加了0.22、0.94、0.21倍,与W1、W3期相比,于W2期施加GGR-6提升早熟禾叶片POD活性更为显著,其POD活性峰值出现在8、10天,其后随着干旱胁迫的进行,早熟禾叶片受到较重的逆境伤害,POD活性降低,但仍显著高于对照(表9)。

表9 施用GGR-6浓度和时间变化对早熟禾‘优异’不同干旱胁迫时期过氧化物酶含量的影响
3 讨论
3.1 GGR-6对干旱胁迫下紫羊茅和早熟禾叶片MDA含量的影响
植物抗旱性越强其处于干旱条件下叶片膜系统的损伤则越低[23],植株叶片MDA含量反映了叶片细胞膜脂过氧化反应,而GGR-6作为一种植物生长调节剂,能够促进处于逆境的植物体的生长,增强植物体内酶活性,以提升植物对逆境的抗性。在本研究中,2种草坪草叶片的MDA含量均在干旱胁迫下显著增加,表明2种草坪草由于干旱逆境导致了细胞膜损伤,造成叶片MDA含量增加,进而损伤了其叶片膜系统。施用GGR-6后,3种草坪草叶片MDA含量显著低于对照,表明不同施用周期、不同浓度GGR-6对干旱逆境下的植物体细胞膜损伤有不同程度的缓解。另外,2种草坪草在干旱胁迫下对于GGR6的反应有所差异,紫羊茅需要较早的施用GGR6。对于早熟禾来说,W1、W2下施加低浓度GGR-6(0.1 g/L)有效缓解了早熟禾叶片的膜系统损伤,而W3下,高浓度GGR-6(0.3 g/L)的作用效果更为显著。表明GGR6的施用依赖于植物种类和胁迫程度。对于此类研究,前人往往仅关注不同浓度GGR-6的生理效应,忽视了不同生育期对生根剂的响应,因此本研究结合两者综合预测GGR-6的生理效应更具实际意义。
3.2 GGR-6对干旱胁迫下紫羊茅和早熟禾叶片游离脯氨酸含量的影响
由于植物对逆境的自我保护机制,在其膜上积累大量活性氧的同时,植株叶片会通过渗透调节来维持其体内的代谢平衡[24]。植物在干旱胁迫下,游离脯氨酸会帮助维持植物体的渗透平衡,降低其渗透势,避免植物叶片细胞脱水[25]。在本研究中,2种草坪草叶片游离脯氨酸含量均随干旱胁迫的持续而显著升高,且施加GGR-6显著提高了草坪草叶片游离脯氨酸含量,表明GGR-6帮助2种草坪草在逆境下通过积累溶质来主动降低其植株体内渗透势,维持细胞膨压。随着干旱胁迫的持续,紫羊茅的游离脯氨酸活性增幅较小,表明其生理代谢对干旱胁迫的响应较弱,抗旱能力较差。
3.3 GGR-6对干旱胁迫下紫羊茅和早熟禾叶片抗氧化酶的影响
干旱条件下,植物体内抗氧化酶会清除由于植株细胞膜受损产生的活性氧物质,而SOD和POD是该系统的2个重要的酶[26]。在本研究中,施加GGR-6显著提高了2种草坪草叶片SOD和POD活性,且2种草坪草叶片SOD、POD活性随干旱胁迫的加剧呈现先升高后降低的趋势。表明GGR-6影响了2种草坪草的活性氧防御系统,响应了植物体的干旱胁迫,提升了2种草坪草的抗旱性。
在植物体的抗氧化酶系统中,SOD在歧化反应中催化超氧阴离子自由基形成氧分子和过氧化氢,降低了植物体由于自由基的攻击而产生的毒性[27]。本研究中,施加GGR-6的早熟禾在干旱胁迫10天时到达最大值,随后逐渐降低,而紫羊茅在干旱胁迫8天时即到达最大值。SOD通过歧化反应在植物体内生成氧分子和过氧化氢后,POD进一步将低毒性的过氧化氢分解为水,进一步缓解了干旱对于植物的逆境影响。在本研究中,干旱条件下,紫羊茅的POD活性下降更为明显表明紫羊茅对于干旱胁迫较为敏感,抗旱能力较低。
4 结论
干旱胁迫下,施加GGR-6可以帮助2种草坪草维持细胞膜透性、积累渗透调节物质、启动保护酶系统来更好地保证其植物体的正常生长,缓解干旱对生长的抑制,浇灌GGR-6能显著提升2种草坪草抵御干旱逆境的能力,但是2种草坪草对不同浓度GGR-6以及浇灌时期有着不同的响应,其中,紫羊茅于播种后1周浇灌0.1 g/L、0.2 g/L的GGR-6的效果最好。早熟禾播种2周后浇灌低浓度(0.1 g/L、0.2 g/L)的GGR-6,播种后3周浇灌高浓度(0.3g/L)的GGR-6效果较好。2种草坪草幼苗的抗旱性差异较大,早熟禾抗旱能力高于紫羊茅,对于GGR-6深层次的提高植物耐旱分子机理有待于今后进一步研究。

