鱼腥草内生菌Aspergillus sp.GZWMJZ-636次级代谢产物研究
刘思成,许言超,吴 耽,何文文,胡华林,朱伟明,王立平*
1.贵州医科大学 省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550014
2.贵州医科大学药学院,贵州 贵阳 550025
3.贵州省中国科学院天然产物化学重点实验室,贵州 贵阳 550014
内生菌广泛分布于植物的各个部位[1],且以互惠共生的寄生关系协同生长,宿主植物为内生菌提供生长所需条件,内生菌则代谢产生具有生理活性的物质作为回报促进植物的生长及防御[2]。鱼腥草Houttuynia cordataThunb.为三白草科蕺菜属植物蕺菜的新鲜全草或干燥地上部分,主要分布于我国长江流域以南地区,包括贵州、江西、四川等省。鱼腥草具有清热解毒、消痈排脓、利尿通淋等功效[3],研究表明其主要化学成分包括黄酮、多糖、生物碱和挥发油等类成分[4],是药食两用植物。鱼腥草生命力较强,不易被病菌感染,目前已有对鱼腥草内生菌的抑菌活性报道[5-7],但主要是内生菌的分离及其发酵提取物的抑菌活性筛选。然而,对鱼腥草内生菌次级代谢产物的研究却鲜有报道,本研究从1株鱼腥草内生菌Aspergillussp.GZWMJZ-636的发酵产物中分离并鉴定了1个新的吲哚二酮哌嗪生物碱18-氧代曲普鲁斯太汀B(18-oxotryprostatin B,1)和5个已知化合物,分别为1,2-裂环-杀锥曲菌素(1,2-seco-trypacidin,2)、常现青霉素(questin,3)、短密青霉菌胺F(brevianamide F,4)、特来孢菌嗪D(terezine D,5)和去甲氧基烟曲霉素C(demethoxyfumitremorgin C,6),部分化合物对小麦赤霉病菌和辣椒枯萎病菌生长具有一定的抑制活性。化合物1~6结构见图1。
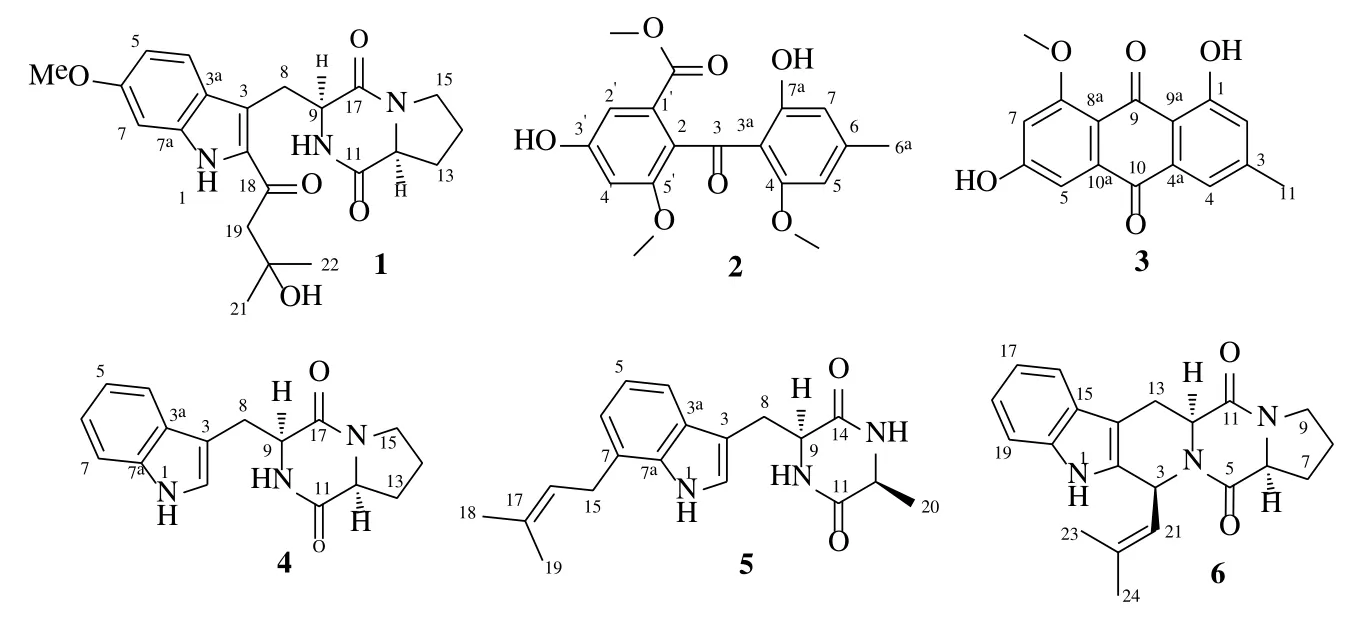
图1 化合物1~6的结构Fig.1 Structures of compounds 1–6
1 仪器与材料
Bruker-600 MHz超导核磁共振波谱仪(美国Bruker公司),Waters 2695 LCQ-MS质谱仪(美国Waters公司),日立Primaide分析型高效液相色谱仪(日本Hitachi公司),日立Primaide制备型高效液相色谱仪(日本Hitachi公司),鲁道夫AUTOPOL1自动旋光仪(美国Rudolph公司);柱色谱及薄层色谱用硅胶H(青岛谱科分离材料有限公司),Sephadex™ LH-20葡聚糖凝胶(瑞典Amersham公司),色谱柱(北京欣维尔),FA1104型电子分析天平(上海恒平科学仪器有限公司),ZF-6型三用紫外线分析仪(上海嘉鹏科技有限公司),Air Tech洁净工作台(苏州安泰科技有限公司),LDZX-75KBS高压灭菌锅(上海申安医疗器械厂),ZWY-2112B恒温培养箱(上海智诚分析仪器制造有限公司)。提取分离用醋酸乙酯、甲醇、丙酮、二氯甲烷、石油醚等均为分析纯,液相用甲醇为色谱纯。
鱼腥草Houttuynia cordataThunb.采自贵州省黔南布依族苗族自治州龙里县,由贵州省中国科学院天然产物化学重点实验室顾玮副研究员鉴定。内生菌Aspergillussp.GZWMJZ-636分离自鱼腥草地下部分,菌株委托北京六合华大基因科技有限公司武汉分公司进行ITS测序,NCBI数据库blast比对,鉴定为曲霉属,GenBank登录号为No.MW440553。该菌株保藏于贵州省中国科学院天然产物化学重点实验室。抑菌活性实验所用的2种植物致病菌为小麦赤霉病菌Fusarium graminearum和辣椒枯萎病菌F.oxysporum,菌株由贵州省中国科学院天然产物化学重点实验室黄烈军副研究员提供。
2 方法
2.1 菌株发酵
将保藏于4 ℃冰箱的菌株接种到PDA固体培养基平板上,在28 ℃培养箱中培养3 d。然后挑取单菌落接种到装有真菌二号培养基(麦芽糖20 g、味精10 g、KH2PO40.5 g、MgSO4·7H2O 0.3 g、葡萄糖10 g、酵母膏3 g、玉米浆1 g、甘露醇20 g,自来水1000 mL)的锥形瓶中(150 mL/500 mL),在28 ℃恒温摇床培养(180 r/min)培养4 d,作为种子液使用。采用大米固体培养基(50 g大米,50 mL水)发酵,发酵量为5 kg,在28 ℃下静置培养30 d。
2.2 活性产物的提取分离
发酵结束后的菌株用醋酸乙酯-甲醇(10∶1)分批搅拌提取3次,每次搅拌2 h,提取液减压浓缩后得到粗提物180 g。提取物经硅胶柱色谱分离,石油醚-醋酸乙酯(100∶1、50∶1、20∶1、10∶1、5∶1、2∶1、1∶1)洗脱,得到9个组分(Fr.1~9)。通过硅胶柱色谱对组分Fr.4(3.8 g)进行梯度洗脱,石油醚-醋酸乙酯(10∶1、5∶1、2∶1、1∶1)洗脱,得到8个组分(Fr.4.1~4.8)。Fr.4.7用HPLC(半制备型,C18柱)制备(甲醇-水78∶22)得到化合物2(tR=9 min,12.9 mg)。Fr.4.8通过凝胶柱色谱,甲醇-二氯甲烷(1∶1)洗脱,得到5个组分(Fr.4.8.1~4.8.5)。Fr.4.8.5用HPLC(半制备型,C18柱)制备(甲醇-水68∶32)得到化合物3(tR=5 min,9.5 mg)。Fr.5(5.6 g)经硅胶柱色谱分离,石油醚-醋酸乙酯(2∶1、1∶1、1∶2、1∶4)洗脱,得到10个组分(Fr.5.1~5.10)。Fr.5.2用HPLC(半制备型,C18柱)制备[甲醇-水(40∶60)]得到化合物6(tR=9.3 min,12.0 mg)。Fr.6(4.6 g)经硅胶柱色谱分离,二氯甲烷-甲醇(30∶1)洗脱得到6个组分(Fr.6.1~6.6)。Fr.6.2用HPLC(半制备型,C18柱)制备[甲醇-水(55∶45)]得到化合物4(tR=9.6 min,9.3 mg)。Fr.6.3用HPLC(半制备型,C18柱)制备[甲醇-水(55∶45)]得到化合物1(tR=8.5 min,15.2 mg)。Fr.6.5用HPLC(半制备型,C18柱)制备[甲醇-水(65∶35)]得到化合物5(tR=9.2 min,98.3 mg)。
2.3 抗植物病原菌活性评价方法
实验分为药物组和空白组,药物组以DMSO溶解待测化合物,空白组为DMSO溶液。将待测化合物用DMSO配制成质量浓度为50 mg/mL的溶液,备用。配制PDA培养基,按10 mL定量分装至50 mL锥形瓶中,在121 ℃灭菌30 min。药物组每瓶加入待测化合物溶液10 μL,终质量浓度为50 μg/mL,混匀后倒入无菌培养皿中,静置冷却,为给药组;空白组用同样方法定量加入10 μL DMSO溶液,待培养皿充分冷却后,在各组平板中央接入直径为5 mm病原真菌的菌饼,于28 ℃培养。当空白组菌落长满平板时,用十字交叉法测量各组的菌落直径,计算各组均值,根据平均值计算化合物的抑菌率。
抑菌率=(空白组菌落直径-药物组菌落直径)/空白组菌落直径
3 结果与分析
3.1 结构鉴定
化合物1:白色无定形粉末,高分辨质谱m/z436.183 0 [M+Na]+(计算值436.184 3,C22H27N3O5Na)提示化合物的分子式为C22H27N3O5。[α]20D−58.8°(c0.56);紫外光谱显示,在218 (2.97)、256 (1.19)、341 (2.87)、347 (2.79) nm 处有紫外吸收。3386,3272,2974,2855,1662,1576,1525,1451,1428,1382,1351,1304,1237,1163,1047,1021,910,815。通过分析其1H-和13C-NMR(表1)、DEPT和HSQC谱得知,化合物1有8个sp2季碳(δC193.7、169.5、165.7、158.8、137.6、132.9、122.4、121.9),3个sp2次甲基(δC118.8、111.9、93.7),1个sp3季碳(δC69.6),2个sp3次甲基(δC58.4、55.2),5个sp3亚甲基(δC52.3、44.9、27.5、25.0、22.3)及1个甲氧基(δC56.1)和2个同化学位移的甲基(δC29.8)。其核磁共振谱数据与已知化合物18-氧代曲普鲁斯太汀A[8]非常接近,其差别主要在于异戊烯基双键信号消失,以及增加了1个sp3亚甲基信号(δH/C3.01/ 52.3)和1个连氧的sp3季碳信号(δC69.6)。在HMBC谱(图2)中,H2-19 (δH3.01) 与C-2、18、20、21、22,20-OH (δH4.72) 与C-19、20、21、22以及H3-21、22 (δH2.15)与C-19、20有长距离相关信号,提示异戊烯基的双键与1分子水加成形成20-位叔醇结构,水合后的异戊烯基通过C-18位与母核的C-2位相连。为确定化合物的立体构型,进行了Marfey’s衍生化分析,脯氨酸部分被确定为L构型。NOESY谱(图3)中H-9(δH4.36)与H-12(δH4.13)的相关信号提示H-9与H-12在环的同侧,化合物1的立体构型确定为 (9S,12S),命名为18-氧代曲普鲁斯太汀B。

表1 化合物1的NMR数据 (600/150 MHz,DMSO-d6)Table 1 NMR data of compound 1 (600/150 MHz,DMSO-d6)
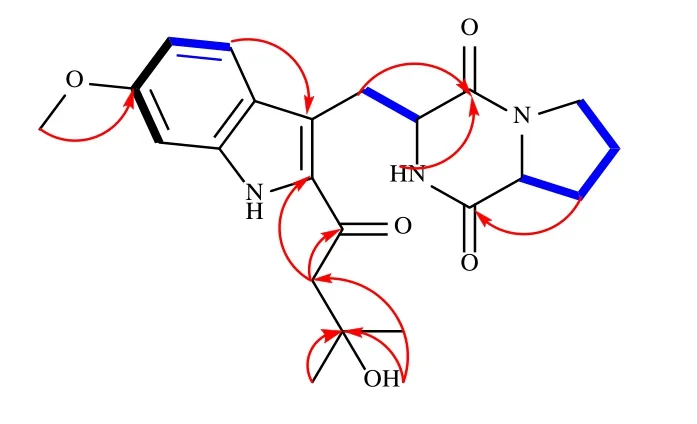
图2 化合物1主要的1H-1H COSY (粗线,H-5/H-7为远程偶合)、HMBC (箭头) 相关信号Fig.2 Key 1H-1H COSY (bold lines,long-range coupling for H-5/H-7) and HMBC (arrows) correlations of compound 1

图3 化合物1主要的NOESY相关 (虚线箭头)Fig.3 Key NOESY (broken arrows) correlation of compound 1
化合物2:白色粉末,分子式C18H18O7;ESI-MSm/z:345.1[M-H]−;1H-NMR (600 MHz,DMSO-d6)δ:6.91 (1H,s,H-2′),6.70 (1H,s,H-7),6.39 (1H,s,H-5),6.27 (1H,s,H-4′),3.64 (3H,s,5′-OMe),3.63(3H,s,1′-COOMe),3.34 (3H,s,4-OMe),2.27 (3H,s,H-6a);13C-NMR (150 MHz,DMSO-d6)δ:199.5 (s,C-3),165.9 (s,1′-COOMe),163.4 (s,C-7a),160.9 (s,C-4),158.3 (s,C-3′),156.8 (s,C-5′),147.9 (s,C-6),128.1 (s,C-1′),125.9 (s,C-2),110.2 (d,C-5),110.2 (s,C-3a),107.3 (d,C-2′),103.6 (d,C-7),103.3 (d,C-4′),56.1 (q,5′-OMe),56.0 (q,1′-COOMe),52.2 (q,4-OMe),22.0 (q,C-6a)。以上数据与文献报道基本一致[9],故鉴定化合物2为1,2-裂环-杀锥曲菌素。
化合物3:黄色粉末,分子式C16H12O5;ESI-MSm/z: 283.0 [M-H]−;1H-NMR (600 MHz,DMSO-d6)δ: 7.41 (1H,s,H-4),7.17 (1H,d,J=2.1 Hz,H-5),7.11 (1H,s,H-2),6.80 (1H,d,J=2.1 Hz,H-7),3.89(3H,s,8-OMe),2.38 (3H,s,H-11);13C-NMR (150 MHz,DMSO-d6)δ: 186.5 (s,C-9),182.9 (s,C-10),163.9 (s,C-6),162.1 (s,C-8),146.8 (s,C-3),137.2 (q,C-10a),132.5 (s,C-4a),124.5 (d,C-2),119.4(d,C-4),114.8 (s,C-9a),112.5 (s,C-8a),107.9 (d,C-5),105.5 (d,C-7),56.6 (s,8-OMe),21.8 (q,3-Me)。以上数据与文献报道基本一致[10],故鉴定化合物3为常现青霉素。
化合物4:无色固体,[α]24D−117.6°(c5.68,MeOH);分子式C16H17N3O2;ESI-MSm/z: 306.4 [M+Na]+;1H-NMR (600 MHz,DMSO-d6)δ:10.87 (1H,s,NH-1),7.75 (1H,s,NH-10),7.58 (1H,d,J=7.5 Hz,H-4),7.34 (1H,d,J=7.5 Hz,H-7),7.19 (1H,s,H-2),7.06 (1H,t,J=7.5 Hz,H-6),6.97 (1H,t,J=7.5 Hz,H-5),4.31 (1H,m,H-9),4.05 (1H,m,H-12),3.37(1H,m,H-15),3.27 (1H,m,H-8),3.25 (1H,m,H-15),3.09 (1H,m,H-8),1.97 (1H,m,H-13),1.68 (1H,m,H-14),1.61 (1H,m,H-14),1.38 (1H,m,H-13);13CNMR (150 MHz,DMSO-d6)δ:169.1 (s,C-11),165.6(s,C-17),136.0 (s,C-7a),127.4 (s,C-3a),124.5 (d,C-2),121.0 (d,C-6),118.7 (d,C-4),118.3 (d,C-5),111.3 (d,C-7),109.3 (s,C-3),58.5 (d,C-12),55.3 (d,C-9),44.7 (t,C-15),27.7 (t,C-13),25.9 (t,C-8),21.9(t,C-14)。以上数据与文献报道基本一致[11],故鉴定化合物4为短密青霉菌胺 F。
化合物5:白色粉末,[α]24D+6.1°(c1.97,MeOH);分子式C19H23N3O2;ESI-MSm/z:348.4 [M+Na]+;1H-NMR (600 MHz,DMSO-d6)δ:10.84 (1H,s,NH-1),8.00 (1H,s,NH-10),7.92 (1H,s,NH-13),7.39(1H,d,J=7.0 Hz,H-4),7.05 (1H,s,H-2),6.87 (1H,t,J=7.0 Hz,H-5),6.81 (1H,d,J=7.0 Hz,H-6),5.38(1H,t,J=6.3 Hz,H-16),4.11 (1H,brs,H-9),3.62(1H,d,J=6.7 Hz,H-12),3.49 (2H,d,J=6.3 Hz,H-15),3.22 (1H,m,H-8),3.02 (1H,m,H-8),1.69(3H,s,H-18),1.69 (3H,s,H-19),0.48 (3H,d,J=6.7 Hz,H-20);13C-NMR (150 MHz,DMSO-d6)δ:167.9 (s,C-11),166.9 (s,C-14),134.7 (s,C-7a),131.8 (s,C-17),127.8 (s,C-3a),124.4 (d,C-2),124.1 (s,C-7),122.4 (d,C-16),120.0 (d,C-6),118.7 (d,C-5),116.7 (d,C-4),109.0 (s,C-3),55.4 (d,C-9),49.9 (d,C-12),29.1 (t,C-8),29.0 (q,C-15),25.6 (t,C-18),19.4 (q,C-19),17.7 (q,C-20)。以上数据与文献报道基本一致[12],故鉴定化合物5为特来孢菌嗪 D。
化合物6:淡黄色粉末,[α]24D+5.3°(c1.66,CHCl3);分子式C21H23N3O2;ESI-MSm/z:372.5 [M+Na]+;1H-NMR (600 MHz,DMSO-d6)δ:11.02 (1H,s,NH-1),7.55 (1H,d,J=7.9 Hz,H-16),7.33 (1H,d,J=7.9 Hz,H-19),7.07 (1H,t,J=7.9 Hz,H-18),7.00(1H,t,J=7.9 Hz,H-17),5.95 (1H,d,J=9.6 Hz,H-3),4.87 (1H,d,J=9.6 Hz,H-21),4.28 (1H,m,H-6),4.28 (1H,m,H-12),3.44 (2H,m,H-9),3.36(1H,m,H-13),2.91 (1H,m,H-13),2.20 (1H,m,H-7),2.00 (1H,m,H-7),1.94 (3H,s,H-24),1.87 (2H,m,H-8),1.58 (3H,s,H-23);13C-NMR (150 MHz,DMSO-d6)δ:169.2 (s,C-5),165.5 (s,C-11),136.1 (s,C-20),134.3 (s,C-22),132.7 (s,C-2),125.9 (s,C-15),124.6 (s,C-21),121.0 (d,C-18),118.8 (d,C-17),117.9 (d,C-16),111.4 (d,C-19),105.0 (s,C-14),58.5(d,C-6),56.1 (d,C-12),49.9 (d,C-3),44.9 (t,C-9),27.9(t,C-7),25.5 (q,C-23),22.7 (t,C-8),21.4 (t,C-13),18.0(q,C-24)。以上数据与文献报道基本一致[13],故鉴定化合物6为去甲氧基烟曲霉素C。
3.2 抑菌活性测试结果
对化合物1~6进行了2种植物致病真菌的抑制活性测试,当待测化合物终质量浓度为50 μg/mL时,化合物2和3对小麦赤霉病菌的抑制率分别为21.4%、20.0%,对辣椒枯萎病菌抑制率分别为18.0%、20.9%。
4 讨论
农业致病菌的防治是现代农业发展面临的重大难题,传统的化学农药因对环境的污染而受到越来越多的关注,无公害的绿色农药已成为农业致病菌防治的趋势,可提高中草药的品质。内生菌与宿主植物互惠共生且不造成宿主的病变,其代谢的具有抑菌活性物质可能具有开发为新型无公害绿色农药的潜质。本研究从1株鱼腥草内生菌发酵产物中分离鉴定了6个化合物,化合物1为新的吲哚二酮哌嗪生物碱,化合物2和3对小麦赤霉病菌和辣椒枯萎病菌具有一定的抑制活性,可将其作为先导化合物进行研究,通过结构改造提升化合物的抗植物病原菌活性。
利益冲突所有作者均声明不存在利益冲突

