静电纺丝丝素蛋白纳米纤维在骨组织工程中的运用
向 静,李玲婕,李雨舟,张 赫,季 平,杨 生
(重庆医科大学附属口腔医院,重庆市口腔疾病与生物医学重点实验室,重庆,401147)
意外事故、肿瘤切除、骨发育不全等造成的大面积骨缺损严重影响人体美观、功能等,常常需要进行人工骨移植或骨重建进行修复。人工骨移植包括异体骨移植和自体骨移植,异体骨具有免疫原性,而自体骨则来源有限[1]。因此,1987年提出的“骨组织工程”成为修复骨缺损的新兴方法得到了广泛关注[2]。骨组织工程(tissue engineering,TE)由支架、细胞、生长因子及其在微环境中的相互联系组成,其中,构建理想的支架材料提高骨再生的效果是骨TE的核心问题。丝素蛋白(silk fibroin,SF)已被证明是一种极具前景的支架材料,其良好的生物相容性、优异的力学性能和低免疫原性决定了其在骨TE的重要性和应用潜能。本文就电纺SF纳米纤维在骨TE中的运用进展作一综述。
1 SF
SF是一种天然生物蛋白,来自于产丝节肢动物的腺体,包括蜘蛛,蚕等。使用最多最普遍的家蚕B.mori丝素蛋白,其蛋白结构如示意图1所示,由~26 kDa轻链(L链)和~390 kDa重链(H链)通过二硫键相互连接构成[1]。SF具有3种典型的结构[3],其中,亚稳态的亲水性结构silk I可以通过改变温度或添加有机溶剂(如甲醇)等方式转变为疏水性结构silk II;silk III则是一种在空气和水界面自组装形成的三倍体螺旋结构[4]。SF具有良好的机械性能,包括300~740MPa的拉伸强度、62,104J/kg的韧性、10-17GPA的拉伸弹性模量以及4%-26%的断裂应变强度。此外,SF还具有良好的生物相容性,1993年,美国食品和药物管理局(FDA)定义SF为安全的生物材料,并广泛应用于缝合等医学领域[5]。不仅如此,SF还具有可控的生物降解性、良好的氧气和水蒸气渗透性等,在生物技术、材料科学、医学美容等领域都有广泛应用[6-7]。
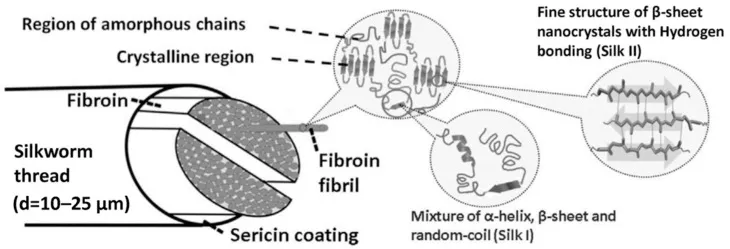
图1 丝素蛋白的结构示意图[7]
2 静电纺丝
静电纺丝技术起源于20世纪初,其原理是粘弹性溶液在高静电力下被挤压成射流,形成连续的纳米/微米纤维。静电纺丝的基本装置如图2所示,包括高压电源、注射泵、旋转的聚合物溶液和接收装置。研究表明,电纺参数对纤维的形态结构有一定影响,比如聚合物性质、溶剂性质、溶质性质、加工环境条件以及电纺溶液的浓度、分子量、粘度和流速等[8]。电纺参数对纤维形态的影响在表1总结如下。
3 丝素蛋白静电纺丝
SF静电纺丝,常用六氟异丙醇(HFIP)、甲酸(FA)和水溶液三种溶剂。首先,HFIP有机溶剂,具有很好的粘弹性,7%(w/v)的SF-HFIP即可形成纤维,平均直径6.5~100nm[10];通过β折叠后,SF-HFIP纳米纤维具有良好的机械性能[11]。FA作溶剂,5%~20%的SF-FA溶液制备的纤维直径在12-1500nm之间[12];甲醇溶液诱导SF β折叠后,膜的孔隙率从76.1%下降到68.1%,膜的机械性能增强[13]。Zhang et al.比较HFIP和甲酸两种溶剂对SF纤维形态、结构和细胞毒性的影响发现,相同条件下SF-HFIP制备的纤维直径平均约2um,而SF-FA平均直径约0.3um,且SF-FA纳米纤维膜结晶度更高,但两种膜对人表皮细胞(NHEF)粘附生长的影响没有明显区别[14]。
HFIP和FA都是有机溶剂,残留在体内可能产生负作用,因此一些研究探讨了对人体最安全的溶剂-水对SF电纺纤维的影响。SF-水作为电纺溶液,可纺性差。Wang et al.利用28w/v% SF-水溶液电纺制备的纤维直径400~800nm,而浓度低于17%的SF-水溶液不能形成纤维[15]。但是,研究表明高浓度的SF-水溶液容易通过氢键和疏水作用等相互作用转化为凝胶,不利于加工操作[16]。因此,为改善SF-水溶液的电纺性,Jin et al.提出在SF-水溶液中加入聚氧化乙烯(PEO)[17]。研究表明,5(wt)%的PEO溶液与8(wt)%的SF按4∶1(wt/wt)比例混合形成的7.5wt% SF-PEO溶液具有良好的可纺性,制备的纤维直径平均约800nm,且具有良好的机械性能[18]。Kishimoto et al.通过改进提取SF的方法,在无PEO等水溶性聚合物共存的情况下,以小于10wt%的SF-水溶液进行电纺,制备的SF膜具有良好的机械性能和生物相容性。综上,无论采用何种溶剂,SF电纺可行性高,且制备的SF纳米纤维膜具有良好的机械性能和生物相容性,因此,在骨TE具有较大的应用前景[19]。
4 丝素蛋白电纺纳米纤维在骨组织工程的应用
4.1 成骨相关细胞和丝素蛋白电纺纳米纤维间的相互作用
虽然SF的蛋白序列中没有任何细胞特异性结合位点,SF纳米纤维膜依然能促进间充质干细胞(MSCs)的粘附和增殖。首先,电纺SF纳米纤维膜具有高比表面积,能够促进蛋白黏附和细胞附着,为骨细胞的铺展生长奠定基础[9]。其次,通过调节电纺参数可以调控SF纳米纤维膜的孔径、孔隙率以及生物活性等,更好的模拟骨细胞生长微环境,促进成骨相关细胞的增殖分化[20]。Won Seo et al.研究表明SF纳米纤维膜增强了小鼠前体成骨细胞(MC3T3-E1)的ALP活性,促进了细胞成骨分化[21]。Nikbakht et al.通过体外培养BMSCs 12d证明SF促进了BMSCs矿化[22]。研究表明,SF调控干细胞成骨分化的机制主要通过以下途径:Wnt、Notch、成纤维细胞生长因子(FGF)、骨形态发生蛋白/转化生长因子β(BMP/TGFβ)、胰岛素样生长因子(IGF)和血小板衍生生长因子(PDGF)等[23]。根据药理学和分子学的研究,Notch信号在MSCs向成骨细胞分化过程中起重要作用,SF通过抑制Notch信号而上调一些成骨细胞分化标记物(如ALP,osteorix和Runx2)的表达[24]。以上研究表明,SF对成骨相关细胞的作用非常明显,因此,其在骨TE中的具有较大的应用前景。
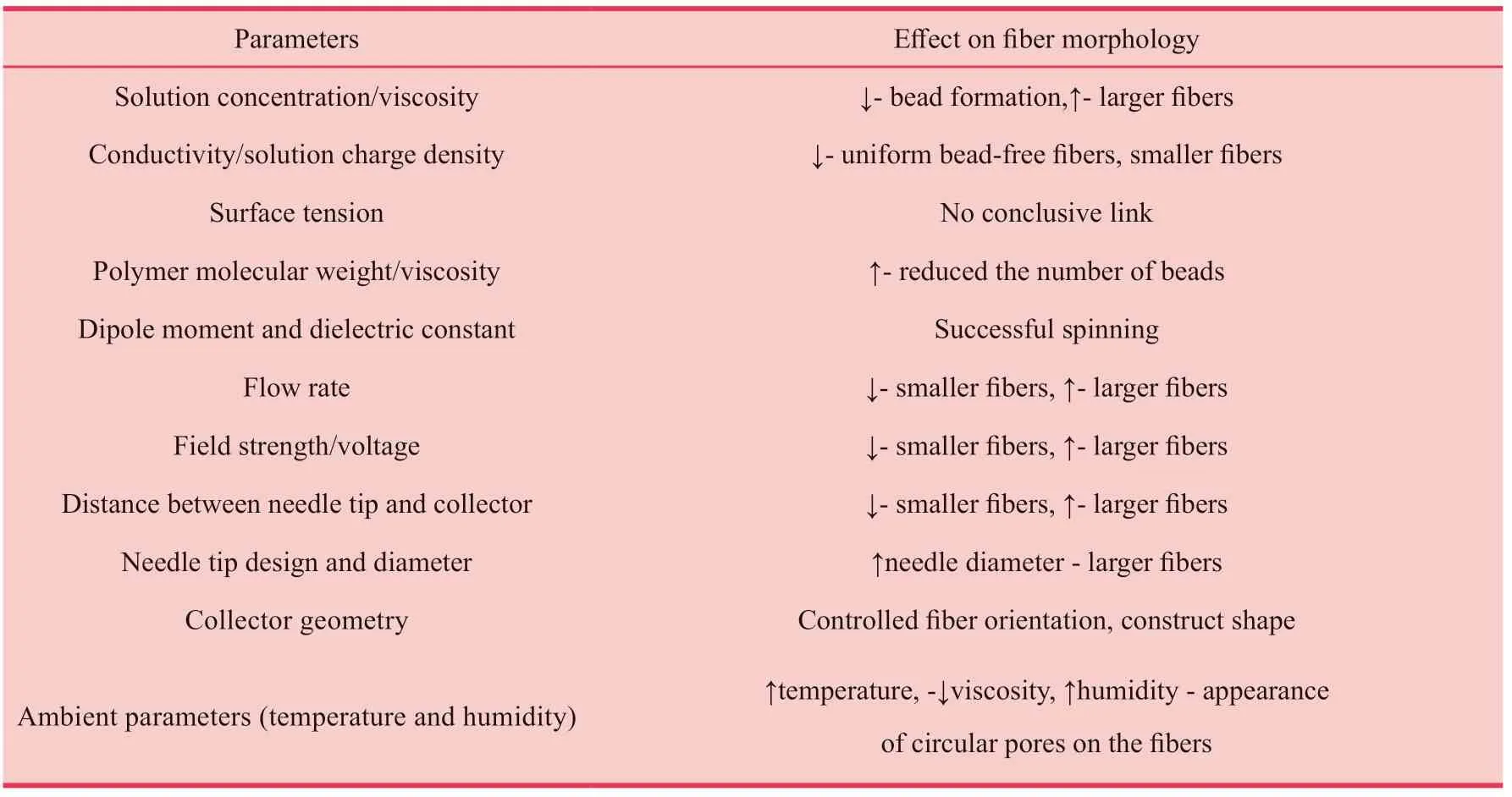
表1:电纺参数及其对纳米纤维形态的影响。
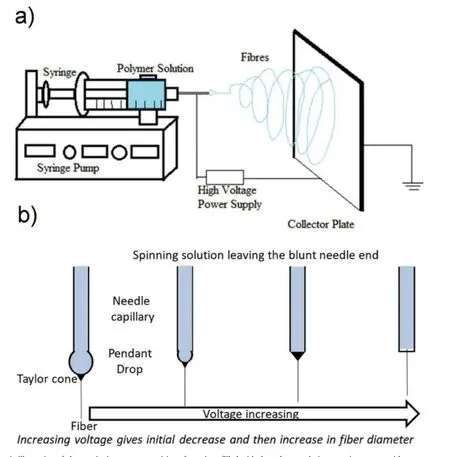
图2 a)电纺装置示意图,包括一个装溶液的注射器,一个可控速度的注射器泵,以及一个高压电源。通过施加合适的电压,形成泰勒锥,射流喷射到集电极板上。b)电压升高对泰勒锥(深色尖端)形成的影响。在低电压下,首先形成垂坠,然后在尖端形成锥体,电压持续增大,在针尖处形成锥形,更高的电压触发纤维形成[9]。
4.2 破骨细胞和电纺丝素纳米纤维间的相互作用
在骨组织工程中,骨形成细胞在支架上成骨向分化并矿化,促进骨再生非常重要。但是,骨重建是一个骨形成和骨吸收平衡的过程,在骨再生过程中,不仅需要考虑骨形成细胞而且还要考虑骨吸收细胞。目前为止,只有少数文献涉及破骨细胞和SF纳米纤维膜之间的相互作用。通过蒸汽β折叠的SF和甲醇折叠的SF薄膜单培养或共培养小鼠成骨细胞和破骨细胞发现,单独培养单核细胞时,抗酒石酸酸性磷酸酶(TRAP)阳性的细胞出现聚集;而破骨细胞和成骨细胞共培养时,TRAP阳性细胞均匀分布,表明丝素蛋白可能是研究破骨细胞和成骨细胞之间细胞-细胞交流的有利生物材料[25]。相反,SF水解产物以时间和剂量依赖方式抑制鼠单核巨噬细胞系RAW 264.7细胞中RANKL诱导的TRAP的形成[5]。目前尚不清楚在SF支架上培养破骨细胞过程中,存在多少丝素蛋白的裂解产物,但是,丝素蛋白的裂解物可以用作天然化合物通过减少破骨细胞生成来防止骨质流失。
4.3.电纺丝素纳米纤维作为支架参与体内骨再生
临床应用中,生物材料的应用不能仅通过体外测试来评估,因为很难从体外情况推至体内。因此,骨TE中骨科材料的生物相容性和骨再生能力也应在体内研究中体现。为了评估SF纳米纤维支架的体内骨再生能力,已在不同动物模型中进行测试,主要包括小鼠、大鼠、兔和绵羊等的颅骨、下颌或股骨缺损等。Jwa-Young Kim et al.利用大鼠颅骨临界缺损模型研究了BioGide膜和SF膜在骨再生中的差异。Bio-Gide膜主要是I型胶原,其中存在GER肽序列(GFP*GERGVEGPP*GPA),是α2β1整合素结合的必要识别位点,在介导成骨细胞分化中发挥重要作用。然而,体内研究表明,材料植入8周后,SF和商业Bio-Gide胶原膜(分别为8.75±0.80和8.47±0.75 mm3)的骨再生的能力没有明显差异[26]。此外,SF纳米纤维膜降低了传播感染的风险,为促进骨再生提供了另一种选择。另一研究制备的SF纳米纤维膜具有良好的生物相容性,在兔颅骨缺损模型中,体内植入8周后观察到骨愈合[27]。用于颌面骨再生的SF纳米纤维膜通过螺钉植入大鼠股骨缺损模型中,术后8周观察到令人满意的骨重建[28]。以上研究表明,SF在体内亦具有良好的骨再生性能。
4.4 电纺丝素纳米纤维作为成骨药物的载体
近年来,静电纺丝法制备的SF纳米纤维已被用于骨TE。然而,SF本身并不具有成骨性能,因此,有必要加入合适的成骨因子提高骨再生效果,比如骨特异性生长因子(BMP-2,血小板衍生生长因子PDGF)、基因和酶等[29]。Shalumon采用静电纺丝法制备了SF/壳聚糖/纳米羟基磷灰石/骨形态发生蛋白-2 (SF/CS/nHAp/BMP-2,SCHB2)支架[30],BMP-2包裹在纳米纤维的芯层,而壳层由两种厚度的SF/CS/nHAp组成。与纯SF/CS和SF/CS/nHAp相比,BMP-2结合的SCHB2纳米纤维能更好的诱导BMSCs成骨向分化。尽管BMP-2在诱导骨代谢和再生方面效果很好,但高浓度的BMP-2可能导致免疫原性、异位骨修复和水肿等[9]。因此,P24(S[PO4]KIPKASSVPTELSAISTLYLDDD),一种新的氨基酸多肽已被用作BMP-2的替代品用于骨TE[31]。研究表明,将P24经氧化石墨烯(GO)修饰后(GO-p24)组装到SF/CS纳米纤维表面,避免了P24的局部快速扩散,促进了细胞的黏附[32]。最近,通过静电纺丝法制备了聚谷氨酸结合BMP-2肽(E7-BMP-2)修饰的SF/PCL纳米纤维膜,研究表明,脂肪组织源性干细胞(ADSCs)在E7-BMP-2肽修饰支架上具有良好的成骨分化能力[33]。
小分子也可以用作有效的骨诱导因子,因为它们的分子质量较低(<1000 Da),不会激发宿主的免疫反应,可以有效缓解使用蛋白质和多肽带来的难题[34]。例如,瑞舒伐他汀(RSV)是一种弱亲水性小分子药物,与其他他汀类药物如阿托伐他汀和辛伐他汀相比,在骨诱导方面表现出了巨大的潜力[35]。此外,添加荨麻(Urtica dioica L.,)这种成骨因子,增加了SF纳米纤维的直径,且以剂量依赖的方式促进了ALP、Runx2、Col I和OCN等成骨分化相关基因的表达,促进了hADSCs的成骨分化[36-37]。
5 展 望
大面积骨缺损严重影响人体美观、功能运动,骨TE成为修复治疗骨缺损的重要方法之一。电纺SF纳米纤维在形态结构和生物活性等方面具有可调性,比如与生物材料(如nHA)结合,形成复合支架,模仿天然骨骼环境,增加支架的成骨能力,这使它们成为骨TE应用优先考虑的候选材料。但是SF作为一种天然聚合物,其性质因来源而异,且不同的脱胶过程和制造方法以及电纺参数的控制都可能改变材料的性能。此外,尽管许多研究证实了SF纳米纤维膜在体内具有诱导成骨的潜力,但这些研究大多是在小动物模型上进行的,因此结果可能不能完全推广到人类使用。未来还需要进行更多的研究,以确定在临床试验中使用SF纳米纤维支架的安全性,并构建适合的用于骨组织再生的商业化产品。

