健康草莓体内可分离培养微生物的多样性
施宁雪 张烨 倪欢 韦永淑 靳晶豪 陈孝仁


摘要:研究草莓体内能够分离培养的微生物的群落组成和结构,对健康草莓稳态菌群的构建和保持具有重要意义。以健康草莓为研究样本,对其根、茎、叶内的真菌和细菌进行分离培养,分别利用真菌rDNA-ITS引物和细菌16S rRNA引物进行PCR扩增,然后基于测序及其生物信息学分析鉴定微生物种类。结果表明,从健康草莓根、茎、叶部获得了真菌1个门4个属中的14株菌株和细菌3个门6个属中的14株菌株,其中细菌内生菌的多样性高于真菌类群;3个器官中根部内生菌的多样性程度最高;芽孢杆菌(Bacillus)和葡萄孢属(Botrytis)是丰度较高的2个内生菌属。本研究初步明确了草莓不同部位可培养内生菌的分布特点和规律,为探索利用这些内生菌以促进草莓健康生长奠定了基础。
关键词:草莓;内生菌;根;茎;叶;多样性;促生作用
中图分类号:S668.401;S182文献标志码: A
文章编号:1002-1302(2021)07-0130-05
收稿日期:2020-07-27
基金项目:国家自然科学基金(编号:31671971、31871907);2016年度江苏高校青蓝工程项目;2018年度扬州大学“高端人才支持计划”(拔尖人才成长计划)。
作者简介:施宁雪(1996—),女,江苏南京人,硕士研究生,主要从事植物真菌病害研究,E-mail:whoilove1996@163.com;
共同第一作者:张 烨(1995—),男,江苏南通人,硕士研究生,主要从事植物真菌病害研究,E-mail:424396702@qq.com。
通信作者:陈孝仁,博士,教授,主要从事植物真菌病害研究。E-mail:xrchen@yzu.edu.cn。
内生微生物(endophytic microorganisms)是植物微生态系统的重要组成部分,是一大类能够在健康植物活组织内生存而不引起明显寄主植物病变的微生物,主要包括细菌、真菌、放线菌和病毒[1-4]。内生微生物一生或在生活史的某个阶段生活于植物活组织内,在长期的进化过程中与寄主植物建立了和谐联合的关系,是植物微生态系统中巨大而宝贵的资源库[5-6]。自20世纪90年代以来,植物内生微生物逐渐成为微生物学研究的热点,对它的认识逐渐深入。首先,内生微生物种类多样,最常见的是细菌、真菌和放线菌,亦被合称为内生菌(endophytes)。已经明确地球上所有科的植物都含有内生真菌[7]。其次,内生微生物不仅可以提高植物抗生物逆境(抗病、抗虫及其他食草动物)和抗非生物逆境能力,还可以帮助植物吸收磷、氮、硫及微量元素[8-9]。此外,内生菌能够降解环境中的有害污染物,具有生物修复能力[6]。
深入了解植物内生微生物,尤其是内生菌的种类、生活史、新陈代谢及其与寄主植物的相互关系,对其在农业上的应用具有重要意义。目前,尚不清楚植物内生菌的具体种类和数量。一般而言,不同地理环境下生长的植物具有的内生菌可能不一样。例如,高纬度地区的植物内生菌种类较少,且多来自子囊菌门;而热带地区植物的内生菌种类则更加丰富[10]。此外,在相似环境下生长的不同植物可能拥有不同的内生菌[11]。随着分子生物学技术的不断发展,利用高通量测序等技术分析微生物的核糖体RNA (rRNA)序列可对植物内生菌进行全面而快速的鉴定[12],微生物组学(microbiome)也应运而生。尽管如此,這些分子生物学手段未涉及到植物内生菌的分离培养,因此也就无法进行下一步的内生菌开发利用工作。
草莓是蔷薇科(Rosaceae)草莓属(Fragaria)的多年生草本植物,其果实酸甜可口、营养丰富,是一种具有较高经济价值的水果。目前,针对草莓的微生物组研究主要是围绕草莓根际土壤、果实表面或者叶片表面的微生物类群,针对其内生菌的研究报道很少,不利于草莓内生菌的开发利用[13-20]。开发利用植物内生菌,首要条件就是可以人工分离、培养这些微生物,以进一步分析其生活史、生理生化性状以及与植物的关系。有鉴于此,本试验从健康草莓的根、茎、叶不同部位分离内生真菌和细菌,并利用分子生物学技术进行快速鉴定,分析草莓不同部位内生菌的分布特点和规律,以期为探索利用这些内生菌以促进草莓健康生长奠定基础。
1 材料与方法
1.1 样品采集
2017年5月在江苏省扬州市施桥镇扬子村任桥露地草莓园(119°43′7.00′′E,32°31′7.00′′N)采集草莓品种章姬(Akihime)为试材。在无病田选取3处进行“S”形取样,共采集15株草莓,整株挖出,用无菌袋低温保存带回实验室。利用自来水冲洗掉植株根部和表面的土壤和残屑,再用无菌水彻底冲洗植株,晾干待用。
1.2 内生菌的分离
分离健康草莓根、茎、叶部的内生真菌和细菌。叶片取样分3个部位(从叶片边缘切取的约5 mm×5 mm的组织、主叶脉中间段2侧切取的约5 mm×5 mm 的组织、5~8 mm的叶柄中段)。根状茎取样分2个部位:韧皮部和木质部各取5 mm×5 mm的组织。根取样分3个部位进行:表皮、皮层和维管束各取5 mm×5 mm的组织。
1.2.1 内生真菌的分离 植物组织置于0.5%次氯酸钙溶液中消毒0.5~1 min,然后在无菌水中漂洗3次,晾干后置放在含0.5 μL/mL 96%乳酸的PDA平板(马铃薯200 g,葡萄糖16.0~20.0 g,琼脂16.0~20.0 g,蒸馏水1 000 mL)上。平板静置于霉菌培养箱(22±2) ℃内培养3 d,长出的菌丝尖端转入新的PDA平板。利用分生孢子进行菌株纯化,获得的单孢株保存于4 ℃。
1.2.2 内生细菌的分离 将植物组织用0.5%次氯酸钙消毒0.5~1 min,然后用无菌水冲洗3次,将组织块加入无菌水中捣碎制成悬浮液,然后吸取100 μL悬浮液用划线法涂布于NA固体培养基(牛肉浸膏3.0 g,蛋白胨5.0 g,NaCl 5.0 g,蒸馏水 1 000 mL,pH值7.0,琼脂16.0 g)上,晾干后将培养皿置于30 ℃条件下培养3 d,挑取单菌落进行划线纯化。
1.3 分子生物学鉴定
1.3.1 基因组DNA的提取 在PDA平板表面铺上灭菌的玻璃纸,将真菌菌株接种到玻璃纸上,置于25 ℃培养箱培养3~4 d,再利用金属铲收集玻璃纸上的菌丝。利用杭州爱思进公司基因组DNA试剂盒(AP-MN-MS-GDNA-250)提取菌丝的基因组DNA。
挑取细菌单菌落加入到含有5 mL KB培养液的试管中,30 ℃、200 r/min培养过夜。取1.5 mL菌液离心收集菌体,利用CTAB/NaCl法[21]提取细菌基因组DNA。
1.3.2 PCR扩增 利用细菌16S rDNA通用引物进行PCR扩增,引物序列为16S 33F:5′-ATGAGAGTTTGATCCTGGCTCAG-3′,16S 1387R:5′-TATTGGTGTGACGGGGGGTGT-3′。利用真菌rDNA-ITS (internal transcribed spacer,核糖体基因转录间隔区)通用引物进行PCR扩增,引物序列为ITS4:5′-TCCTCCGCTTATTGATATGC-3′,ITS5:5′-GGAAGGTAAAAGTCAAGG-3′。
PCR扩增体系:2 μL 1×PCR buffer、1.2 μL 25 mmol/L Mg2+、100~300 ng DNA、上下游引物(10 μmol/L)各1 μL、2 μL 2.5 mmol/L dNTPs、0.2 μL 5 U/μL Taq DNA聚合酶,无菌水补齐到 20 μL。PCR反应程序:94 ℃预变性5 min;95 ℃变性30 s,55 ℃复性30 s,72 ℃延伸 1 min,31个循环;72 ℃延伸5 min。PCR扩增产物经1%琼脂糖凝胶电泳检测后,通过胶回收、TA载体克隆,送往上海生工生物工程有限公司进行序列测定。
1.3.3 生物信息学分析 序列提交到NCBI数据库,进行BlastN比对,并登录GenBank。将获得的所有序列进行多重比对,再用MEGA7的Neighbor-Joining法构建系统发育树,采用自举法(bootstrap)对系统发育树进行检验,共1 000次循环,以保证系统树的可靠性。
2 结果与分析
2.1 菌株分离结果
本研究從健康草莓根、茎、叶这3个器官的8个部位采样,分成两等份分别进行细菌和真菌的分离,最后共获得14株真菌菌株和14株细菌菌株(表1)。其中,来自叶片的真菌菌株有8株,细菌菌株有5株;来自茎的真菌菌株有1株,细菌菌株有4株;来自根部的真菌和细菌菌株各有5株。菌株数目的不同可能与不同器官分离的部位数量有一定关系。
2.2 属水平上内生菌的多样性
对细菌菌株的16S rDNA、真菌菌株的rDNA-ITS序列进行扩增、克隆与测序,获得了长度分别为1 455~1 519、563~615 bp的片段序列, 提交GenBank进行登记(表1)。基于这些序列在NCBI数据库中的比较,将菌株鉴定到属或者种水平。由表1可知,分离获得的真菌菌株来自真菌界的4个属:葡萄孢属(Botrytis)、枝穗霉属(Clonostachys)、新拟盘多毛孢属(Neopestalotiopsis)和小不整球壳属(Plectosphaerella)。分离获得的细菌菌株来自原核生物界的6个属:芽孢杆菌属(Bacillus)、新鞘氨醇杆菌属(Novosphingobium)、葡萄球菌属(Staphylococcus)、类芽孢杆菌属(Paenibacillus)、假单胞菌属(Pseudomonas)、微杆菌属(Microbacterium)。细菌的多样性高于真菌。
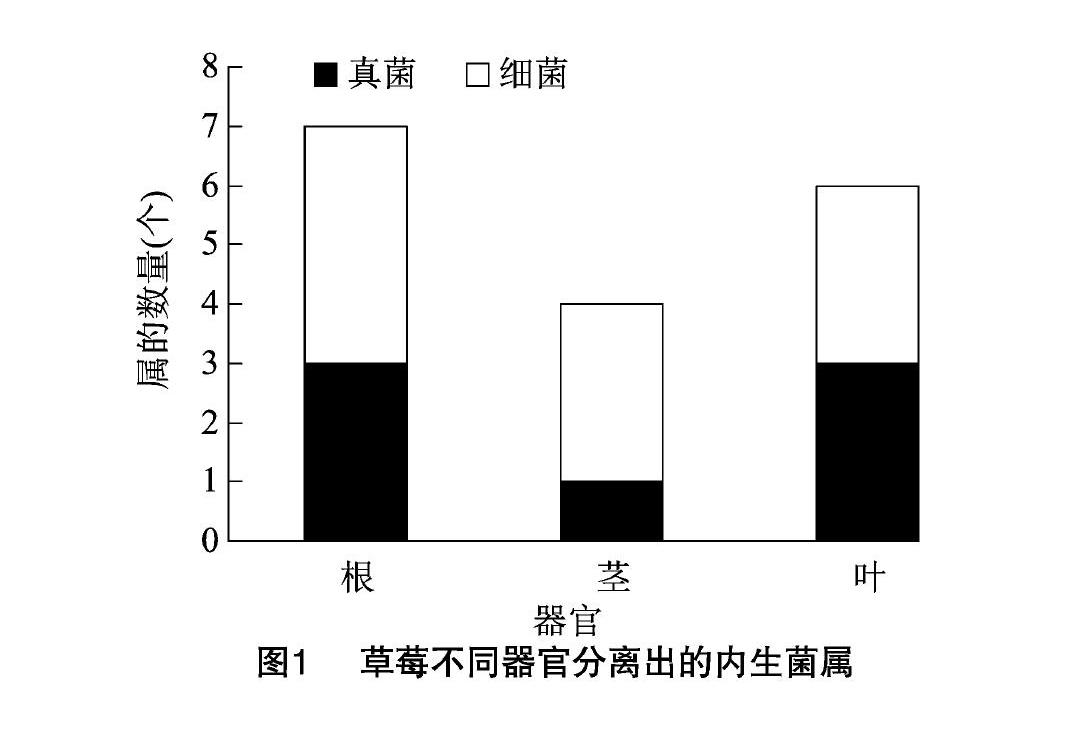
进一步对分离的菌株进行分析,发现草莓不同部位中可培养内生菌在属水平上呈现出多样性的特点。按照内生菌多样性的丰富度从高到低排列,根部>叶部>茎部。其中,根部分离出3个属的真菌和4个属的细菌,多样性程度最高(图1)。
在分离的真菌类群中,获得葡萄孢属菌株的比例最高,达到43% (6/14);其次是枝穗霉属,分离比为36%。在细菌类群中,芽孢杆菌属出现的频率最高,达到43%;其次是新鞘氨醇杆菌属,分离比为21%。真菌中1个属、细菌中3个属各分离获得1株菌株,代表性最低(图2)。
2.3 属以上阶元内生菌的多样性
对获得的内生菌进行进一步的分类阶元梳理,结果(表2)发现,真菌内生菌均来自真菌界子囊菌门(Ascomycota),而细菌来自原核生物界的3个门:厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria);在纲(Class)水平上,真菌来自2个纲:锤舌菌纲(Leotiomycetes)和粪壳菌纲(Sordariomycetes),细菌则来自4个纲:芽孢杆菌纲(Bacilli)、α-变形菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)和放线菌纲
(Actinobacteria)。可见,在高级分类阶元上细菌内生菌的多样性也高于真菌类群。
3 讨论
植物内生微生物定殖于健康植物体内,与寄主植物在长期进化过程中形成了和谐共生的关系,对寄主植物具有防病、促生、固氮和生物修复等生物学作用,具有广泛的应用价值[4,11]。目前,内生细菌和真菌不仅应用于植物病虫害的生物防治,还用来促进植物生长[8-9,22]。深入了解植物内生菌资源,是其开发利用中的重要一步。草莓作为一种重要的作物,2018年在世界范围内的种植面积约为 37万hm2,产量约为834万t(世界粮农组织,http://www.fao.org/faostat/)。目前并不清楚草莓内生微生物,尤其是细菌和真菌的种类以及分布情况。已有的关于草莓微生物组的研究主要是调研草莓根际土壤、果实或者叶片表面的微生物类群,针对其内生菌的研究报道很少,影响了草莓内生菌的开发利用[13-20]。针对该问题,本研究同时对草莓根、茎、叶3个部位的内生菌进行分离纯化,获得了真菌界子囊菌门4个属中的14株菌株、原核生物界3个门6个属中的14株菌株。这是首次分析草莓不同器官内生菌(真菌和细菌)的分布特点,为下一步分析内生菌的侵染定殖规律、生物学性状及其开发利用奠定了基础。
目前,分子生物学技術已应用于植物内生菌种类的分析研究。直接以植物组织中提取的总DNA为材料,通过构建文库、测序等方法可获得内生菌的种类信息[4]。这些方法不需要对内生菌进行分离培养,减少了复杂的分离过程,而且其高通量测序可快速、全面地了解植物内生菌多样性的真实水平。但是,尽管用分子手段得到的植物内生菌的多样性较为丰富,然而植物内生菌的开发利用仍然离不开对内生菌的定殖、生理生化性状以及寄主植物和其他微生物的相互作用等方面的认识,这必然要求首先要获得可人工培养的内生菌菌株以进行相关研究。例如,Marian等从草莓组织中分离获得了226个放线菌菌株,利用离体叶片分析试验最终筛选出一株能够抑制草莓炭疽病的菌株MBFA-172;在随后的温室防控试验中,该菌株显示出类似于杀菌剂甲基代森锌的防控效果,表明该菌株具有作为草莓炭疽病生防制剂的应用潜力[20]。当然,分离培养的方法也存在一定的局限性。首先,由于难以模拟一些内生菌的生长条件而不能获得其纯培养,导致内生菌多样性被低估;其次,分离内生菌时对植物组织表面的消毒以及消毒时长可能会影响内生菌调查的准确性;再次,分离时所选用的培养基以及所用抗生素、乳酸等对内生菌的数量和种类也存在一定的影响[8]。这些问题需要在后续的研究中加以思考。结合分子生物学技术,对传统分离培养方法进行优化调整,有助于解决这些问题。
研究发现,不同的寄主植物拥有不同的内生菌,植物不同器官内生菌的分布也存在较大差异。现有研究表明,根内生细菌数量远远超过其他植物器官的内生细菌,具有寄主植物多样性和种属多样性特征,这是多种生物因素和非生物因素共同作用的结果[1,22]。本研究从根部分离出3个属的真菌和4个属的细菌,其多样性程度高于叶和茎部;进一步发现,芽孢杆菌属(Bacillus)是细菌类群中丰度最高的属。这与大豆、玉米、小麦、水稻、马铃薯等多种作物的组织中分离的结果[23]一致。
本研究发现,健康的草莓体内也携带有多种病原真菌,如灰葡萄孢(Botrytis cinereal)、新拟盘多毛孢属(Neopestalotiopsis)和小不整球壳属(Plectosphaerella)。灰葡萄孢是一种典型的死体营养型病原真菌,寄主范围很广。研究发现,在多花报春(Primulax polyantha)的幼苗上接种灰葡萄孢,一般在植株开花之前不会表现出症状;附着在种子表面的灰葡萄孢孢子侵入植物体内后可以在莴苣体内生长,但不引起症状;入侵植物矢车菊(Centaurea stoebe)中也发现了内生性生长的灰葡萄孢[24-26]。可见,植物病原真菌在植物体内进行内生性生长的现象是普遍存在的,也许可以将它们视为一类特殊的“内生真菌”;但在特定条件下,尤其是植物的抗性受到削弱时,它们就会促使植物产生症状[9]。
本研究采用传统的病菌分离方法从健康草莓根、茎、叶部获得了真菌1个门4个属中的14株菌株和细菌3个门6个属中的14株菌株,其中细菌内生菌的多样性高于真菌类群;3个器官中根部内生菌的多样性程度最高;芽孢杆菌(Bacillus)和葡萄孢属(Botrytis)是丰度较高的2个内生菌属。本研究分析了草莓体内可培养真菌和细菌的分布情况、菌群结构及生物多样性间的差异和丰富度,为草莓内生菌的开发利用奠定了基础。
参考文献:
[1]Hallmann J,Quadt-Hallmann A,Mahaffee W F,et al. Bacterial endophytes in agricultural crops[J]. Canadian Journal of Microbiology,1997,43(10):895-914.
[2]Bao X,Roossinck M J. Multiplexed interactions:viruses of endophytic fungi[J]. Advances in Virus Research,2013,86:37-57.
[3]Stepniewska Z,Kuzniar A. Endophytic microorganisms-promising applications in bioremediation of greenhouse gases[J]. Applied Microbiology and Biotechnology,2013,97:9589-9596.
[4]Müller D B,Vogel C,Bai Y,et al. The plant microbiota:systems-level insights and perspectives[J]. Annual Review of Genetics,2016,50:211-234.
[5]Wilson D. Endophyte:the evolution of a term,and clarification of its use and definition[J]. Oikos,1995,73(2):274-276.
[6]鲍 敏,康明浩. 植物内生菌研究发展现状[J]. 青海草业,2011,20(1):21-25.
[7]Martinez-Klimova E,Rodríguez-Pea K,Sánchez S. Endophytes as sources of antibiotics[J]. Biochemical Pharmacology,2017,134:1-17.
[8]何玲敏,叶建仁. 植物内生细菌及其生防作用研究进展[J]. 南京林业大学学报(自然科学版),2014,38(6):153-159.
[9]姜道宏. 植物内生真菌及其展望[J]. 中国生物防治学报,2015,31(5):742-749.
[10]Arnold A E,Lutzoni F. Diversity and host range of foliar fungal endophytes:are tropical leaves biodiversity hotspots[J]. Ecology,2007,88:541-549.
[11]Wani Z A,Ashraf N,Mohiuddin T,et al. Plant-endophyte symbiosis,an ecological perspective[J]. Applied Microbiology and Biotechnology,2015,99(7):2955-2965.
[12]王 瑫,李 永,朱天辉,等. 植物内生细菌及其研究方法[R]. 成都:中国医学科学院医药生物技术研究所,2012.
[13]魏 超,郭灵安,胡 莉,等. 草莓表面农药残留检测及其对微生物群落影响[J]. 西南农业学报,2014,27(6):2534-2538.
[14]赵 帆,赵密珍,王 钰,等. 不同连作年限草莓根际细菌和真菌多样性变化[J]. 微生物学通报,2017,44(6):1377-1386.
[15]Yokoya K,Postel S,Fang R,et al. Endophytic fungal diversity of Fragaria vesca,a crop wild relative of strawberry,along environmentalgradientswithinasmallgeographicalarea[J].
PeerJ,2017,5:e2860.
[16]戴宝玲,肖英平,戴贤君,等. 基于Illumina高通量测序技术分析草莓表面微生物结构[J]. 江苏农业科学,2018,46(20):25-28.
[17]赵 帆,赵密珍,王 钰,等. 基于高通量测序研究草莓根际微生物群落结构和多样性[J]. 土壤,2019,51(1):51-60.
[18]王廷峰,赵密珍,关 玲,等. 江苏省不同区域草莓连作土壤养分及微生物区系分析[J]. 果树学报,2019,36(1):86-93.
[19]杨俊誉,魏世杰,苏代发,等. 温室中患白粉病与健康草莓植株根际原核生物群落的比较研究[J]. 西南农业学报,2020,33(1):85-91.
[20]Marian M,Ohno T,Suzuki H,et al. A novel strain of endophytic Streptomyces for the biocontrol of strawberry anthracnose caused by Glomerella cingulate[J]. Microbiological Research,2020,234:126428.
[21]王振荣. 慈溪杨梅病害调查及主要病原种类鉴定與病害防治[D]. 扬州:扬州大学,2013.
[22]喻 江,于镇华,刘晓冰,等. 植物根组织内生细菌多样性及其促生作用[J]. 中国农学通报,2015,31(13):169-175.
[23]Schulz B J,Boyle C J,Sieber T N,et al. Microbial root endophytes [M]. Berlin:Springer,2006.
[24]Barnes S E,Shaw M W. Factors affecting symptom production by latent Botrytis cinerea in Primulax polyantha[J]. Plant Pathology,2002,51:746-754.
[25]Sowley E N K,Dewey F M,Shaw M W. Persistent,symptomless,systemic,and seed-borne infection of lettuce by Botrytis cinerea[J]. European Journal of Plant Pathology,2010,126(1):61-71.
[26]Shipunov A,Newcombe G,Raghavendra A K H,et al. Hidden diversity of endophytic fungi in and invasive plant[J]. American Journal of Botany,2008,95(9):1096-1108.

