基于深度学习与功能磁共振的人工智能前列腺癌诊断效能
李凌昊,胡怡音,孟广明,黄子丹,李致勋,姜建
1.南昌大学第一临床医学院,江西南昌 330027;2.南昌大学第一附属医院影像科,江西南昌 330006;3.南昌大学信息工程学院,江西南昌 330031;*通讯作者 姜建 jij2002cn@126.com
前列腺良性增生与前列腺癌是中老年男性的常见疾病,我国前列腺癌发病率较高,且呈逐年上升趋势[1]。常见的前列腺癌临床诊断主要包括直肠指检、前列腺特异性抗原(prostate-specific antigen,PSA)检测及穿刺活检。直肠指检通过临床医师指触的方式判断前列腺体积大小,适用于初步诊断;PSA 水平易受炎症影响,多次穿刺容易造成组织损伤。因此,尽管后两者诊断前列腺癌准确度较高,但仍存在误差或不足。
多功能磁共振成像发展迅速,为前列腺癌的诊断提供了有效的影像学途径。扩散加权成像(DWI)主要反映组织内水分子的运动信息,进而提示阳性组织区域,对前列腺癌的诊断有较高的参考价值,是目前临床常用的诊断方法[2]。
近年提出多个人工智能癌症诊断与辅助检测系统及模型,相关研究与实验证明人工智能在图像识别上具有一定的优势[3-5]。深度学习由Hinton 等[6]于2006年首次提出,是一种基于无监督学习和特征层次结构的学习方法,在图像的归类分类、语音辨识等多个领域均有较好的表现[7]。卷积神经网络(convolutional neural networks,CNN)是一个多层神经网络,具有强鲁棒性和容错能力,易于训练和优化[8]。残差网络(residual network,ResNet)是He 等[9]提出的一类CNN,通过在每2 层增加1 个运算通道,构成1 个残差块,达成全网络的跳跃连接,回避了由于各层参数过小且相乘导致的梯度下降问题与网络退化问题[10]。
本研究拟对人工智能在DWI 与表观扩散系数(ADC)图像诊断上的效能进行研究,对2 种模型与图像的组合进行评估,并利用ADC 图像对ResNet 的定性分析能力进行测试。
1 资料与方法
1.1 仪器与方法 采用西门子1.5T MR 系统,患者取仰卧位,扫描范围从髂棘扫描到耻骨联合下缘。DWI采用快速自旋回波序列,视野180 mm×200 mm,层厚4 mm,层距1,TR 4100 ms,TE 91 ms,矩阵256×256,b 值取0、800、1600 s/mm2。由b=800 s/mm2自动后处理重建ADC 图像。
1.2 数据处理 共收集1.5T MR 病例112 个,其中经过病理诊断为前列腺癌52 个,病理结果阴性60 个。删去伴有炎症及影像特征不典型的图像,其余图像由3 名影像科医师进行人工标记,标注阳性特征范围,由1 名泌尿系统影像学诊断专家审核,共处理阳性ADC 与DWI(b 值取1600 s/mm2)图像各251 张。使用全部阳性图片作为分割实验训练集。选用训练集样本图片320 张(阳性120 张,阴性200 张),测试组样本图片98 张(阳性22 张,阴性76 张)对ResNet通过ADC 图像诊断前列腺癌性能进行测试。人工组由2 名影像科医师组成,对同组影像测试数据进行判断。使用人工勾画区域为“金标准”,对分割结果使用交并比指标评价分割性能;对定性诊断结果使用交叉熵计算每个样本的置信度。
1.3 统计学方法 使用SPSS 22.0 软件,绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC), 并判断最佳临界点。P<0.05 表示差异有统计学意义。
2 结果
2.1 CNN 分割性能测试 将上述数据作为训练集输入CNN 进行训练。使用测试集进行分割性能测试。测试准确曲线见图1,图像趋势明显,且未出现明显的震荡现象,ADC 与DWI 图像准确度分别为61.34%和57.35%。

图1 CNN 学习测试曲线
2.2 ResNet 分割性能测试 选用具有深度学习特性的ResNet 网络进行训练,并对其性能进行测试(图2)。由图2 可见,曲线趋势明显,未出现过拟合与震荡现象。测试准确度分别为60.05%、63.08%。同时发现ResNet 图像在细节精度上明显高于CNN,图3 为同一测试图像的分割结果,ResNet 图像在边界分割上明显优于CNN,且对有不同信号特点的前列腺正常组织结构做出了一定的区分。对于转移性癌组织区分,2 种模型分割图像效果均不甚理想,对癌症区域勾画较为准确,但无法区分是否为前列腺区域,如出现盆底肌转移(图4)。
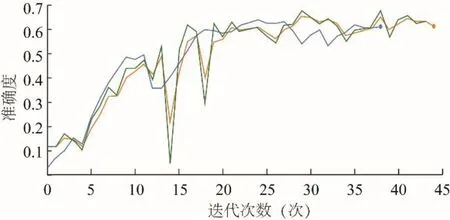
图2 ResNet 学习测试曲线
2.3 基于ResNet-ADC 区域分割的前列腺癌诊断 模型检出22 张阳性样本中的12 张,76 张阴性样本中的56 张,诊断准确度、敏感度和特异度分别为69.39%、54.50%和73.68%。人工组22 张阳性样本全部检出,76 张阴性样本检出71 张。根据人工智能判断数据绘制ROC 曲线(图5),AUC 为0.782。根据图像所得最佳阈值为50.1%,此时模型准确度达90.9%。
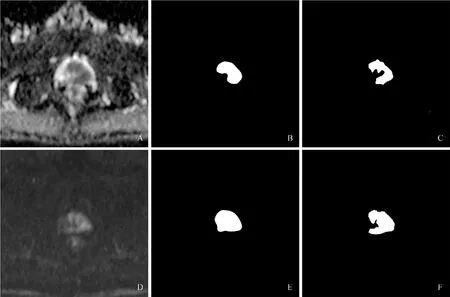
图3 男,61 岁,前列腺腺癌(Gleason 评分3+4=7 分)。A 为ADC 图像,中心低信号区域为阳性区域;B 为CNN 勾画ADC区域;C 为ResNet 勾画区域;D 为同层面DWI(b=1600 s/mm2)图像;E 为CNN 勾画DWI 区域;F 为ResNet 勾画区域
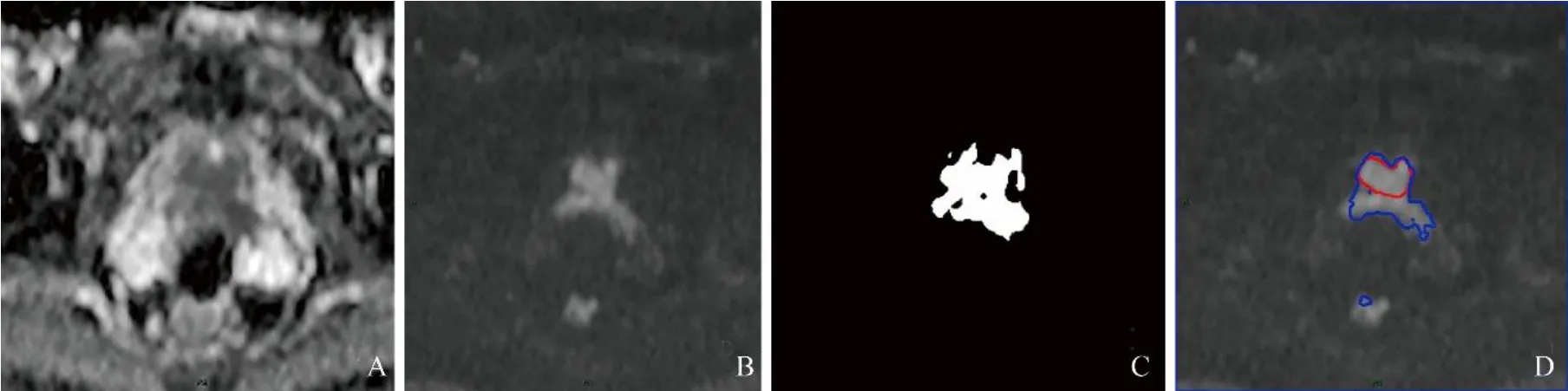
图4 男,72 岁,前列腺腺癌(Gleason 评分4+4=8 分)。A 为1例有直肠转移的前列腺癌ADC 图像;B 为同层面DWI 图像;C 为CNN 勾画区域;D 中红色区域为人工组勾画区域,蓝色为ResNet 勾画区域
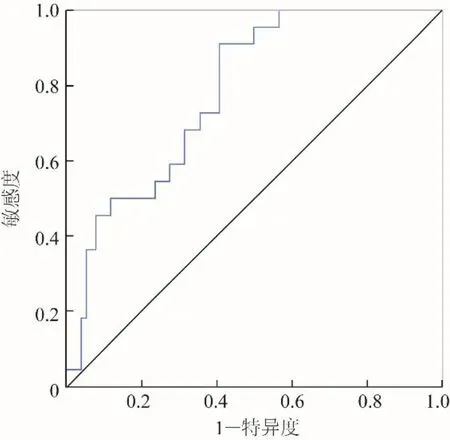
图5 根据ResNet模型测试样本置信度绘制ROC曲线
3 讨论
目前应用较广的、准确性较高的前列腺癌诊断方法主要有PSA检测、直肠超声引导病理穿刺和MRI。临床上运用最广的是PSA,其具有极高的组织特异性,但敏感度高而特异性低。直肠超声穿刺活检是目前诊断前列腺癌的“金标准”,但在敏感度与准确度上仍存在一定的局限性[11]。传统MRI主要通过T2、ADC与DWI联合使用进行诊断,能获得较上述3种方法更清晰、准确的病灶,但在实际工作中,由于增生与移行区本身组织特点造成的复杂信号影,其对病灶的定位仍有一定的不足。
人工智能影像诊断已在胶质瘤、心血管疾病、肺结节、乳腺癌等多个领域有所突破[12-15]。与传统的人工诊断相比,较成熟的人工智能诊断与分割优势在于:①在图像特征如明暗度、图像对比度等方面,人工智能的识别能力强于人眼识别;②回避了由于影像医师经验、熟练度、疲劳等主观因素造成的误诊率;③数字信息存储便于开展不同区域、不同领域的案例、数据交流合作。
本实验勾画的病例中含有位于移行区与外周带的癌灶,且包括多个分级。分别使用CNN与ResNet学习图像特征并进行分割测试。结果显示,2个模型在ADC图像分割上准确率相近,ResNet的DWI分割准确率较CNN有一定的提高,提示尽管ADC与DWI图像存在关联性,但在训练模型价值上或仍存在一定的差异。基于ResNet-ADC区域分割的前列腺癌诊断调试至最佳阈值后,人工智能整体准确率也可提升到较高水平。
本研究发现,深度学习网络在MRI前列腺癌病灶分割上显示出较大优势,国内外亦有多种思路与模型对此类问题进行讨论与研究。Yan等[16]提出的传播深度学习网络,可以将多级特征提取的最佳组合纳入一个模型中。使用的30个MR测试集样本表现出较高的鲁棒性与准确率。To等[17]利用T2与ADC图像构建的3D深密集多径CNN分割、鉴别前列腺癌,在2个独立测试集中分别实现了95.11、89.01的Dice系数。本研究采用对大数据更为敏感的、建模较为成熟的CNN与ResNet深度学习模型,选用临床工作常用扫描序列,结果有较强的可应用性。
本研究尝试在预处理步骤中,对ADC图像与DWI图像进行对比度调整并组合。但对于新生成的图片,阳性区域的认定、特征代表的临床意义、诊断价值等问题尚未取得统一的意见与建议。而对于T2图像与ADC或DWI的拟合,除存在上述问题外,由于扫描平面稍不同,还存在图像对齐问题亟需解决。本研究着重实验分析了ADC与DWI(b=1600 s/mm2)的结果,但对同切面T2图像亦进行了实验,结果差强人意,分析其主要原因为:①与ADC及DWI相比,T2图像的癌区域具体范围更难标记,尤其是移行区的癌变边界,人工标记精度存在较大波动。②T2图像下,前列腺内部各区域信号值差异更为明显,需要提取,学习的特征更多。因此对训练集样本数目与质量均提出了更高的要求。
总之,深度学习网络在前列腺癌病灶分割和定性分析上均显示出较大的优势,具有一定的临床实用性。

