非酒精性脂肪性肝炎伴糖代谢异常与血浆同型半胱氨酸相关性的临床观察
朱瑛珲,郭莲怡,吴贺明,李晓飞
(1.锦州医科大学附属第一医院,辽宁 锦州 121000;2.解放军968医院朝阳院区,辽宁 朝阳 122000)
非酒精性脂肪肝疾病(non-alcoholic fatty liver disease,NAFLD)是一种慢性肝脏疾病,表现出一系列肝脏病理改变,包括肝脏脂肪变性,非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH),肝纤维化和肝硬化,NAFLD进展到NASH可大大增加肝硬化、肝衰竭及肝细胞癌的风险。NASH的确切发病机制目前尚未明确,其中胰岛素抵抗可致肝细胞脂肪酸代谢失衡,并导致肝脏进一步脂肪变性[1]。在胰岛素抵抗状态下,胰岛素介导的抑制白色脂肪组织脂解和肝糖异生等作用受到损害,从而可导致2型糖尿病(type 2 diabetes mellitus,T2DM)[2]。
同型半胱氨酸(homocysteine,Hcy)是一种含硫氨基酸,肝脏在Hcy的代谢中起着重要的作用。据流行病学显示,慢性肝病患者的T2DM发病率较高,而T2DM占全球糖尿病人口的90%,占全球每年因健康和社会经济问题而死亡的9%[3],T2DM可导致周围神经病变、肾病及心血管疾病等一系列并发症。研究表明,Hcy是与T2DM心血管等并发症密切相关的危险因素,高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)可加重胰岛素抵抗[4],故控制危险因素比控制血糖能更好地减少T2DM的发生及发展。本文旨在探讨NASH伴糖代谢异常患者与Hcy的关系,为NASH伴糖代谢异常患者的诊断、预防和治疗提供线索。
1 资料与方法
1.1 研究对象与分组
选取2018年10月至2020年1月于锦州医科大学附属第一医院住院的非酒精性脂肪肝炎伴糖代谢异常的男性患者资料211为研究组(同型半胱氨酸男女参考值范围不同,为了便于统计分析,故本研究只针对男性患者进行分析),根据空腹血糖水平分为4组:单纯NASH组(A组)52人,空腹血糖调节受损组(B组)51人,糖耐量减低组(C组)55人,糖尿病组(D组)53人,以同期健康体检者50例为对照组。
1.2 纳入与排除标准
1.2.1 纳入标准
符合2014年9月世界胃肠病学会全球指南关于非酒精性脂肪性肝病及非酒精性脂肪性肝炎的诊断标准[5]:(1)肝活组织检查存在脂肪性肝炎;(2)B超检查显示弥漫性脂肪性肝病变;(3)无酒精依赖史,每周酒精摄入量<40 g;(4)认知功能正常;(5)排除伴有自身免疫性肝炎、妊娠或哺乳期妇女等。
糖代谢状态分类符合1999年世界卫生组织(WHO)糖尿病诊断及分型标准[6]:(1)空腹血糖调节受损:FPG 6.1~7.0 mmol/L,2 h PG<7.8 mmol/L;(2)糖耐量减低:FPG<7.0 mmol/L,2 h PG 7.8~11.1 mmol/L;(3)糖尿病:FPG≥7.0 mmol/L,2 h PG≥11.1 mmol/L;(4)所有研究对象年龄<75周岁;(5)健康体检者为既往体健,无肝脏及其他系统疾病,体检中辅助检查包括肝脏彩超,且结果正常。
1.2.2 排除标准
(1)酒精性肝病者;(2)严重心、肺、脑、肾及血液系统等重要脏器疾病者;(3)正在服用叶酸,硫酸亚铁、B族维生素及利尿剂者;(4)病毒性肝炎、全胃肠外营养、肝豆状核变性、药物性肝病等可导致脂肪肝的特定疾病;(5)1型糖尿病患者或其他特殊类型糖尿病;(6)合并各种急、慢性感染者。
1.3 研究方法
1.3.1 资料收集及指标测定
收集患者的年龄、性别、体重指数(BMI)、吸烟史、高血压病史等资料,清晨抽取空腹静脉血,检查Hcy、谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein,HDL)、低密度脂蛋白胆固醇(low density lipoprotein,LDL)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、空腹血糖(fasting blood-glucose,FBG)、空腹胰岛素(fasting insulin,FINS)、同型半胱氨酸(homocysteine)等。
1.3.2 计算
胰岛素抵抗指数(index of insulin resistance,HOMA-IR)=空腹血糖×空腹胰岛素/22.5;体质指数(body mass index,BMI)=体重/身高2(kg/m2)。
1.4 统计学处理

2 结 果
5组间HDL逐渐降低,各组间比较均有统计学差异(P<0.05);5组间ALT、AST、GGT、TG、TC、HDL、LDL、HbA1c(%)、FINS、BMI、Hcy 逐渐升高,各组间比较均有统计学差异(P<0.05);IFG组、IGT组、DM组HDL、LDL、BMI、HOMA-IR、Hcy明显高于对照组,比较有统计学差异(P<0.05),单纯NASH组、IFG组、IGT组、DM组的ALT、AST、GGT、FINS比较无统计学差异,见表1。

表1 5组生化指标、BMI、HOMA-IR及Hcy水平比较
Pearson相关性分析结果如下所示,所有变量均与Hcy有显著相关性,ALT与Hcy的相关系数为0.822呈显著正相关,见表2。
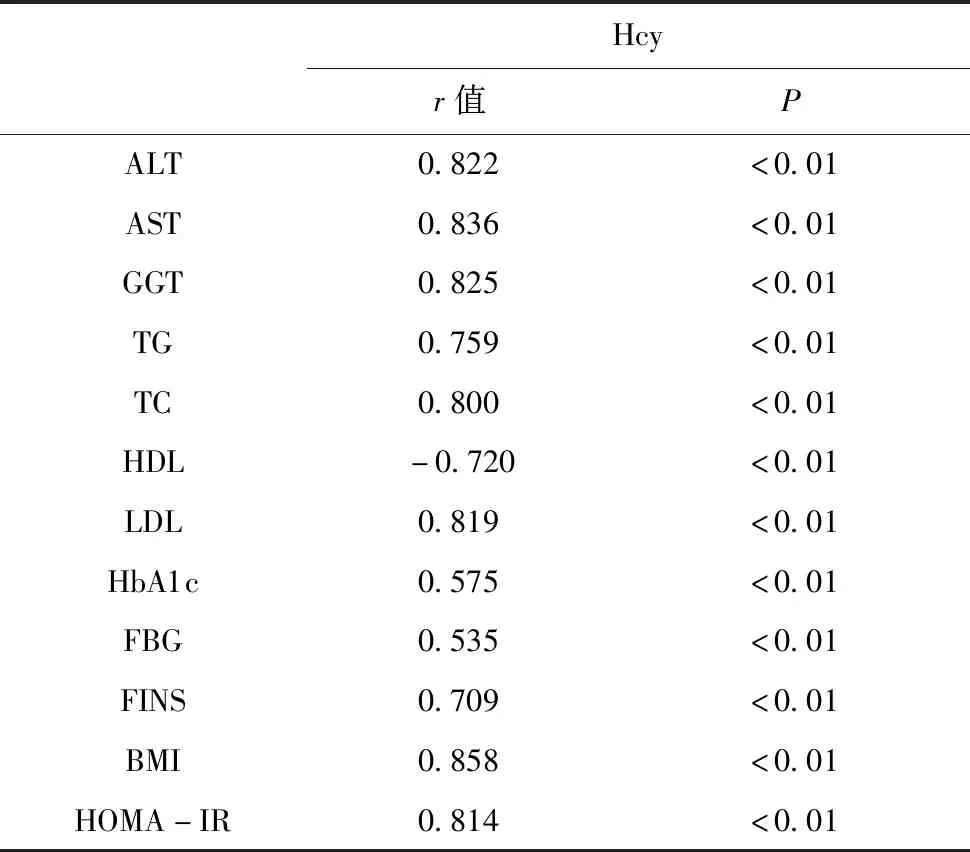
表2 同型半胱氨酸与生化指标、BMI、HOMA-IR的相关分析
多元逐步回归结果如下所示,最终筛选的变量包括:BMI、LDL、TC、FBG、TG,其中BMI、LDL对Hcy的影响最为显著,见表3。
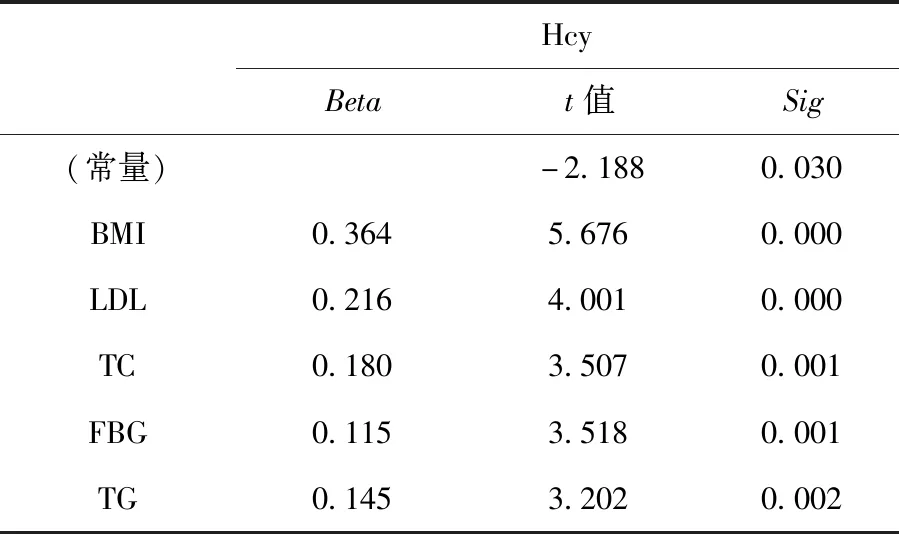
表3 多元逐步回归分析影响同型半胱氨酸水平的因素
对单纯NASH组和IFG组进行二分类logistic回归分析,得出Hcy、BMI、TC、HOMA-IR是独立危险因素(OR>1,置信区间下限均大于1,P<0.05),见表4。

表4 Hcy、TG、BMI、TC、HDL、HOMA-IR的logistic回归
3 讨 论
糖尿病患病率的增加将会不可避免地导致糖尿病相关并发症的发病率增加,如视网膜病变、神经病变、心血管疾病等一些微血管和大血管疾病。大量研究表明,仅针对高血糖并不能降低糖尿病的风险,这就强调了对其他危险因素进行积极治疗的必要性。2型糖尿病(T2DM)之前会有一段时间血糖调节功能受损,糖尿病前期是T2DM未来发展的主要危险因素。此外,其他危险因素,如T2DM家族史,或妊娠糖尿病、多囊卵巢综合征(PCOS)、非酒精性脂肪性肝病(NAFLD)、肥胖等个人病史,可显著增加T2DM的发病风险[7]。肝脏是葡萄糖代谢的重要器官,T2DM和NAFLD通常并存于这两种疾病之间的联系是胰岛素抵抗,来自日本的队列研究报告,NAFLD在基线时与2型糖尿病发生风险增加2.37倍相关,独立于常见危险因素[8]。NASH患者有潜在的葡萄糖耐受不良,在NASH患者中,胰岛素抵抗是2型糖尿病最重要的危险因素。本文在NASH患者中也得出了与上述一致的结论:各组与对照组的BMI、HOMA-IR、HbA1c(%)、FBG、FINS、HDL、LDL均与有统计学差异(P<0.05),且NASH合并IFG组、NASH合并IGT组、NASH合并DM组的HOMA-IR依次递增,差异有统计学意义(P<0.05)。
近期大量研究明确表明,Hcy可促进炎症和动脉粥样硬化,从而增加心血管疾病和死亡的风险。与一般人群相比,这种关系在糖尿病患者中似乎更强。因此,糖尿病的现代治疗方案应有效地优化血糖控制,并通过改变危险因素包括高同型半胱氨酸水平来预防血管并发症[9]。肝脏在Hcy的产生和代谢中起着重要作用,而目前关于Hcy与NAFLD以及T2DM的关系报道甚少。本研究发现,NASH患者的Hcy水平明显高于对照组,差异有统计学差异(P<0.05),且在NASH患者中,IFG组、IGT组、DM组的Hcy水平呈递增趋势,各组间对比均有统计学差异(P<0.05);经Person相关系数分析,ALT、AST、GGT、TG、TC、LDL、HbA1c、FBG、FINS、BMI、HOMA-IR均与Hcy呈显著正相关,HDL与Hcy呈显著负相关;多元逐步回归分析结果显示,BMI、LDL对Hcy的影响最为显著。对A组和B组进行二分类Logistic回归分析,得出Hcy、BMI、TC、HOMA-IR是独立危险因素(OR>1,置信区间下限均大于1,P<0.05)。其可能的机制为:(1)Hcy是一种非蛋白质含硫氨基酸,由蛋氨酸代谢形成,通过再甲基化和转硫化分解,主要在肝脏中进行。肝脏在Hcy的代谢中起着重要作用,它与丝氨酸浓缩,在分离水分子和胱氨酸-多合酶(维生素B6依赖的酶),它产生胱氨酸。同时,胱氨酸在胱氨酸酶(维生素B6依赖酶)的作用下分解为高丝氨酸和半胱氨酸。在高丝氨酸脱氨酶的作用下,从高丝氨酸中分离出氢氧化铵和硫化氢,使高丝氨酸转化为α-酮丁酸,同型半胱氨酸的一部分可以氧化成同型半胱氨酸,蛋氨酸可能由同型半胱氨酸和甲基四氢叶酸重新合成[4]4146-4151;(2)高同型半胱氨酸血症(HHcy)是一种以高水平的同型半胱氨酸为特征的疾病,它是一种炎症因子,会促进胰岛素抵抗。Hcy水平的升高导致活性氧(reactive oxygen spercies,ROS)的破坏性发生作用,导致胰岛素分泌反应下降,致胰岛素抵抗。另外,有研究表明,高同型半胱氨酸血症(HHCY)通过在脂肪组织中诱导内质网应激来抑制胰岛素敏感性,HHCY还加重了胰岛素抵抗,继而增加了脂肪细胞中抵抗素的产生[10];(3)同型半胱氨酸通过抑制LXR -ABCA1/ABCG1途径,激活PCSK9,促进动脉粥样硬化斑块和泡沫细胞的形成。高同型半胱氨酸血症可引起内皮功能障碍,并与血小板和血栓的激活有关[11];(4)有报道称高同型半胱氨酸血症改变细胞内脂质代谢,脂质代谢失衡和胰岛素抵抗引起的肝脂质蓄积,同时胰岛素抵抗除了具有促进肝脏脂肪生成的能力外,还参与氧化应激的发展,并有助于高活性氧(ROS)水平[12]。氧化应激可促进NASH中的坏死性炎症。对于NASH患者,应评估胰岛素抵抗和T2DM的风险。早期干预胰岛素抵抗,预防NASH患者发展为T2DM等其他代谢性疾病。
综上所述,Hcy是NASH合并糖代谢异常的患者一项独立的危险因素,并与BMI、ALT、AST、TG、HDL、LDL水平具有相关性。NASH患者有潜在的糖耐量受损以及发展为T2DM的风险,及时检测Hcy浓度可对NASH患者发展为T2DM起到一定的警示作用,通过改善生活方式如健康饮食、适量运动,或药物治疗如服用维生素B6、B12及叶酸等可有效降低Hcy浓度,缓解高同型半胱氨酸血症导致的T2DM等代谢综合征以及相关并发症,必要时需要适当的胰岛素抵抗治疗。故早期针对高同型半胱氨酸血症的干预,有助于降低NASH患者合并T2DM的风险。

